单核细胞增生李斯特菌对食品加工中的胁迫响应及其机制研究进展
2021-09-27孙海磊董鹏程毛衍伟梁荣蓉杨啸吟张一敏朱立贤
孙海磊,董鹏程,毛衍伟,梁荣蓉,杨啸吟,张一敏,*,朱立贤,*,罗 欣,2
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
单核细胞增生李斯特菌(Listeria monocytogenes)(以下简称单增李斯特菌)是一种人畜共患的病原菌,其引起的死亡率高达20%~30%,在20世纪90年代被世界卫生组织(World Health Organization,WHO)列为世界第四大食源性致病菌[1-2]。微生物的生长繁殖是通过与外界环境(水分、氧气、温度、酸碱性等)发生相互作用而进行的,如果环境发生改变,就会对微生物造成环境胁迫,而在食品加工过程中所采用的酸喷淋、加热、冷藏、腌制等加工处理方法均会对微生物形成环境胁迫[3-4]。
单增李斯特菌对于食品加工过程中的环境胁迫具有很强的抵抗能力,Almeida等[5]报道称尽管工厂采取了清洁和消毒措施,但是仍能从食品加工设备表面检出单增李斯特菌。这就使得单增李斯特菌极易对肉、乳制品、水产品和蔬菜等食品造成污染,而人受其感染的主要途径便是食用被其污染的食品[6]。单增李斯特菌暴露于亚致死环境胁迫条件下一段时间后,会增强抵抗致死性环境胁迫能力,Skandamis等[7]的研究表明单增李斯特菌暴露于弱酸下一段时间后,可显著增强其耐酸性。此外,在整个食品加工过程中可能会出现多种不同的胁迫环境,这极易导致单增李斯特菌产生交叉保护,如低温下生长的单增李斯特菌可增强抵抗高渗透压胁迫的能力等[8]。而最应该值得注意的是,目前有许多研究表明环境胁迫可以增强单增李斯特菌耐受胃液的能力,这严重危胁人类身体健康[9-10]。因此,为了开发有效的措施来防止食品加工过程中的单增李斯特菌的污染以及控制其在食品贮藏过程中的生长,了解单增李斯特菌在食品加工环境中对胁迫条件的响应及耐受机制是至关重要的。本文在前人研究的基础上,就单增李斯特菌在食品加工中产生的酸胁迫应激、热胁迫应激、冷胁迫应激、干燥和高渗透压胁迫应激以及交叉保护等最新研究结果进行了综述,旨在为单增李斯特菌在食品加工过程中胁迫响应研究及该菌的防控提供指导。
1 酸胁迫
在食品加工过程中单增李斯特菌广泛存在。代长宝[11]调查了肉牛屠宰工厂的各个屠宰环节(运输车、待宰圈、粪便、皮毛、去内脏后胴体、喷淋后胴体、冷却后胴体、冷却肉)单增李斯特菌的检出情况,发现经酸喷淋后胴体仍可检出单增李斯特菌。单增李斯特菌最适生存pH值为6~7,但在pH 4.1~9.6的范围内仍可存活生长[12]。当食品或加工设备等用酸处理时,便会对单增李斯特菌形成酸胁迫应激。在酸胁迫应激条件下单增李斯特菌会产生诱导耐酸反应(acid tolerance response,ATR)[1,13]。ATR是指菌株处于亚致死pH值的酸性环境一段时间后,其抵抗致死性酸环境的能力会增强的现象。这一反应能够提高单增李斯特菌的毒力和耐受胃酸的能力[14]。还有学者发现单增李斯特菌进行ATR后不仅可以增强其耐酸能力,还可以产生交叉保护作用,提高菌株耐热、耐冷、耐渗透压等的能力,增强细菌的毒性,严重危害人类健康[14-16]。
图1展示了单增李斯特菌的耐酸系统和耐酸机制。单增李斯特菌处于酸胁迫条件下时,质子(H+)通过细胞膜扩散进入菌株,造成菌株内酸性阴离子含量增加,打破菌株内pH值的动态平衡,使菌株的细胞膜以及重要的代谢途径受到破坏和损伤。单增李斯特菌具有F0F1-ATPase系统、谷氨酸脱羧酶系统(glutamate decarboxylase system,GAD)、精氨酸脱亚胺酶系统(arginine deiminase system,ADI)等多种维持pH值平衡的机制来调控上述过程,故单增李斯特菌在进行ATR后可以获得较强的耐酸能力[18-22]。

图1 单增李斯特菌的耐酸机制[17]Fig.1 Mechanisms of stress response in Listeria monocytogenes[17]
1.1 F0F1-ATPase系统
F0F1-ATPase是一种多亚基酶,最初由Datta等[23]发现其与单增李斯特菌的耐酸性有关。当单增李斯特菌处于酸性环境时,细胞内外存在pH值梯度差,当梯度差达到一定程度时会导致F0F1-ATPase水解ATP程度增强,进而产生质子迁移力(proton motive force,PMF),PMF可以促进细胞内质子(H+)的排出,提高细胞内pH值进而维持pH值平衡[24]。
N,N-二环己基碳二亚胺(N,N-dicyclohexylcarbodiimide,DCCD)是F0F1-ATPase的抑制剂,Datta等[23]用其证实F0F1-ATPase与单增李斯特的耐酸性有关。Cotter等[25]报道称单增李斯特菌在pH 5.5条件下诱导1 h,再在pH值为3.0条件下酸激2 h,采用DCCD处理组比未采用DCCD处理组的存活率低3 个对数值,这表明F0F1-ATPase与单增李斯特菌ATR机制有关。张一敏[26]发现单增李斯特菌细胞膜流动性的改变可以影响其耐酸性,但该学者并未探讨其具体原因。然而有学者在研究大肠杆菌时发现,细胞膜流动性改变影响菌株耐酸性的原因是细胞膜流动性改变了F0F1-ATPase的活性[27]。单增李斯特菌中细胞膜流动性影响其耐酸性的原因是否与F0F1-ATPase系统有关还有待阐明。
1.2 GAD系统
GAD系统是影响单增李斯特菌耐酸的一个关键机制[1]。该系统由2 个逆转运蛋白基因(gadT1和gadT2)和3 个脱羧酶基因(gadD1、gadD2和gadD3)组成,逆转运蛋白基因编码对应的逆转运蛋白GadT1和GadT2,脱羧酶基因编码对应的脱羧酶GadD1、GadD2和GadD3。当菌株处于低pH值条件(pH<4.5)下时,GadD2催化L-谷氨酸脱羧生成GABA,催化完成后GadT2会将GABA导出胞外并将L-谷氨酸导入胞内(图1)。除此之外,GadD3消耗质子(H+)也可以使L-谷氨酸脱羧生成GABA和CO2,这个过程产生的GABA在细胞内累积。GAD系统调控上述两个过程维持细胞内pH值的稳定[17]。
很多学者就GAD系统对单增李斯特菌耐酸能力的影响进行了相关研究。Karatzas等[28]通过研究不同类型单增李斯特菌的GAD系统,发现该系统具有菌株依赖性。王宜等[29]研究单增李斯特菌SigB调控GadD3的抗酸应激作用,发现3 个谷氨酸脱羧酶基因(gadD1、gadD2、gadD3)对单增李斯特菌的耐酸胁迫能力贡献大小为gadD2>gadD3>gadD1。除此之外该实验还得出SigB可以正向调控gadD3的转录与表达,这与Jeroen等[30]得出的结论相同。但Kamzierczak等[31]认为SigB下调gadD3的转录水平。这与王宜[29]和Jeroen[30]等的结论不同,这可能是实验所用的菌株类型不同所致。现有的研究结果表明GAD系统抗酸应激作用的具体调控尚不明确,gadD1基因的调控因菌株而异,此外,大多数学者认为SigB参与gadD3基因的转录与表达调控,但对于其是否是正向调控gadD3基因的转录与表达结论还存在争议。
1.3 ADI系统
ADI系统在维持单增李斯特菌细胞内pH值稳定方面也发挥着重要作用[1]。ADI系统主要由精氨酸脱亚胺酶(arginine deiminase,ArcA)、分解代谢鸟氨酸氨基甲酰基转移酶(catabolic ornithine carbamoyltransferase,ArcB)、氨基甲酸酯激酶(carbamate kinase,ArcC)和精氨酸-鸟氨酸逆向转运酶(membrane-bound arginineornithine antiporter,ArcD)分别由arcA、arcB、arcC和arcD编码。当单增李斯特菌处于较低pH值时,上述3 种酶将进入细胞内的精氨酸分解为NH3、CO2、ATP和鸟氨酸(图1),NH3与H+结合生成NH4+进而使细胞内pH值升高,维持pH值平衡,而产生的ATP可以参与F0F1-ATPase系统质子转运,ArcD可以在不消耗能量的前提下将鸟氨酸转运到细胞外并交换精氨酸进入细胞内[32]。
有很多学者针对单增李斯特菌的ADI系统进行了研究,程昌勇[33]研究了单增李斯特菌酸应激(pH 2.5、60 min)后arcA基因的转录和蛋白表达水平,结果显示两者均显著升高,且缺失acrA基因的单增李斯特菌在酸性环境中的存活性显著下降。该结果也进一步证实了Ryan[32]得出的ADI系统对于单增李斯特菌的耐酸性起到重要作用这一结论。Freitag等[34]报道称ADI系统受SigB因子和毒力因子PrfA调控。lmo1367编码精氨酸代谢调控因子ArgR,lmo0041编码rpiR家族转录调控因子Lmo0041。陈健舜[2]发现ArgR和Lmo0041在胃液中分别正调控和负调控单增李斯特菌ADI系统,且ArgR的作用弱于Lmo0041,同时ArgR还可对Lmo0041正调控。该学者还提出ArgR、Lmo0041、SigB和PrfA可以构成级联调控网络(图2)的观点。ADI系统的耐酸调控机制尚不完全清楚,SigB和PrfA分别对ArgR和Lmo0041的调控机制还有待阐明;除此之外,ADI系统和GAD系统均可消耗细胞内H+来提高细胞内pH值,但两个系统之间的关系以及在耐酸机制中发挥作用的重要程度也有待深入研究。
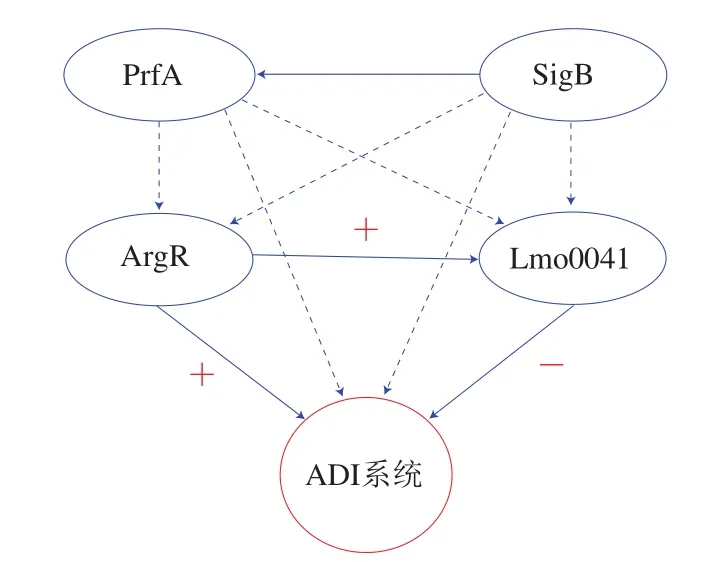
图2 PrfA、SigB、ArgR、Lmo0041与ADI系统的级联调控网络[2]Fig.2 Cascade regulation of PrfA, SigB, ArgR and Lmo0041 on ADI system[2]
2 热胁迫
热处理是减少食品尤其是是乳制品和肉类中微生物含量最常用的方法之一。如果环境温度发生改变,微生物体内的生理生化反应也会发生相应的变化。单增李斯特菌在食品消毒、运输等过程中均有可能遇到温度升高的情况,因此为了保证自身的存活,单增李斯特菌需具备抵抗热胁迫应激的能力[17]。与ATR类似,亚致死温度下诱导单增李斯特菌一段时间,其热应激抵抗能力也会增强。Shen Qian等[35]研究单增李斯特菌在亚致死温度48 ℃下诱导不同时间后暴露于致死温度(60 ℃)下的存活情况,结果显示经48 ℃诱导后的单增李斯特菌在60 ℃下的存活率要显著高于未经诱导的单增李斯特菌,说明单增李斯特菌经亚致死温度暴露一段时间后其抵抗致死温度的能力会增强,这与Wałecka-Zacharska等[36]的结论相一致。除此之外,Shen Qian等[35]还发现当单增李斯特菌在亚致死温度下诱导30~60 min时,其在致死温度下的存活能力最强,这也验证了Linton等[37]得到的单增李斯特菌抵抗热应激能力与其在亚致死温度下的诱导时间有关的结论,但Linton等[37]提出的最佳的亚致死温度诱导时间为20 min,这与Shen Qian等[35]所得的最佳亚致死温度诱导时间30~60 min又有所差异,这可能与两位学者所用菌株类型不同以及对菌株的培养时间不同有关。
为了更好地模拟现实中食品加工环境,Carazo等[38]研究了动态条件下单增李斯特菌的耐热情况,发现相对于等温处理单增李斯特菌,现实中动态温度的处理并不会导致单增李斯特菌的快速减少,且会使单增李斯特菌抵抗热的能力变得更强,进而对食品造成严重污染。此外,该学者还报道称单增李斯特菌进行动态温度处理时的热胁迫应激机制在等温处理过程中是观察不到的,但具体相关机制该学者并未阐释。
单增李斯特菌抵抗热胁迫应激的能力来自其细胞膜固有的稳定性和其内部大分子(如酶、蛋白、DNA等)。当单增李斯特菌暴露于高于45 ℃的环境中时,其会迅速作出热应激反应,诱导相关基因表达,大量合成一组高度保守的蛋白质,称为热休克蛋白(heat shock proteins,HSPs)[17]。大多数HSPs为分子伴侣和蛋白酶。HSPs是单增李斯特菌抵抗热胁迫应激所必需的,目前单增李斯特菌中已鉴定的HSPs包括DnaK、DnaJ、GroES、GroEL、HtrA和Clp,分别由基因dnak、dnaJ、groES、groEL、htrA和clp编码。其中DnaK、DnaJ、GroES和GroEL属于分子伴侣,修复和复性应激条件下发生损伤的蛋白、防止蛋白聚集和错误折叠等;而HtrA和Clp属于蛋白酶,主要功能是降解变性蛋白等[2]。表1总结了最近热胁迫下HSPs在单增李斯特菌中表达的研究进展。

表1 热胁迫下HSPs在单增李斯特菌中的表达Table 1 Expression of HSPs in Listeria monocytogenes under heat stress
菌株处于热胁迫状态时会大量合成HSPs,但HSPs并不会一直维持高表达水平,在适应热胁迫一段时间后HSPs表达量会降低,这可能是因为HSPs对热胁迫损伤的蛋白进行了修复和降解[43]。HSPs是单增李斯特菌抵抗热胁迫应激所必需的,但不同的HSPs对菌株抵抗热胁迫应激的贡献程度因菌株类型不同等原因有所差异。Omori等[43]发现不同类型的单增李斯特菌在同样热胁迫条件下,DnaK、DnaJ及Clp等表达差异较大,差异的原因可能是菌株类型不同。除此之外,很多学者对于HSPs的调控方面做了很多研究。dnaK、dnaJ、groES和groEL属于DNA操纵子,其表达受阴遏蛋白HrcA的影响,而HrcA/CIRCE是热休克阴遏系统之一,故有学者推测单增李斯特菌中DnaK、DnaJ、GroES和GroEL的表达可能受HrcA/CIRCE系统调控[2,44-45]。最近的一项研究中,Sheet等[42]发现单增李斯特菌在处于热胁迫条件下时,其菌体内dnak、groES、clpC、clpP和clpE表达水平下调的同时SigB表达水平也有所下调,因此该学者认为DnaK、GroES以及Clp的表达受SigB调控。现有研究显示不同的HSPs的调控有所不同,同一HSPs的调控也有所差异,关于单增李斯特菌的热胁迫应激机制以及HSPs的调控机制还尚未有明确的定论,对上述机制还需要进一步的研究探索。
3 冷胁迫
冷藏是延长食品货架期最常用的手段,单增李斯特菌可耐受低温,在冷藏条件下仍可存活繁殖,这也是食品中,特别是肉类和海鲜中频繁检出单增李斯特菌的原因。低温会导致单增李斯特菌代谢速率降低、膜弹性降低、蛋白质和酶活性降低甚至蛋白质出现损伤等[46]。有研究表明苹果在1、4、10 ℃下贮存12 周后,单增李斯特菌活细胞数会下降0.5~1.5(lg(CFU/个)),这表明低温会影响单增李斯特菌的存活[47]。因此,为了自身生存,单增李斯特菌必须调节自身的基因表达来应对低温带来的危害。而低温对于单增李斯特菌的存活也并不全是有害的。当单增李斯特菌在相对较低温度下生长一段时间后,其抵抗冷胁迫应激的能力也会大大增强。最近一项研究报道便验证了该结论,报道称处于冷胁迫条下的单增李斯特菌,其抵抗冷胁迫的能力的增强,易形成超级耐冷菌株[48]。
单增李斯特菌冷胁迫应激机制主要与冷休克蛋白(cold shock proteins,CSPs)有关。CSPs是一种高度保守的蛋白质,长约65~70 个氨基酸,其在DNA和RNA的复制、转录和翻译过程以及稳定核酸构象防止核酸降解等方面起重要作用[17,43]。单增李斯特菌中有3 个CSPs(CspA、CspB和CspD)对抵抗冷胁迫至关重要,除此之外,还有一些其他蛋白以及细胞脂肪酸也与单增李斯特菌冷胁迫应激机制有关(表2)。

表2 冷胁迫下单增李斯特菌的蛋白和细胞脂肪酸的变化情况Table 2 Changes in Listeria monocytogenes protein and cellular fatty acids under cold stress
单增李斯特菌在冷胁迫条件下时,菌体内CSPs、细胞脂肪酸以及其他蛋白都会做出相应的调整反应。CSPs表达大致有如下规律:同一冷胁迫温度下,CspA和CspD在整个生长阶段中先上调,然后到稳定期时居于平稳或略有下调,而CspB在整个生长阶段呈下调趋势;同一生长阶段下,在温度相对较低的情况下CspA和CspD表达量高,CspB表达量低。冷胁迫条件下单增李斯特菌中细胞膜变化主要是脂肪酸链长度缩短,不饱和脂肪酸和支链脂肪酸含量增加,产生变化是为了使细胞膜流动性增强以更好地抵抗冷胁迫。然而也有学者发现冷胁迫条件下支链脂肪酸含量减少[50],这与大多数研究结果相反,其中原因该学者并未探究,故在进一步的研究中需侧重于菌株脂质代谢方面,以期更好了解冷胁迫条件下的细胞脂肪酸情况,为研究冷胁迫反应机制奠定基础。
冷胁迫条件下的其他蛋白表达情况也有很多学者进行了研究(表2)。Flp经常在冷胁迫研究中被讨论,单增李斯特菌在低温条件下培养到稳定期时会诱导flp基因表达产生Flp[51],这解释了Hingston等[49]发现的Flp在稳定期表达量最高的现象。Flp参与冷胁迫应激机制可能与低温下细胞内铁的合成有关[51]。鞭毛蛋白如Fla、FlhA和MotA等也经常在冷胁迫研究中被讨论,鞭毛蛋白表达量升高与冷胁迫下菌株的运动性变化有关。OpuCA是肉碱的主要转运体,其在冷胁迫中的作用是吸收肉碱等低温保护物质到菌体内以保护细菌在冷胁迫条件下的生长。除此之外,LtrA、LtrB、LtrC也被确定为低温下生长所必需的蛋白[52],然而关于这3 种蛋白尤其是LtrC的报道结果各有不同,有学者报道称低温下LtrC的表达水平高于37 ℃,而Hingston等[49]发现较低温度下LtrC的表达水平反而较低。尽管产生上述两种结果差异的原因尚未可知,但LtrA、LtrB、LtrC在冷胁迫条件下的表达现已被证实与SigB调控有关[49,53]。
4 干燥及高渗透压胁迫
干燥也是食品加工中常用的延长货架期方法之一。干燥通过引起菌体内蛋白质变性和盐类等物质浓度提高来抑制细菌生长繁殖。渗透压胁迫通常由向食品中添加盐或糖造成,这也是食品常用贮藏手段之一。干燥和渗透压都涉及到降低微生物的水分活度。和众多微生物一样,单增李斯特菌生长繁殖需要适宜的水分活度,当水分活度降到不适宜生长但又未达到致死水平时,其会产生应激反应来保证自身的存活[2,17]。
单增李斯特菌应对低水分活度的环境主要依靠相容性溶质,如肉碱、脯氨酸、甘氨酸甜菜碱等,相容性溶质在胞浆中具有稳定酶结构、维持细胞内外渗透压平衡等作用。BetL、Gbu和OpuC构成的转运系统将相容性溶质摄入到细胞内。此外,CSPs、鞭毛蛋白等也参与抵抗干燥和渗透压胁迫[17,53-55]。表3总结了最近干燥及高渗透压胁迫下单增李斯特菌的蛋白表达的研究情况。

表3 干燥及高渗透压胁迫下单增李斯特菌的蛋白表达情况Table 3 Protein expression in Listeria monocytogenes under dryness and osmotic stress
干燥或高渗透压胁迫下,相容性溶质转运蛋白表达会上调从而吸收相容性溶质到细胞内。然而有学者发现BetL在干燥条件下表达未有显著变化[53],这是因为BetL转运蛋白与Na+的含量有关,其主要在盐导致的高渗透压胁迫中起作用[58]。除了相容性溶质外,其他蛋白也参与干燥和高渗透压胁迫应激机制。干燥或高渗透压胁迫极易导致DNA损伤,而CSPs被证实有助于损伤DNA修复,故在干燥或高渗透压胁迫下CSPs的表达也显著上调。有学者报道称当面临干燥等环境胁迫时,单增李斯特菌运动相关基因表达减少将会导致存活率提高[59],这解释了Kragh[53]和Zhang Donglai[55]等的研究中发现运动蛋白表达下调的现象。
SigB调控因子在单增李斯特菌中参与多种胁迫应激调控,在干燥和高渗透压胁迫下起关键作用。在干燥和高渗透压胁迫下,SigB表达上调,参与opuCABCD操纵子、ClpC以及GroE等与干燥和渗透压胁迫有关基因和蛋白的调控[53-54]。此外,同一胁迫条件下,SigB在不同菌株或不同培养基上的表达也不同[53,57],这可能与SigB表达的随机性有关,此前就有学者发现SigB在单增李斯特菌中的表达并不是由确定性的通路诱导,而是由多种通路在细胞中同时“开启”或“关闭”SigB表达,这导致SigB的表达具有随机性[60]。
5 交叉保护
越来越多的研究表明单增李斯特菌处于某一环境胁迫下时,不仅会导致抵抗本环境胁迫能力增强,也会导致其他环境胁迫抵抗能力增强,比如经亚致死酸性条件处理的单增李斯特菌,其抵抗热胁迫、高渗透压胁迫、乙醇胁迫以及氧化应激等能力显著增强,这一现象称为交叉保护[17]。
交叉保护严重危害食品安全,最近一项研究中,有学者先将单增李斯特菌用10% NaCl胁迫处理24 h,然后将其接种于pH值为4.17左右的奶酪中,结果显示随着时间的延长,菌量有所下降,但与未经盐胁迫菌组相比,经盐胁迫菌组的下降趋势与幅度远低于未经盐胁迫菌组。上述结果表明单增李斯特菌经盐胁迫后可产生交叉保护,提高其抵抗酸的能力[61]。
交叉保护因诱导胁迫环境的不同,其机制也有所不同。众多学者发现在研究单增李斯特菌在某一环境胁迫应激时,主管其他环境胁迫的蛋白和基因的表达也有显著变化,如Kragh等[53]在研究高渗透压胁迫时,发现在冷胁迫应激中发挥主要作用的CspA表达发生显著变化。除了这些参与多种胁迫应激的蛋白外,SigB的调控也是产生交叉保护现象的一个重要原因,SigB是环境胁迫应激的主要调控因子,尽管不同的环境胁迫下其表达程度不同,但其调控多种环境胁迫蛋白,SigB表达量的变化直接影响着其调控蛋白的表达[62]。目前关于单增李斯特菌中交叉保护的研究还相对较少,但其危害却非常大,尤其是经过某一环境胁迫后会增强其抵抗胃酸的能力,这给人们的健康带来极大隐患。因此在进一步的研究中我们需要加强交叉保护这一方向的研究,这对于食品安全和人类健康具有重要意义。
6 结 语
单增李斯特菌在食品加工过程中极易受到环境胁迫影响,如果胁迫条件并不能完全致死,反而会使其抵抗环境胁迫的能力大大增强。因此,了解单增李斯特菌在环境胁迫下的机制可以帮助工厂在食品加工过程中避免污染,同时也有助于制定更加安全卫生的食品安全措施。然而目前关于单增李斯特菌环境胁迫应激的具体机制尚未完全明确,仍需进一步的研究探索。目前的研究中还存在以下问题:1)不同环境应激机制调控因子不同,有的甚至一个应激系统涉及多个调控因子,目前对单增李斯特菌胁迫机制的调控因子方面了解甚少,需要进一步深入研究。2)在食品加工过程中,单增李斯特菌往往并不是只受到某单一环境胁迫,而是受多种环境胁迫,目前关于单增李斯特菌复合应激尤其是复合应激的蛋白组学、基因芯片全基因组表达谱等研究还较少,在这方面还需要进一步研究。3)从食品原料到餐桌的过程中,单增李斯特菌有时候要先后经历多种胁迫,比如牛肉在屠宰加工往往要先经历酸胁迫,再经历冷胁迫或其他胁迫。而胁迫顺序的不同产生的交叉保护,其抵抗环境胁迫能力尤其是抵抗胃酸的能力是否会比经历单一环境胁迫后要强?目前在单增李斯特菌中关于这方面的研究还比较少。
