非变性II型胶原蛋白研究进展
2021-09-27杨舒乔高彦祥
杨舒乔,王 迪,高彦祥*
(中国农业大学食品科学与营养工程学院,北京 100083)
交原蛋白或称交原是一类重要的蛋白质,是细胞外基质的一种结构蛋白。目前已经发现有20余种不同类型的交原蛋白,包括I型、II型、III型、IV型和V型等[1](表1)。其中,II型交原蛋白(collagen type II,CII)具有致密的纤维结构,是软骨基质中最主要的有机成分,为软骨组织的特征性蛋白质,与多糖紧密结合,使软骨具有柔韧性,可以吸收冲击和承受负载。研究表明,保持完整三螺旋结构的CII,即非变性CII(undenatured type II collagen,UC-II)具有良好的生物相容性和低抗原性,以适宜剂量的UC-II诱导人体免疫耐受,可预防或缓解骨关节炎、类风湿性关节炎病症[2]。本文主要阐述UC-II的分布、功能及结构特性,对UC-II的提取方法及应用现状进行综合论述,同时总结现有的UC-II表征方法,并对其应用前景做出展望。

表1 不同类型胶原蛋白的肽链组成及组织分布[1,3]Table 1 Peptide chain composition and distribution of different types of collagen in animal tissues[1,3]
1 UC-II的特点
UC-II主要分布于软骨、眼玻璃体、髓核、角膜和胚胎的上皮细胞中,具备良好的生物相容性、生物可降解性、低免疫原性等交原蛋白基本生物学功能,还可以维持软骨组织的完整性,刺激软骨细胞生长和再分化[3]。UC-II由3 条α1肽链组成,即[α1(II)]3。每一条多肽链的氨基酸排列中,存在甘氨酸-X-Y(G-X-Y)这样的三肽重复序列,可用(G-X-Y)n表示[4-6]。同时X位通常由脯氨酸残基占据(20%~30%),甘氨酰-脯氨酰-Y这类三肽的数量约占三肽数量总和的1/3,其结构式如图1所示。这种三肽重复序列对交原蛋白的结构具有重要作用。每条肽链有1 000 个左右氨基酸残基,分子质量介于95 000~100 000 Da之间,所以每一个UC-II分子的分子质量约为300 kDa。

图1 UC-II的甘氨酰-脯氨酰-Y结构[1]Fig.1 Gly-Pro-Y structure of undenatured type II collagen[1]
UC-II的二级结构是由3 条肽链组成的三股螺旋[7-9],各个链中的氨基酸通过肽键结合,而3 条肽链则通过氢键、偶极-偶极键、离子键和范德华相互作用维持三螺旋结构。但UC-II的三螺旋结构极易受内因或外因的影响,如环境温度升高可导致UC-II的三股肽链之间的氢键不断减弱,肽链的螺旋度降低,逐渐伸直至解螺旋,整个蛋白的无序性增加,变性后的UC-II生物活性大大降低[10-13],图2为UC-II与变性CII的显微结构图。

图2 UC-II(A)和变性CII(B)的电子显微结构(×50 000)[14]Fig.2 Electron micrographs of undenatured (A) and denatured collagen II (B) (× 50 000)[14]
2 UC-II提取方法
对交原蛋白提取方法的研究大部分都集中在I型交原蛋白上,通常以鸡、牛、羊、猪、鱼等动物的皮、骨、肌腱等为原料,采用碱法、酸法或酶法进行提取[15-18]。碱法容易引起蛋白质变性,甚至会产生D-型、L-型氨基酸消旋混合物,且提取率较低,因此若想要提取完整结构的交原蛋白则很少采用此法。酸法虽然可以较大程度地保持交原蛋白的三螺旋结构,但是在浓酸条件下色氨酸、丝氨酸、酪氨酸等氨基酸会遭到一定程度的破坏,同时采用酸法提取需要准确控制酸度、温度、时间等条件,因此酸法很少单独使用,通常与酶法配合。CII的结构更为复杂,丝状的交原蛋白纤维与弹性蛋白及多糖蛋白相互交织形成网状结构,同时还要保证在提取过程中三螺旋结构不被破坏,提取难度较大。现有的提取方大多采用酶解法,选用特定的蛋白酶,切断苯丙氨酸、亮氨酸或谷氨酸残基侧的肽键,去除CII末端的非螺旋区域,则螺旋区的交原蛋白可溶解在酸性溶液中,从而得到高纯度的UC-II(图3)。
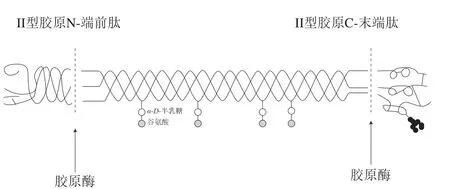
图3 原胶原蛋白分子结构[19]Fig.3 Molecular structure of pro-collagen[19]
2.1 UC-II提取方法的国外研究现状
Trentham等[2]在早在1977年就通过关节炎模拟实验研究UC-II的自身免疫现象,其在0.5 mol/L乙酸的酸性条件下用胃蛋白酶提取UC-II,但该方法酶解时间长达3 d,且并未对酶解产物的纯度及结构进行表征。Ho等[20]首次采用猪软骨作为原料,提高胃蛋白酶使用量同时降低酶解温度,用质量分数2%胃蛋白酶在1 ℃下酶解16 h提取UC-II,该工艺缩短了实验时长,提高了提取效率。为进一步优化提取工艺,Meng Dawei等[21]发现在用鲟鱼脊索提取UC-II时,对脊索进行碱性预处理不仅可以提高交原蛋白的提取速率,且不影响交原蛋白的热稳定性,使其仍保持三螺旋结构。Cremer等[22]指出,在提取前用低离子强度缓冲液(如磷酸钾缓冲液)去除蛋白多糖,有利于CII的溶出,提高提取效率。Sturrock等[23]提出一种UC-II的制备方法,主要包括预处理阶段使用胃蛋白酶部分消化和除去大部分含有I型交原蛋白的软骨膜,以及用胰蛋白酶去除与CII交联的蛋白多糖,从而获得纯度较高的UC-II。Maity等[24]在2019年提出了一种经济有效的快速分离CII的方法,将山羊耳软骨在37 ℃下采用0.04%胃蛋白酶消化72 h,用1.2 mol/L NaCl沉淀,可优化CII的分离效果,提取率约为55%,并且在分离和纯化过程中保留了天然分子间交联,酰胺II带(1 553 cm-1)的存在表明分离的蛋白质保留了三螺旋结构。
2.2 UC-II提取方法的国内研究现状
国内对UC-II的研究起步较晚。王彦宏等[25]在2000年用含1 g/L胃蛋白酶的0.5 mol/L乙酸溶液酶解粉碎后的牛软骨,并用离子交换色谱进行纯化,得到牛软骨UC-II,但并未进行定量测定。叶春婷等[26]在2001年对提取方法进行改进,选取猪透明软骨作为原料,用二乙氨乙基纤维素(diethylaminoethyl cellulose,DAEA)柱对微量残留的蛋白多糖进行吸附,再经胃蛋白酶酶解,整个提取、纯化过程中多次采用了NaCl盐析手段去除降解或变性的交原,得到了高纯度的UC-II。陆雪琴[27]比较盐析和盐酸胍溶解2 种去杂质方法对UC-II得率和纯度的影响,结果表明无论是提取率还是纯度,盐酸胍处理都优于NaCl盐析。此后,大多数研究都使用盐酸胍对原料进行预处理。李赛娜等[28]将牛关节软骨用NaCl和盐酸胍进行预处理,在酸性条件下用胃蛋白酶降解杂蛋白,经盐析、透析和冷冻干燥后获得UC-II。刘媛[29]以羊软骨为原料,用盐酸胍抽提蛋白多糖,在酸性条件下用胃蛋白酶酶解,得到纯度为93.12%的UC-II。曹慧[19]通过响应面方法得到UC-II提取的最优酶解条件为胃蛋白酶质量浓度1 g/100 mL、酶解时间32 h、酶解温度20 ℃,该条件下UC-II提取率43.49%。
除选用鸡、牛、羊等陆地动物软骨作为提取原料外,海洋动物软骨也被逐渐利用。郭休玉等[30]在2016年采用鱿鱼软骨作为原料,经0.2%胃蛋白酶在4 ℃下水解48 h后,得到鱿鱼软骨UC-II。车帅等[31]在2018年用人工养殖中华鲟软骨提取UC-II,采用二次提取法,在含有0.1 g/100 mL胃蛋白酶的0.5 mol/L冰醋酸中重复酶解2 次,每次48 h,在真空度20 Pa下冷冻干燥得到中华鲟软骨UC-II,也为海洋生物的综合利用提供新思路。
通过上述研究可以发现,虽然软骨来源不同,但提取方式基本相同。一般包括以下几个步骤:原料的预处理、脱脂、去除杂蛋白、酶解、纯化(表2)。大部分提取方法都存在处理量小、生产工艺繁琐、耗时长、实验试剂成本高等问题,适合实验室制备样品,并不利于规模化生产。
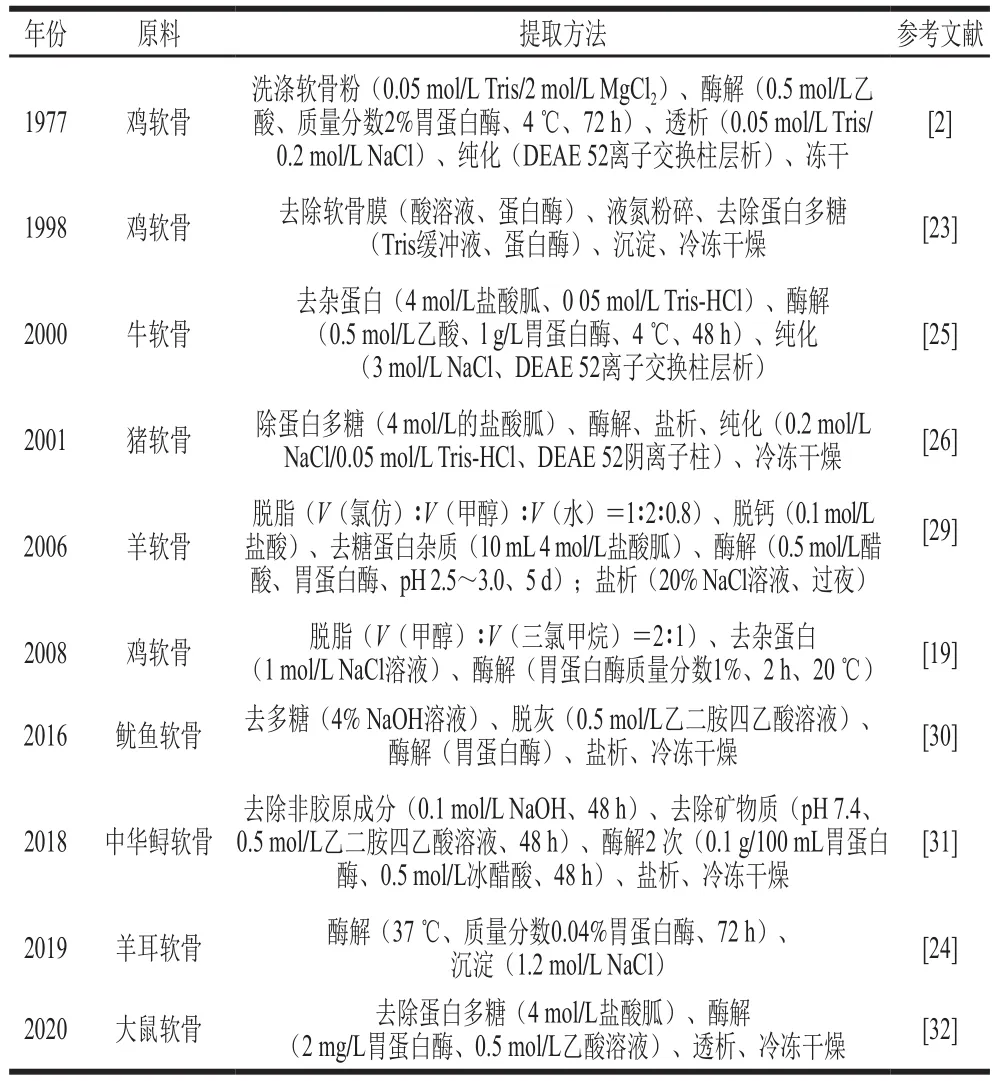
表2 UC-II提取方法Table 2 Extraction methods for undenatured type II collagen
3 UC-II定性和定量检测方法
UC-II的定性和定量检测既是UC-II研究的重点也是难点。通常采用Woessner比色法及反相高效液相色谱法对UC-II进行定量检测,十二烷基硫酸钠-聚丙烯酰胺凝交电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)、氨基酸测定、紫外吸收光谱、傅里叶变换红外光谱、差示扫描量热法、圆二色光谱分析、等电点测定、扫描电子显微镜等方法也逐渐被应用于UC-II的定性检测[26-31]。近些年,已有研究将质谱法、酶联免疫吸附法用于UC-II的检测[33-35],为其定量检测提供新的方向。
3.1 UC-II的定量检测
3.1.1 Woessner比色法[36]
比色法又称分光光度法,是对物质进行定量分析的常用方法。羟脯氨酸是一种非必需氨基酸,也是交原蛋白的特征氨基酸。Woessner比色法的基本原理是:含羟脯氨酸的样品经酸水解后,用氯胺T将羟脯氨酸氧化脱羧生成吡咯,再用对二甲氨基苯甲醛与吡咯反应生成红色复合物,根据可见光下该复合物的吸光度判断溶液中的羟脯氨酸含量。交原蛋白中的羟脯氨酸含量稳定,因此羟脯氨酸含量即可表示交原蛋白含量。该实验方法对实验条件要求不高,但是操作步骤繁琐,只能测定交原蛋白总量,并不能区分交原蛋白类型。
3.1.2 高效液相色谱法
高效液相色谱法具有较高的灵敏性和精密度,已广泛应用于物质的定量检测。曹慧等[37]建立了高效液相色谱测定软骨中CII的方法。采用ZORBAX 300SB C18色谱分离柱,流动相A为体积分数5%乙腈、0.05%三氟乙酸,流动相B为体积分数80%乙腈,线性梯度洗脱,检测波长220 nm,柱温35 ℃,通过精密度和回收率实验证明了该方法的准确性。郑婷等[38]采用分子排阴-高效液相色谱法测定UC-II含量,使用Sepax Nanofilm SEC-150色谱柱,流动相为0.15 mol/L磷酸钾盐缓冲液,检测波长为210 nm,柱温为25 ℃。结果表明,该方法线性关系、重复性、稳定性良好。高效液相色谱法简便、准确、样品使用量小,且易于自动化,为UC-II的定量检测提供了有效方法。
3.1.3 酶联免疫吸附测定法
近20 年免疫学检测法因快速、有效、灵敏度高等特点受到越来越多的重视[39]。目前市面上可以购买到的UC-II检测试剂盒有两种,一种是来自美国Chondrex公司生产的II型交原检测试剂盒(#6018),另一种是中国江莱生物科技有限公司生产的UC-II ELISA检测试剂盒。两种试剂盒均采用酶联免疫吸附法量化细胞或组织中的UC-II,可以准确测定微克级交原蛋白含量,但价格相对较高。
3.2 UC-II的定性检测
3.2.1 SDS-PAGE分析
SDS-PAGE分析是鉴别UC-II纯度最常用的方法[40],由于UC-II是由3 条相同的α-链构成,所以在100~150 kDa附近有浓度较高的α1-链条带,在200 kDa附近有一条浓度较低的β-链条带,无其他杂蛋白带,这是典型的UC-II SDS-PAGE图谱。
3.2.2 氨基酸分析
目前普遍使用氨基酸分析仪来测定蛋白质水解液中的氨基酸组成。UC-II氨基酸组成具有一定的特点[41-42],其中甘氨酸含量最高,约占总氨基酸残基数的1/3,脯氨酸和羟脯氨酸约占1/4,此外还含有较多的丙氨酸,少量的酪氨酸和组氨酸,不含色氨酸,这是典型的动物CII的氨基酸组成(表3)。
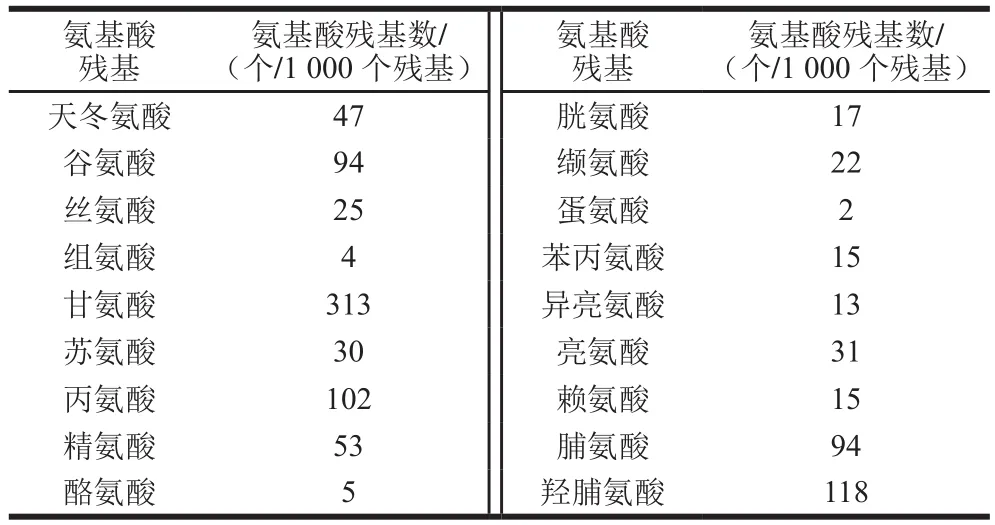
表3 美国Sigma公司CII标准品的氨基酸组成[19]Table 3 Amino acid composition of type II collagen standard produced by Sigma Chemical Company, USA[19]
3.2.3 紫外吸收光谱分析
UC-II链中-CO-、-COOH、-NH-都是生色基团,在200~240 nm波长处的短波紫外吸收光区有特征吸收,此吸收峰与多肽链的氨基酸组成及螺旋程度有关,具有交原三螺旋结构的典型紫外吸收图谱特点。研究表明,鸡胸软骨UC-II在220 nm波长处出现最大吸收峰,鱿鱼软骨UC-II在224.5 nm波长处出现最大吸收峰[30],中华鲟软骨UC-II在229 nm波长处出现最大吸收峰[31],蓝鲨软骨UC-II在226 nm波长处出现最大吸收峰[43]。
3.2.4 傅里叶变换红外光谱分析
酰胺I、酰胺II与酰胺III带和交原蛋白的分子序列及三螺旋结构有关。根据Muyonga等[44]的报道,N-H伸缩振动吸收峰出现在3 400~3 450 cm-1处,表明其N-H伸缩参与了分子中氢键的形成。1 651.3 cm-1附近为酰胺I带的C=O伸缩振动峰,吸收峰最强,是蛋白质二级结构变化的敏感区域。1 557.29 cm-1处为酰胺II带的吸收峰,由N-H弯曲振动和C-N伸缩振动产生,为β-折叠和无规卷曲叠加产生的吸收带。1 200~1 400 cm-1的特征吸收带是由N-H伸缩振动和-COO-的对称伸缩振动引起的,这是其他蛋白质所没有的红外光谱特征,这与交原蛋白中甘氨酸和特征氨基酸羟脯氨酸、脯氨酸含量高且形成独特的(Gly-Pro-Hyp)n序列有关。1 200~1 360 cm-1谱带归属酰胺III带,由C-N伸缩和N-H弯曲引起。通过傅里叶变换红外光谱可对UC-II进行定性分析。
3.2.5 热稳定温度分析
差示扫描量热法是测定蛋白质热稳定性常用的实验方法[45]。UC-II的变性温度近似等于放热曲线峰值所对应的温度[46]。研究表明,鸡软骨UC-II的变性温度为44 ℃[19],羊软骨UC-II的变性温度为39 ℃[26],蓝鲨UC-II的变性温度为41 ℃[43],中华鲟UC-II变性温度为31.5 ℃[31]。
3.2.6 圆二色光谱分析
圆二色光谱是测定蛋白质二级结构的常见方法,广泛应用于UC-II的结构测定中。在198 nm波长处附近出现的负吸收谱带是UC-II分子构象中无规卷曲结构的典型特征;在220 nm波长处附近出现的正吸收谱带是左旋聚脯氨酸(P-II)构型肽链圆二色光谱的典型特征,213 nm波长处出现正负交叉点,这是交原蛋白三螺旋结构的典型特征[47]。该方法可快速鉴定UC-II的三螺旋结构是否被破坏,当UC-II的三螺旋结构被完全破坏时,正吸收峰完全消失,负吸收峰明显红移[48]。
4 UC-II的应用现状
UC-II是关节软骨中不可或缺的交原蛋白成分,并且在软骨细胞的发育和成熟过程中发挥至关重要的作用。同时在类风湿性关节炎、骨关节炎的病理研究方面以及口服治疗类风湿关节炎方面已有临床实验报道[49-56]。Gupta等[57]研究证明UC-II通过干扰局部免疫作用于关节炎症,口服少量UC-II(10 mg)可抑制针对关节软骨中CII的免疫反应,这种机制被称为口服耐受。UC-II的作用机理是口服后到达小肠Peyer’s淋巴结,经肠道内抗原呈递细胞(antigen-presenting cells,APC)在细胞内将外源性抗原UC-II进行加工、处理,并形成主要组织相容性复合体-抗原肽复合体,然后激活调节性T细胞产生抗炎症因子转化生长因子β(transforming growth factor-β,TGF-β)、白细胞介素(interleukin,IL)4、IL-10,下调T细胞攻击关节内交原活性,从而减轻疼痛和炎症[58](图4)。UC-II的作用在不同的动物模型实验中均已得到证实。研究表明,UC-II可显著减轻犬类在骨关节炎期间的炎症反应和疼痛程度[59-62]。Gupta等[63]以马为实验对象评估UC-II对关节炎的作用,相比对照组,每天接受80、120、160 mL UC-II的马各项指标均表明关节炎得到了明显改善。虽然猫对非甾体抗炎药的敏感性与狗相比是有限的,但Blair等[64]的研究表明,一种包含10 mg UC-II的新型补充剂可以通过口服耐受减轻猫骨关节炎相关的症状。同时关于UC-II的安全性也备受关注,Marone等[65]通过长达90 d的家兔急性经口毒性、急性皮肤毒性、原发性皮肤刺激性和原发性眼部刺激性毒性等多种毒理学实验评估UC-II的广谱安全性,尸检后未观察到体质量变化或不良反应。叶春婷等[66]通过小鼠急性毒性实验、新西兰白兔刺激性实验、豚鼠过敏性实验及白兔溶血性实验等再次证实UC-II无毒副作用,并具有良好的细胞相容性,对细胞的增殖有促进作用。

图4 UC-II在骨关节中作用机制的模拟示意图[14]Fig.4 Schematic diagram of the proposed mode of action of type II collagen (UC-II) in joints[14]
美国Interhealth公司生产的UC-II经过美国食品药物管理局售前通知的批准,获得GRAS(Generally Recognized as Safe)认证[67],并且在钙尔奇、Move Free等产品中(如钙尔奇UC2速效骨交原、Move Free舒钙骨交原)得到应用。在日本,UC-II作为具有关节支撑作用的功能性食品已得到了批准[68],日本Bell Corporation公司推出UC-II+交囊,包含UC-II、甲基硫酰基甲烷、氨基葡萄糖等多种成分,成为解决腰痛、关节痛的速效配方。在中国,2016年国家卫计委批准UC-II(又更名为含UC-II软骨粉)可作为普通食品生产经营。该产品质量指标按照企业标准执行,卫生安全指标按照GB 2762—2017《食品安全国家标准 食品中污染物限量》、GB 29921—2013《食品安全国家标准 食品中致病菌限量》执行。国内市售的CII肽一般三股螺旋分子结构已被破坏。2017年北京盛美诺生物技术有限公司获得生产许可,已能够规模化生产含UC-II软骨粉[69]。
5 结 语
UC-II因其特定的致密纤维结构而不易提取,研究进展缓慢,目前大多数研究仅适用于实验室小规模的制备,存在处理量小、生产工艺繁琐、耗时长、实验试剂成本高等问题,因此开发适合工厂大量生产、纯度高、绿色环保且成本低廉的提取工艺,在不破坏交原蛋白三螺旋结构的基础上,将天然组织转化为纯度较高的商品是UC-II研发的创新方向。UC-II在国外已有较大的市场,但在国内对其认知还不够深入,国内市场基本处于起步阶段,虽然已有一些预防和治疗关节疾病的UC-II保健品,配方基本是UC-II、氨糖和硫酸软骨素等,但普遍因口感不好而制作成交囊或片剂吞服食用,其他类型食品鲜见报道;因此,拓宽UC-II在食品领域的应用范围也是未来的一个发展方向。UC-II作为治疗关节炎的重要食品性原料,必将有广阔的发展前景。
