河北省药品上市许可持有人药物警戒工作现状
2021-09-26郭莎莎刘红星
郭莎莎 刘红星 王 冰 魏 莉 王 芳
1.沧州市药品不良反应监测中心,河北沧州 061000;2.河北省药品监测评价中心,河北石家庄 050090;3 河北省药品职业化检查员总队,河北石家庄 050090
2019 年8 月26 日颁布的《药品管理法》确立了药品上市许可持有人(以下简称“持有人”)制度,规定国家建立药物警戒制度,其中持有人是指取得药品注册证书的企业或者药品研制机构等[1]。药物警戒所关注的内容已不拘泥于药品不良反应信号,还涉及到药品误用、滥用、过量使用、药物间相互作用、缺乏疗效等其他药品安全问题,贯穿于药品前期研发和上市后的全生命周期中,而持有人是药物警戒制度实施后的责任主体[2-3]。近年来,国家也相继出台了一些政策和措施以落实持有人的主体责任,因此,分析研究当前持有人药物警戒工作现状,为监管部门制订和实施药物警戒制度提供参考,推进持有人完善药物警戒工作显得尤为必要。
2019 年药物警戒年度报告是新《药品管理法》实施以来国内持有人第一次撰写,反映了企业年度内药品不良反应监测体系运行情况、不良反应报告情况、风险识别与控制情况、上市后研究情况等信息[4]。本文通过对药物警戒年度报告进行回顾性分析,研究河北省内国产药品持有人药物警戒现状,探讨持有人如何完善药物警戒体系,提升药物警戒工作水平和能力,强化药品上市后风险管理,以期为持有人药物警戒工作开展提供借鉴,为监管部门制订监管政策提供参考。
1 资料与方法
1.1 资料来源
河北省药品监测评价中心在2020 年1 月至3 月收集的由辖区内持有人提交的2019 年度药物警戒年度报告。
1.2 纳入及排除标准
纳入标准:年度报告信息填报完整的报告。
排除标准:年度报告信息填报不完整,2019 年未生产未销售药品的持有人报告。
收集到纸质报告94 份,按照排除标准排除报告7 份,其中药物警戒体系未填的1 份,风险评估与控制项有却未填表格内容的1 份,2019 年未有药品生产和销售的5 份,最后纳入统计分析87 份报告。
1.3 统计学方法
将纸质报告表按照年度报告撰写指南中的项目,逐条逐个提取列入Excel 表格中,利用Excel 软件,对持有人信息、药物警戒体系、境内信息自主收集途径、风险评估和控制、上市后安全性研究等情况进行统计分析。
2 结果
2.1 持有人基本构成
87 份年度报告中涉及到的持有人按照持有人类型包括药品生产企业86 家(98.85%),药品研发机构1 家(1.15%);按照企业类型包括内资企业75 家(86.21%),外资/中外合资企业12 家(13.79%);按照企业规模包括大型企业8 家(9.20%),中型企业27 家(31.03%),小型企业51 家(58.62%),微型企业1 家(1.15%)。
2.2 药物警戒体系
2.2.1 药物警戒专门机构 87 家持有人中未设立专门药物警戒工作机构或部门的有5 家(5.75%),均为内资企业。设立专门机构或部门的有82 家(94.25%),其中该机构独立设置的有41 家,非独立设置的有41 家,各占50%。
2.2.2 药物警戒专职人员 87 家持有人中配有药物警戒专职人员的有74 家(85.06%),未配备专职人员的有13 家(14.94%),其中8 家持有人药物警戒工作由兼职人员负责,5 家持有人未配备人员从事药物警戒工作。
2.2.3 药物警戒管理制度 在2019 年度内,有86 家(98.85%)持有人建立了与药物警戒工作相关的管理制度,药物警戒管理制度齐全的持有人有25 家(29.06%),其余(70.94%)持有人药物警戒管理制度尚未健全。药物警戒管理制度各项内容建设情况见表1。
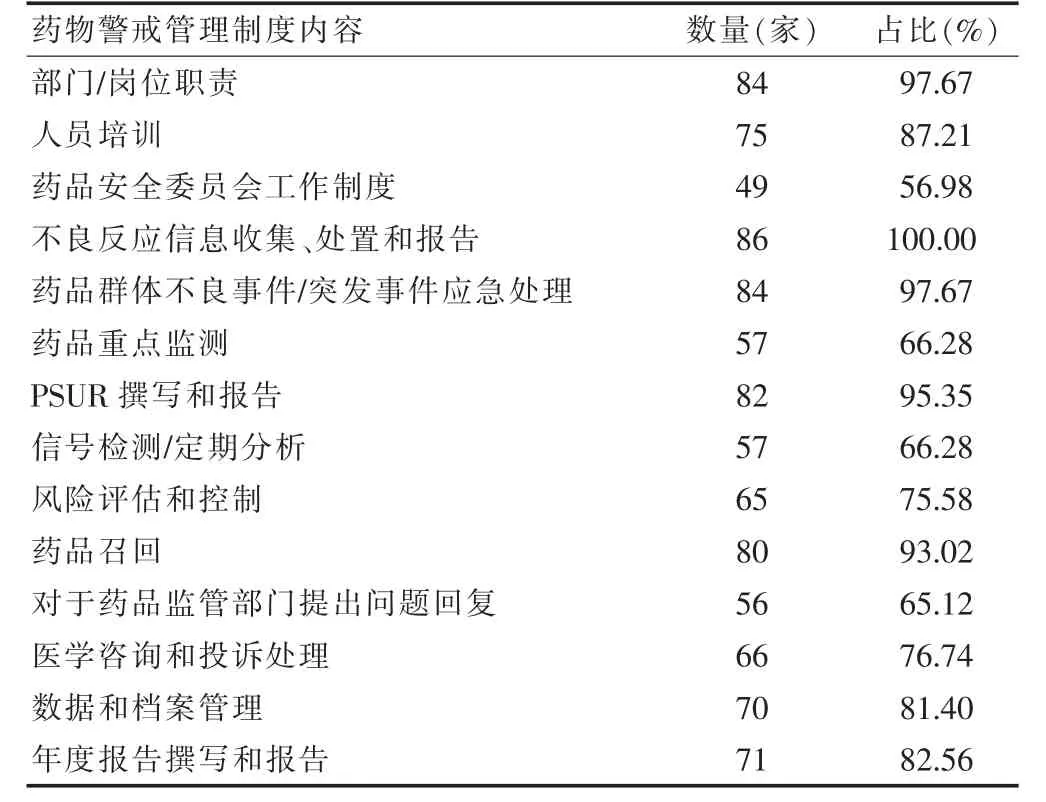
表1 药物警戒管理制度各项内容建设情况
2.2.4 药物警戒负责人 87 家持有人中指定药物警戒负责人的有85 家(97.70%),从统计结果看药物警戒从业年限最长的为30 年,最短的1 年,小于5 年的有33 家(15.29%)。见表2。未指定药物警戒负责人的有2 家,均为内资企业,其中小型企业1 家,微型企业1 家。

表2 药物警戒负责人从业年限分布
2.3 个例药品不良反应报告
2.3.1 境内信息自主收集途径 87 家持有人中有1 家没有建立自主收集境内药品不良反应信息的途径,其余86 家(98.85%)均建立有自主收集途径,其中使用电话和投诉的收集途径最多,来源于上市后研究途径的占比最少,其他的报告来源为企业微信公众号。见表3。

表3 自主收集途径来源
2.3.2 境内报告 87 家持有人2019 年全年共收集到62 902例境内报告,有364例(0.58%)报告来源于自主收集,62 538例(99.42%)的报告来源于监管部门反馈。有自主收集报告的持有人有46 家(52.87%)。
2.4 风险评估和控制及上市后安全性研究
共有9 家(10.34%)持有人(8 家大中型企业,1 家小型企业;7 家内资企业,2 家外资/中外合资企业)在2019 报告年度内新发现了28 个药品重要风险,5 个既往重要风险。评估状态中无需采取措施的药品有2 个,已采取措施的药品有31 个,均采取说明书变更的措施来控制风险。
共有8 家(9.20%)持有人(7 家大中型企业,1 家小型企业;7 家内资企业,1 家外资/中外合资企业)在2019 报告年度内新启动了16 项上市后安全性研究,其中9 项为自主开展,完成了2 项上市后安全性研究,更新既往风险21 项,完成了上市后安全性研究5 项。未发现上市产品安全性问题。
3 讨论
3.1 建立健全药物警戒制度
药物警戒体系是指持有人为保障药物警戒责任有效履行而建立的一套完整系统,包括机构、人员、制度等[5-6]。研究发现2019 年度河北省持有人中5.75%(5 家)未设置专门机构、14.94%(13 家)未配备专职人员,与《药品不良反应报告和监测管理办法》第十三条“药品生产企业应当设立专门机构并配备专职人员”的规定不一致[7]。专门机构和专职人员相当于“全面质量管理”理论中的“人”,承担不良反应报告收集和分析评价等工作[8]。如果未指定“人”,可能会出现发生药品不良事件时因无明确的部门和专职人员而造成工作推诿扯皮、衔接不畅,不能妥善处置药品不良反应风险隐患。
研究发现71.26%的(62 家)持有人药物警戒管理制度尚未健全,未达到66 号公告“持有人建立健全相关管理制度”的要求[4]。制度相当于“全面质量管理”理论中的“法”[8],本研究中药物警戒管理制度涵盖了药物警戒活动的主要环节,健全的制度可让工作有章可循,保证药物警戒工作质量。
药物警戒体系不健全的原因可能与持有人主体责任意识淡薄、对政策法规了解不深入、对药物警戒重视程度不够有关。建议持有人中的高层管理者要提高对药物警戒的重视程度,意识到药物警戒工作的重要性和必要性,认真研读政策法规,建立健全药物警戒体系[8-9]。聘用符合资质的人作为药物警戒负责人,来保障药物警戒工作能持续合规的展开[10-11]。
3.2 提高自主收集报告能力
统计结果显示,河北省98.85%的(86 家)持有人建立了自主收集途径,但通过该途径收集到的个例不良反应报告仅占总报告数的0.58%(364例),报告来源主要依靠监管部门反馈,这表明持有人自主收集报告的能力和途径的有效性不足。
原因可能有:①持有人存在顾虑,担心报告数量多影响销售,出现瞒报漏报;②持有人与医疗机构、经营企业、患者之间沟通机制不够顺畅,收集的信息不够完整达不到报告标准[12-13];③监测人员积极性、责任心或能力不足,对药物警戒与不良反应的区别和联系理解不到位,致报告收集的数量较少、质量偏低[6,14]。
药品不良反应报告是“全面质量管理”理论中的“料”,是药物警戒工作的重要组成部分[8]。持有人应当转变理念,加大不良反应监测投入,加强药品全生命周期管理。为提高自主收集报告能力建议持有人:一要加强与医疗机构、经营企业的沟通,将报告收集纳入销售合同,协助收集报告,与医疗机构建立合作共享机制,通过临床试验、流行病学研究等获得有效的个例不良反应报告;二要拓宽报告收集渠道,可在产品外包装上印制二维码或联系方式,通过微信、电话等公众接受度高且便捷的方式收集报告;三要扩大报告收集范围,深入理解药物警戒内涵,将药物相互作用、药物过量等不良事件纳入报告范围;四要指定具有专业素养的专职人员来开展药物警戒工作,建立激励机制,增强积极性和主动性,提高报告收集的数量和质量[6-15]。
3.3 提高风险管理能力
2019 年国家药品监督管理局发布了27 期药品说明书修订的公告,增加或完善了40 个(类)品种说明书中的警示语、不良反应、注意事项、禁忌等安全性信息[16]。其中涉及到河北省年度内在产的13 家持有人的7 个(类)品种,但是在年度报告中只有5 家持有人对其中的2 个(类)品种填报了风险评估与控制表。由此可见2019 年河北省开展风险评估的持有人为少数。
原因可能有,一是持有人对药品全生命周期管理的理念不清,将更多的资源和精力投入到能获得更多利益的药品上市前的研究,而药品上市后风险管理增加了成本,并未产生明显的利益,因此不愿增加投入;二是持有人对药品风险管理缺乏经验,监测人员知识背景和能力有限,对风险信号不能及时识别、评估和采取控制措施,增加了药品风险管理的难度[17-20]。
持有人应当主动承担起药品全生命周期风险管理的主要责任,建议从药品风险的识别、评估、控制等环节强化药品上市后风险管理[21-23]。一是持有人应当建立起专业的人才队伍,能够对药品不良反应监测数据进行多角度提取分析并评价安全风险,可通过临床研究、专业网站、文献等获取产品安全性信息,识别潜在风险信号,为后续研究提供线索;二是持有人应当对风险识别发现的安全性信号,特别是一些新的、严重的不良反应,报告数量异常增加或是有聚集性趋势的信号要给予重点关注,可通过病例回顾、专家论证等方式确认风险,持续评估药品的风险与效益;三是针对已确认的风险采取控制措施来减少药品伤害,持有人可通过修改说明书,对增加的风险警示及时与患者和医务人员沟通,主动制订风险管理计划,加强对上市后药品的持续管理[24-26]。
3.4 建议
我国药物警戒制度实施时间尚短,基于持有人中存在对相关法律法规不了解,对其主要职责及工作要求不清晰,在加强相关法律法规培训等方面提出以下建议。
3.4.1 监管部门 建议国家药品监督管理部门进一步推进药物警戒法律法规体系建设,尽快出台《药物警戒质量管理规范》。建议省级药品监督管理部门开展针对持有人高层管理人员的培训,宣传贯彻药物警戒制度及相关法律法规,提高药物警戒工作重视程度。同时加强药物警戒工作监管检查和执法力度,促使持有人履行药物警戒主体责任[9]。
3.4.2 监测机构 建议监测机构细化药物警戒工作技术指南,为持有人提供详尽的指导。监测机构开展针对持有人中具体从事药物警戒的技术人员进行培训,使其详细了解并掌握药物警戒工作内容、标准、程序等[27],如个例药品不良反应收集和报告指导原则等[28],帮助持有人有效开展药物警戒活动。
3.4.3 持有人 药物警戒需要多部门参与,如个例不良反应报告的收集需要市场与销售、临床运营、经销商、网站或软件维护人员共同参与;涉及到产品风险还需要生产、质量管理等部门加入[14]。建议持有人一要建立药物警戒质量管理体系,确保药物警戒工作持续合法;二要加强药物警戒法律法规培训,覆盖多个功能部门;三要建立多部门协调机制,以期对风险及时识别、评估和妥善控制[9,14]。
