非编码RNA的m6A修饰及其在肿瘤中的研究进展
2021-09-26胡滨滨张明
胡滨滨 张明
表观遗传学是通过调节RNA的稳定性和折叠模式来描述RNA修饰对基因表达的影响,以及由此对RNA-蛋白质相互作用的影响。尽管尚未确定表观遗传学的全部范围,但通常将其定义为化学修饰,主要包括DNA和RNA修饰、组蛋白修饰和染色质重排等[1]。目前在体内已经鉴定出100多种RNA修饰,常见的包括m5C(5-methylcytidine)[2],m1A(N1-methyladenosine)[3-4]和 N6-甲基腺嘌呤(N6-methyladenosine,m6A)[5]。其中,m6A是真核生物mRNA、长链非编码RNA(lncRNA)和 microRNA(miRNA)最常见的修饰之一[6]。RNA m6A修饰是可逆的,由甲基转移酶(编码器)催化形成,同时通过负责脱甲基酶(擦码器)发生去甲基化,最终被读取蛋白(读码器)识别。m6A修饰主要发生在 2个略有不同的共有基序:RRACH[7-8]和DRACH[9](D=G、A或U;R=G或A;H=C、A或U)。目前越来越多研究表明,m6A修饰在RNA稳定性[10]、mRNA翻译[11-12]、二级结构形成(mRNA和lncRNA)[13]、选择性剪接和聚腺苷酸化[14]以及亚细胞RNA定位[15]等方面发挥重要作用。ncRNAs在人类中占98.5%,提示其在生物进化过程中发挥着重要的生物学功能[16]。多种类型的非编码RNA(ncRNA)、小干扰RNA(siRNAs)和PIWI相互作用的RNAs(piRNAs)在肿瘤发生和发展中的作用也被报道[17-18]。重要的是,ncRNA在体内稳定表达,因此成为肿瘤诊断、预后预测和临床治疗的潜在生物标志物。但是目前有关RNA m6A甲基化的研究主要集中于mRNA,ncRNA研究还较少。本文就ncRNA的m6A修饰及其在肿瘤中的研究进展作一综述。
1 RNA m6A甲基化修饰
1974年,首次在纯化的poly(A)RNA部分中发现m6A修饰[8]。然而,由于缺乏m6A的定位方法,该研究受到阻碍。随着测序技术的不断发展,特别是在大规模高通量测序出现之后,如抗体拉动的m6A横截面高通量测序,也称为m6A-seq或MeRIP-seq(m6A特异性甲基化RNA免疫沉淀与下一代测序结合),m6A定位应用取得了可喜突破[5,19]。m6A修饰调节因子包括m6A修饰甲基转移酶、去甲基转移酶和阅读蛋白。越来越多的证据表明,m6A甲基化修饰与肿瘤发生、转移以及血管生成密切相关。
m6A甲基化过程(图1)涉及3个关键组成部分:“编码器”、“擦码器”和“读码器”[20],它们可以分别添加、移除或识别m6A甲基化位点,从而改变重要的生物学功能。m6A催化复合物“编码器”包含METTL3、METTL14、KIAA1429、WTAP的异二聚体复合物和METTL16的同二聚体复合物。m6A“擦码器”主要包括两种去甲基化酶:ALKBH5和FTO。另一种去甲基化酶ALKBH3与ALKBH5相似,已被证明具有1-甲基腺嘌呤(m1A)和3-甲基胞嘧啶的去甲基化酶活性[21]。此外,有研究指出m6A甲基化也是ALKBH3的底物。值得注意的是,ALKBH3对RNA具有特殊的底物偏好,其仅靶向tRNA中的m6A修饰,而不是mRNA或rRNA中的m6A[22]。m6A“读码器”由人类YTH结构域家族YTHDF1、YTHDF2、YTHDF3以及人类YTH结构域包含YTHDC1、YTHDC2和异质核核糖核蛋白(HNRNP)蛋白质组成[23]。“编码器”和“擦码器”共同决定m6A修饰在RNA上的分布,而“读码器”则介导m6A依赖的RNA代谢和功能调节。它们在整个基因组的表达中起重要的调节作用,对正常的生理功能或病理疾病均具有重要影响。
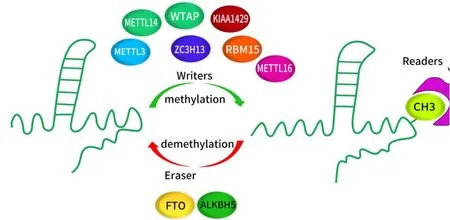
图1 m6A甲基化过程Fig.1 m6A methylation process
2 ncRNA的m6A修饰在肿瘤中的作用
ncRNA根据其长度可分为两类:第一类是少于200个核苷酸的ncRNA,如miRNA、小核RNA(snRNA),其中长度约20个核苷酸的miRNA是已知最小的ncRNA;第二类是具有超过200个核苷酸的ncRNA,甚至达数千个核苷酸的ncRNA,例如lncRNA、环状RNA(circRNA)。目前研究认为,在癌细胞中,m6A修饰可以调节lncRNA的稳定性或其表达水平。m6A修饰也可以影响miRNA的成熟,反过来miRNA也可以靶向作用于m6A甲基化调节因子。至于circRNA,m6A通过circRNA调节mRNA的稳定性,而m6A修饰也可以稳定circRNA。
2.1 m6A修饰与miRNA的相互作用
miRNA是长度为20~40个核苷酸的ncRNA,可以结合靶mRNA的3'非翻译区(3'UTR)以调节基因表达[24]。miRNA成熟涉及3个步骤:第一是转录,其中miRNA在细胞核中加工形成pri-miRNA。第二是在DGCR8和Drosha帮助下,将pri-miRNA转化为pre-miRNA。第三是将pre-miRNA输出到细胞质中进一步处理。在细胞质中,pre-miRNA被Dicer切割成成熟的miRNA[25]。2002年,有研究第一次报道了恶性肿瘤中的miRNA,即在慢性淋巴细胞白血病中发现miR-15和miR-16组成的一簇miRNAs失调[26]。据报道,m6A修饰在mRNAs中富集于5'UTRs、终止密码子附近和3'UTRs的近端区域[19]。此外,研究人员发现miRNAs靶向位点也位于3'UTRs的5'端和3'端,结合位点的相似性表明mRNA甲基化与miRNAs存在相互作用[27]。BERULAVA等[28]报道大部分miRNA含有m6A,敲低m6A去甲基化酶FTO可能影响miRNA的稳态水平。目前认为m6A修饰主要通过两种途径影响miRNA的合成和功能:⑴m6A修饰通过促进miRNA过程和成熟影响肿瘤发展;⑵miRNA可以靶向作用于m6A甲基化调节剂分子。
2.1.1 m6A修饰促进miRNA过程和成熟 如上所述,在 DGCR8和 Drosha的帮助下,pri-miRNA 转化为pre-miRNA。具有 m6A 标记的 pri-miRNA 能被hnRNPA2B1识别,且能与DGCR8相互作用并促进miRNA加工[29]。ALARCÓN等[30]研究发现,METTL3可以使pri-miRNA发生甲基化,从而标记pri-miRNA而被DGCR8识别和处理。在肝细胞癌研究中发现,METTL14与DGCR8相互作用,并以m6A依赖性方式正调节初级miRNA 126过程[31]。在结肠癌中,PENG等[32]研究证实METTL3可以甲基化pri-miR-1246,从而进一步促进pri-miR-1246的成熟;通过生物信息学分析发现,抑癌基因SPRED2为miR-1246下游靶标,其中下调SPRED2能进一步逆转MAPK途径的抑制。在胰腺癌中,METTL3高表达可以增加pri-miR-25的m6A修饰,并诱导成熟miR-25过表达,而成熟的miR-25能抑制其靶基因PHLPP2表达,从而激活AKT信号通路并促进癌症发生和发展[33]。综上可知,m6A甲基化修饰可以作用于miRNA的成熟进程,进而调节miR-NA的水平,影响肿瘤发展。
2.1.2 miRNA靶向作用于m6A甲基化调节剂分子 miRNA也可以调节m6A甲基化调节剂分子以促进癌症进展。m6A修饰通常富集在3'UTR[34]。因此,m6A可能与3'UTR上的miRNA结合位点重叠。CUI等[35]发现METTL3为miR-186的直接靶标,miR-186/MET-TL3轴通过Wnt/β-catenin信号通路促进肝母细胞瘤进展。在肝细胞癌中,YANG等[36]发现microRNA-145通过靶向m6A结合YTHDF2蛋白的3'UTR mRNA区域而调节m6A水平。也有研究报道miR-33a通过靶向调控METTL3 mRNA影响非小细胞肺癌增殖,而miR-33a被证明能直接与非小细胞肺癌细胞中METTL3 mRNA的3'UTR结合[37]。此外,在乳腺癌中,miRNA let-7g可能作为肿瘤抑制因子,通过靶向作用METTL3 mRNA的3'UTR抑制肿瘤发生[38]。
2.2 m6A对lncRNA的影响
lncRNA广泛参与多种细胞过程,包括通过表观遗传调控的转录后调控[39-40]。此外,越来越多的证据表明lncRNAs在多种疾病尤其在癌症发生和发展中起关键作用[41]。m6A对mRNA和lncRNA具有广泛的修饰,在功能上调节真核转录组,影响RNA剪接、输出、定位、翻译和稳定性[9]。XIST是首批功能注释的lncRNA之一,通过募集多种因子在X染色体灭活中发挥关键作用[42],目前已被发现可能是肺癌[43]、卵巢癌[44]、肝癌[45]和结直肠癌[46]等实体瘤的致癌基因。
2.2.1 m6A调节lncRNA表达 在结肠癌中,YANG等[47]发现敲低METTL14基本上可以消除XIST的m6A水平并增强XIST表达,此外m6A甲基化修饰的XIST能被YTHDF2识别,从而介导XIST降解。在肝癌中,METTL3介导的m6A修饰通过增强其稳定性,促进癌症进展,从而导致linc00958上调[48]。METTL3也可以通过提高其RNA转录稳定性,使linc00958上调,进而促进乳腺癌进展[49]。另有研究报道,METTL3可以通过增加结肠癌细胞核的积累上调lncRNA RP11表达[50]。还有研究报道,作为“擦码器”的ALKBH5可以通过去甲基化调节lncRNA KCNK15-AS1的表达,从而抑制胰腺癌细胞迁移和侵袭[51]。在骨肉瘤中,ALKBH5通过上调lncRNA PVT1促进细胞增殖[52]。ALKBH5也能通过去甲基化上调lncRNA NEAT1表达,而且lncRNA NEAT1过表达与结直肠癌患者预后不良相关[53]。此外,“读码器”YTHDF2 介导的lncRNA FENDRR降解可以提高SOX4在子宫内膜癌中的表达,从而促进细胞增殖[54]。由此可见,m6A甲基化调节剂分子可调节lncRNA表达水平,而这些lncRNA表达水平的改变可以促进肿瘤的发展。
2.2.2 m6A调控lncRNAs稳定性 有研究报道METTL3可以提高m6A甲基化修饰水平,也可以增强lncRNA ABHD11-AS1转录稳定性以增加其表达,而METTL3过度表达则与非小细胞肺癌患者预后不良密切相关[55]。FAM225A作为致癌lncRNA,可以促进鼻咽癌细胞增殖、迁移和侵袭。在机制上,FAM225A作为竞争性内源RNA(ceRNA)起作用,可以扩增miR-590-3p和miR-1275,导致ITGB3上调,以及激活FAK/PI3K/Akt信号传导从而促进鼻咽癌细胞增殖和侵袭[56]。WANG等[57]证明m6A修饰可以通过减少RNA降解来改善RHPN1-AS1甲基化转录物的稳定性,而这导致上皮性卵巢癌中的RHPN1-AS1表达上调,且RHPN1-AS1高表达与上皮性卵巢癌患者预后不良密切相关;体外和体内功能实验也显示RHPN1-AS1促进上皮性卵巢癌细胞增殖和转移。该研究作用机制可能是RHPN1-AS1作为miR-596的ceRNA,从而增加LETM1的表达并激活FAK/PI3K/Akt信号通路。在宫颈癌中,ALKBH5可以降低GAS5 m6A修饰水平而增加其稳定性[58],同时还发现发现m6A介导的GAS5 RNA降解依赖于m6A读取蛋白YTHDF2途径。以上研究结果说明,在肿瘤中,m6A甲基化修饰水平的改变可以调节lncRNAs稳定性,这些lncRNAs稳定性的改变同样影响了肿瘤的进程。
2.3 circRNA m6A在癌症中的作用
circRNA是继miRNA和lncRNA之后ncRNA领域又一个新的研究热点。与具有5'帽和3'尾结构的线性RNA不同,circRNA具有独特的环状共价闭合结构[59],因此可以保护它们免受核酸外切酶损害。既往研究显示,circRNA能参与上皮-间质转化、蛋白质翻译、基因表达调控,也可以作为 miRNA“海绵”[60]。m6A修饰也发生在circRNAs中,但是circRNA中的m6A富集模式不同于mRNA[61]。m6A修饰发生在circRNA中,主要通过募集起始因子eIF4G2和m6A“阅读器”YTHDF3促进蛋白质翻译[62]。
2.3.1 m6A修饰的circRNAs稳定mRNA m6A修饰在FTO和METTL3/14复合物调控的circRNAs中尤其 丰富[63]。WU 等[64]报道 circ-KIAA1429通过m6A-YTHDF3-Zeb1加速肝细胞癌进展。CHEN等[65]发现了circNSUN2的 m6A修饰证据,circNSUN2的m6A修饰可以促进circNSUN2向细胞质输出。在细胞质中,circNSUN2通过形成circNSUN2/IGF2BP2/HMGA2-RNA-蛋白三元复合物,增强HMGA2 mRNA稳定性,促进结直肠癌进展;circNSUN2和HMGA2表达上调在结肠癌肝转移组织中也比在原发性结肠癌组织中更为普遍。这些发现阐明了circNSUN2的m6A修饰可调节细胞质输出并稳定HMGA2以促进结肠癌肝转移,说明m6A修饰也可以存在于circRNA中,而且circRNA可以通过m6A修饰调节肿瘤进展。
2.3.2 m6A甲基化修饰稳定circRNA CHEN等[66]研究发现,circ0000069在宫颈癌细胞和组织中上调,m6A修饰可以维持circ0000069的稳定性,进而促进宫颈癌细胞增殖和迁移。但是目前对m6A修饰的circRNAs认识还有限,m6A修饰的circRNAs在肿瘤中的调控机制及其生物学功能尚未明确,仍需进一步探索其作为肿瘤诊断生物标志物和治疗靶点的可能性。
3 小结
m6A在肿瘤中的修饰研究揭示了肿瘤中一个新的表观遗传调控层,为肿瘤发生发展的分子机制研究提供了新的见解。目前认为m6A调控因子可以通过多种机制调控ncRNA,包括促进pri-miRNA的加工成熟、稳定circRNA、甚至通过调节lncRNAs与蛋白质之间的相互作用。反过来,miRNA和lncRNA也可以调节癌细胞中m6A的水平。例如miRNAs可以靶向m6A调节因子的相应mRNA以沉默它们的表达,从而改变癌细胞中m6A的水平。lncRNAs还可能参与维持m6A相关蛋白的稳定性。circRNA不仅可以被m6A修饰,还可以通过与m6A修饰的蛋白质结合而调控m6A修饰过程。因此,值得深入探索m6A修饰如何影响ncRNAs的产生、细胞定位、功能,以及这些过程与癌症的关系。
m6A修饰的ncRNA也已被发现能调控基因表达,调节肿瘤细胞的生物学功能,包括增殖、转移、干细胞分化和稳态,因此m6A修饰与ncRNA的结合为探索肿瘤基因表达的调控机制提供了新的方向,有可能作为癌症指标和治疗干预的靶点。然而尽管m6A调控ncRNA的研究方法不断完善,未来也还有较多问题需要解决。例如,与mRNA不同,ncRNAs不能通过poly(A)富集,意味着难以获得纯的lncRNAs或circRNAs。还有,m6A修饰是动态过程,可由多个因素调节,因此m6A位点高通量序列的结果不稳定且难以重复。此外,m6A甲基化与ncRNA之间的特异性结合位点也有待进一步研究。同一基因转录的ncRNA和m6A调控因子能否通过正反馈或负反馈环相互作用而调控下游靶基因也是值得研究的热点;而进一步探索ncRNA与m6A修饰的交叉调控,也有助于发现癌症诊断和治疗的关键靶点,从而助力个性化医疗目标的实现。
