PD-1抑制剂在弥漫大B细胞淋巴瘤维持治疗中的作用:单中心回顾性病例对照研究
2021-09-26刘玄勇郭智谢晶陈丽娜王月乔张弋慧智陈晓李旭绵韦丽娅王强
刘玄勇 郭智 谢晶 陈丽娜 王月乔 张弋慧智 陈晓 李旭绵 韦丽娅 王强
弥漫大B细胞淋巴瘤(diffuse large B-celllymphoma,DLBCL)是最常见的非霍奇金淋巴瘤亚型,采用R-CHOP(利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松)方案常规化疗后5年生存率可达60%[1]。大部分患者在诱导化疗阶段经过足够疗程化疗后可获得完全缓解,但也可能残存一定数量的肿瘤细胞,影像学手段也难以发现从而导致难治或复发[2]。目前,难治或复发患者预后极差,挽救性治疗包括造血干细胞移植和新型小分子靶向药联合化疗均难以取得显著疗效[3-4]。此外,DLBCL属于显著异质性的侵袭性淋巴瘤,其中存在预后不良因素如国际预后指数(interna-tional prognostic index,IPI)高、MYC蛋白表达或MYC基因重排阳性等的患者更易复发,但是自利妥昔单抗时代以来,甄别危险分层的能力明显受限[5-6]。在此情况下,如果继续增加化疗周期,不仅药物的杀伤作用已达上限,不良反应也会更加明显,因此选择非细胞毒药物方案序贯维持治疗是高复发风险侵袭性淋巴瘤新的治疗策略[7]。在既往的临床研究中DLBCL维持治疗鲜有阳性结果,利妥昔单抗作为DLBCL的维持治疗研究也宣告失败[8],硼替佐米、伊布替尼的维持治疗数据尚不成熟[9],而应用来那度胺维持治疗的REMARC研究也仅改善了60~80岁老年患者的无疾病进展生存时间(progression-free survival,PFS),对总生存期(overall survival,OS)改善作用并不明显[10]。近年来,程序性死亡受体-1(programmed death-1,PD-1)抑制剂在恶性肿瘤的应用备受关注,目前已在霍奇金淋巴瘤、结外NK/T细胞淋巴瘤及原发纵隔大B细胞淋巴瘤中被证实有效[11-13],并被2021年版的 NCCN和CSCO指南推荐。但是在DLBCL临床应用中PD-1还处于探索阶段[14]。本研究回顾性分析本中心使用PD-1抑制剂维持治疗DLBCL患者的疗效及安全性,以期进一步明确PD-1抑制剂在临床中的作用。
1 资料与方法
1.1 病例资料
回顾性分析中国医学科学院肿瘤医院深圳医院血液肿瘤科2018年3月至2019年3月收治的经过诱导化疗获得完全缓解(CR)的DLBCL患者的临床资料。纳入标准:经病理活检(含免疫组织化学检查)确诊为DLBCL,且经抗肿瘤治疗获得CR后选择观察等待或接受PD-1抑制剂维持治疗;临床资料完整。排除淋巴瘤继发中枢侵犯、明确患有自身免疫性疾病、拒绝或无法配合后续随访的患者。本研究获中国医学科学院肿瘤医院深圳医院伦理委员会审批同意,伦理号为2020-50-2。
1.2 治疗方案
治疗组所有患者均接受PD-1抑制剂治疗6个周期以上(最长不超过2年),直至出现不可耐受的毒性或疾病进展。PD-1抑制剂治疗药物包括:纳武利尤单抗3 mg/kg,静脉注射,每2~3周1次,每次持续60 min;帕博利珠单抗2 mg/kg,静脉输注30 min以上,每3~4周给药1次;信迪利单抗200 mg,静脉输注60 min以上,每3~4周给药1次;特瑞普利单抗3 mg/kg,静脉输注,每2~3周1次。治疗期间若出现皮疹、甲状腺功能减退、白细胞减少等不良反应,给予相应对症支持治疗。对照组患者仅随访观察,不接受任何药物治疗。两组患者在维持治疗期间或随访期间如出现疾病复发/进展,则按照NCCN指南调整为后线抗肿瘤治疗方案。PD-1抑制剂药物治疗期间注意监测血常规、肝肾功能、空腹血糖、血脂、脑钠肽、皮质醇、甲状腺功能等血液学检查结果。
1.3 观察指标
通过本院病历系统,检索2018年3月至2019年3月血液肿瘤科收治的经过诱导化疗获CR的DLBCL患者,收集两组患者的一般临床资料,如性别、年龄、体能状态评分ECOG(Eastern Cooperative Oncology Group)评分以及患者基线血生化检查资料、影像学资料(全身增强CT或PET-CT检查结果)、细胞起源情况(生发中心型、非生发中心型)、骨髓侵犯情况、有无大肿块(定义为病灶长径>7.5 cm)、B症状(发热,体温在38℃以上)、盗汗、体重减轻(就诊前6个月内无其他原因体重减轻10%以上)、IPI等。接受PD-1抑制剂维持治疗的患者补充完成脑钠钛、甲状腺功能、空腹血糖、血脂、皮质醇等检验。
1.4 疗效及安全性评估
疗效评价根据2014年Lugano修订版淋巴瘤疗效评价标准判断,分为CR、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。随访截至2021年3月31日。第1~2年内每3~6个月复查增强CT或PET-CT,第3~5年内每6个月复查增强CT或每12个月复查PET-CT。以无复发生存期(relapse-free survival,RFS)为主要研究终点,OS及安全性评价(根据CTCAE 5.0版本)为次要研究终点。RFS定义为疾病缓解至初次复发的时间;OS指从入组开始至因任何原因死亡的时间。
1.5 统计学方法
采用SPSS 22.0软件进行统计分析,通过SPSS描述中的图形检验进行正态分布性检验,符合正态分布的定量资料采用均数±标准差(±s)表示,不符合正态分布的计量资料用中位数描述,两组间比较采用独立样本t检验;定性资料采用例数和百分率表示,组间比较采用χ2检验或Fisher确切概率法。将患者性别、IPI评分、细胞起源、年龄、ECOG评分、B症状、骨髓侵犯、大包块等纳入单因素分析,单因素分析使用Kaplan-Meier生存分析,采用log-rank检验生存结局指标,检验水准α=0.05。
2 结果
2.1 基线特征
本研究共筛选了66例经诱导化疗治疗后获得CR的DLBCL患者,经纳入排除标准排除6例,其中3例患者治疗前乳酸脱氢酶(lactate dehydrogenase,LDH)不详、1例继发中枢侵犯、2例拒绝配合随访,最终60例患者纳入分析。60例患者中,接受PD-1抑制剂维持治疗30例(治疗组),未进行维持治疗30例(对照组)。对照组男性15例,女性15例,中位年龄50岁(范围:26~67岁),≥60岁8例;治疗组男性16例,女性14例,中位年龄48岁(范围:22~73岁),≥60岁7例。治疗组与对照组在疾病分期、B症状、Ki-67指数、IPI评分、大肿块(>7.5 cm)、ECOG评分、细胞起源、骨髓侵犯等分布上差异无统计学意义(均P>0.05)。所有患者的血常规及血生化检查指标、甲状腺功能、皮质醇水平、脑钠钛等均未见异常,见表1。

表1 治疗组和对照组患者的临床基线特征[n(%)]Tab.1 Clinical baseline characteristics of patients in the therapy group and the control group[n(%)]
2.2 治疗情况
治疗组患者中,接受单药PD-1抑制剂(纳武利尤单抗4例、帕博利珠单抗4例、信迪利单抗10例、特瑞普利单抗12例)治疗的患者中位治疗时长为24个月(范围:8~24个月),平均治疗时长为21.9个月,其中6例患者因疾病进展更换其他治疗方案继续治疗,2例患者因疾病进展死亡,未见因治疗毒性等因素停药病例。对照组共8例患者因疾病进展接受其他方案继续治疗,4例因疾病进展死亡。
2.3 生存情况
对照组中位随访时间为30个月(范围:15~36个月),治疗组中位随访时间为30个月(范围:11~36个月),治疗组生存呈改善趋势,但因随访时间较短,OS数据尚不足以分析,见图1。治疗组和对照组2年RFS率差异无统计学意义(80.0%vs73.3%,P=0.542),见图2。亚组分析显示,在IPI评分≥3分患者中,治疗组患者的2年RFS率高于对照组(70.0%vs22.2%,P=0.037),见图 3;non-GCB型患者中,治疗组患者的2年RFS率也高于对照组(90.9%vs45.5%,P=0.022),见图4。而两组不同年龄、疾病分期、性别、ECOG评分、B症状、骨髓侵犯患者的2年RFS率差异无统计学意义(均P>0.05),见表2。
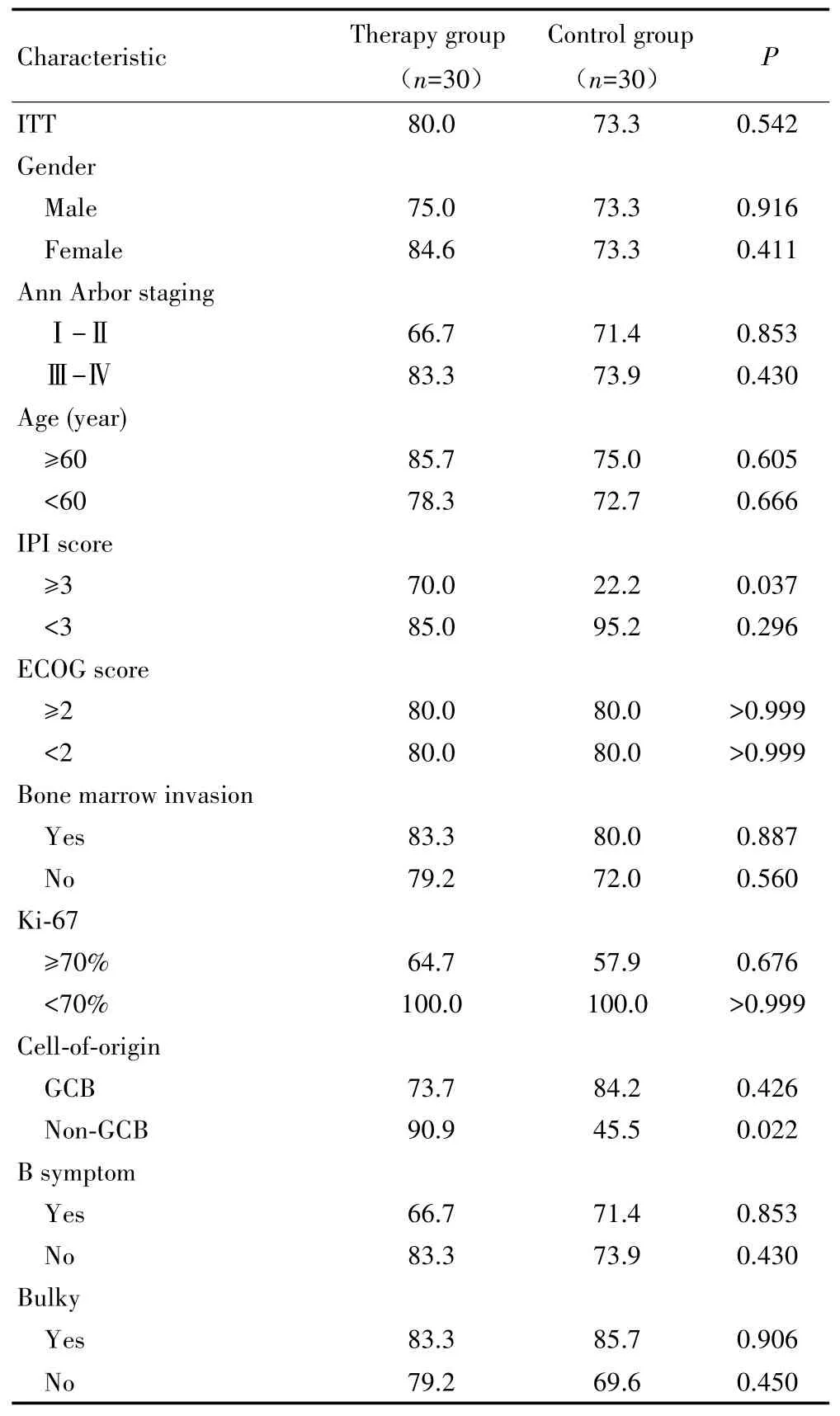
表2 治疗组和对照组患者2年RFS率的比较(%)Tab.2 Comparison of 2-year RFS between therapy group and control group(%)
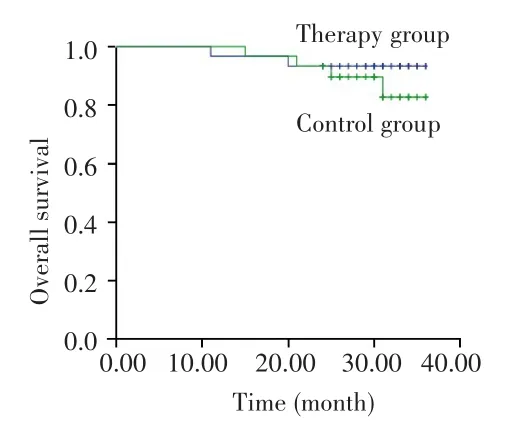
图1 治疗组与对照组患者的总生存曲线Fig.1 Overall survival curves of patients in the therapy group and control group
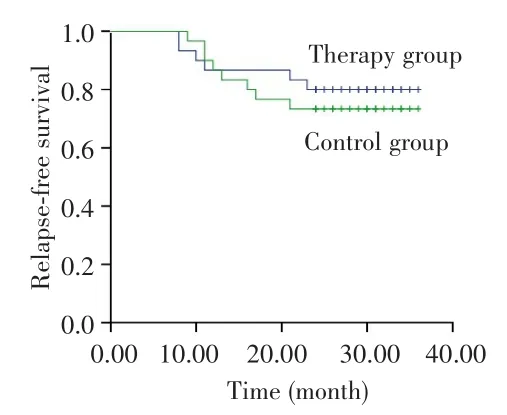
图2 治疗组与对照组患者的无复发生存曲线Fig.2 Relapse-free survival curves of patients in the therapy group and control group
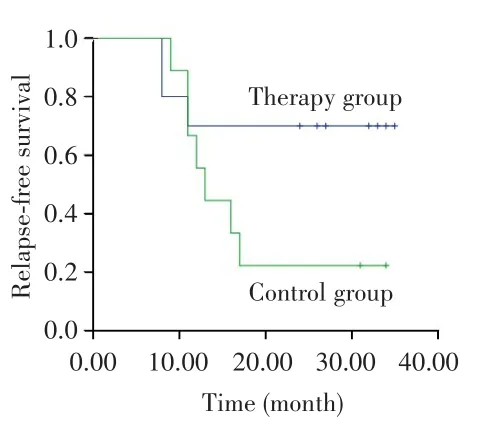
图3 治疗组与对照组IPI≥3分患者的无复发生存曲线Fig.3 Relapse-free survival curves of IPI≥3 points patients in the therapy group and control group
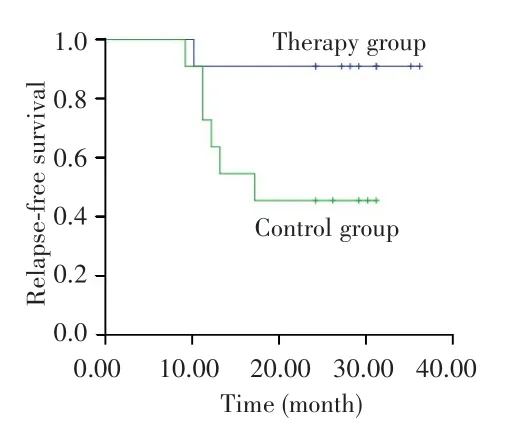
图4 治疗组与对照组non-GCB型患者的无复发生存曲线Fig.4 Relapse-free survival curves of non-GCB patients in the therapy group and control group
2.4 不良反应发生情况
治疗组患者主要不良反应均为Ⅰ~Ⅱ级:皮疹2例(6.7%)、白细胞下降5例(16.7%)、甲状腺功能减退3例(10.0%)、肝功能损害1例(3.3%)、血小板减低1例(3.3%)、糖脂代谢异常1例(3.3%)、消化道反应1例(3.3%),未见免疫性肺炎、心功能不全、皮质醇异常等不良反应。对照组患者随访未见明确的不良事件发生。
3 讨论
DLBCL患者一线接受R-CHOP方案能显著改善预后,但经诱导化疗取得CR后仍面临疾病复发进展风险。前期研究[15]显示DLBCL患者诱导化疗缓解后复发事件多发生于前2年,而保持2年无事件生存后患者后续复发的概率明显下降,此后3年累计复发率为6.9%,5年复发率为9.3%,8年复发率为10.3%,说明降低疾病缓解后前2年的复发率尤为重要。维持治疗的目的是通过选择有效、低毒的治疗药物让患者进行一定时期的治疗,进一步清除体内残存微小肿瘤细胞,从而尽量延缓复发时间,延长生存期。因此,如何选择合适的维持治疗方案备受关注。
PD-1抑制剂的主要作用机制是通过结合PD-L1受体解除肿瘤细胞对T淋巴细胞的免疫逃逸,恢复人体内T细胞对肿瘤细胞的杀伤作用,最终达到抑制肿瘤进展的目的。目前,PD-1抑制剂已在淋巴瘤中有较多的临床应用[16]。在抗肿瘤机制方面,免疫治疗相对传统化疗药物有着根本的区别,同时还具有不良反应发生率低、患者耐受性好等优点。临床研究[17]显示帕博利珠单抗联合R-CHOP方案在初治DLBCL患者中的ORR达90%,CR率达到77%,且未明显增加治疗不良反应。但也有研究提示免疫检查点抑制剂治疗DLBCL的疗效参差不齐,而研究结果不一致的原因考虑主要与DLBCL高度异质性相关[18]。单药PD-1抑制剂(纳武利尤单抗)在难治/复发DLBCL中的治疗反应也较差,ORR为3%~10%,中位PFS为1.4~1.9个月,6个月中位PFS和OS分别为5.2%~19.1%和 47%~67%[19-20]。此外,对于 DLBCL 而言,淋巴瘤的免疫微环境较复杂,进一步厘清DLBCL的免疫杀伤机制,寻找可靠的免疫治疗生物标志物可能是未来免疫性治疗DLBCL的出路之一。因此,基于患者疾病特点遴选出对免疫治疗有效的DLBCL患者接受PD-1抑制剂维持治疗可能会提高RFS。
本研究选择临床上常用的PD-1抑制剂作为DLBCL患者获得CR后的维持治疗药物,评估维持治疗疗效发现治疗组对比对照组在RFS、OS上表现出一定改善趋势,单因素分析显示IPI评分≥3分、non-GCB型DLBCL患者接受PD-1抑制剂维持治疗在2年RFS率中获益明显。ECOG 4494临床研究[8]旨在评估≥60岁DLB-CL患者接受CHOP或R-CHOP诱导化疗后再使用利妥昔单抗维持治疗的疗效,研究结果显示利妥昔单抗维持治疗仅改善了使用CHOP诱导化疗达到PR或CR患者的2年无事件生存率,但并未改善使用R-CHOP诱导化疗患者的无事件生存率。REMARC研究[10]显示,使用来那度胺维持治疗能改善60~80岁患者的PFS,来那度胺维持治疗组和安慰剂组中位PFS分别为54个月和38.6个月(P=0.01),但OS无明显差异。本研究结果与既往研究数据相比,PD-1抑制剂在控制DLBCL复发方面表现出一定优势,值得进一步探索。当然,影响DLBCL患者预后及治疗反应的因素较多[15],精准、合理地选择患者类型符合当下精准治疗的要求,也是影响维持治疗在DLBCL治疗中能否获得成功的关键。本研究亚组分析显示,对于IPI评分≥3分、non-GCB型这两种预后不良的DLBCL患者,PD-1抑制剂维持治疗改善RFS的优势更加明显。考虑可能原因为高IPI评分患者大多肿瘤分期较晚、肿瘤负荷较大,常规诱导化疗后即使影像学评估获得CR,但是患者体内淋巴瘤的微小残留也难以转阴;而non-GCB型DLBCL患者的肿瘤细胞表面存在较高比例的PD-L1过表达情况[21],PD-L1过表达也可能是此类患者独立的预后不良因素[22]。因此认为,伴有以上这两种预后不良因素的DLBCL患者是临床上较容易出现难治复发的人群,也是对维持治疗可能获益的人群。
除疗效外,免疫治疗安全性也是不容忽视的问题。前期研究[23]显示,PD-1抑制剂治疗带来的主要不良反应有甲状腺功能异常、皮疹、免疫性肺炎、血糖血脂代谢异常、血象减低、心功能不全、皮质醇分泌异常等。本研究显示应用PD-1抑制剂维持治疗安全可控,未出现因不良反应导致的停药或死亡事件,说明PD-1抑制剂单药作为DLBCL的维持治疗手段较安全。本研究安全性数据与既往研究数据[24]相比,总体不良反应发生率较低、程度较轻,除考虑与样本量偏小有关外,免疫治疗在淋巴瘤特别是DLBCL中是否存在不同的免疫相关不良反应机制值得进一步研究。
本研究存在以下局限性:⑴PD-L1表达与DLBCL患者接受免疫治疗疗效的相关性尚不明确,且目前PD-L1的免疫组化检测缺乏统一的判读标准,因此本中心的免疫组化项目尚未常规开展PD-L1检测。⑵治疗组中使用的药物包括纳武利尤单抗、帕博利珠单抗、信迪利单抗、特瑞普利单抗,虽然同属PD-1抑制剂,但其疗效和安全性有一定差异,本研究未能进一步作治疗组的亚组分析及多因素分析。⑶本研究为单中心回顾性分析,但最终纳入的两组患者基线水平相当,可能是由于样本量较少造成,未能进一步采用Cox比例风险回归模型校正混杂因素,而这些因素可能影响OS、RFS的分析结果。因此,未来仍需开展前瞻性、多中心、随机对照、双盲队列研究进一步证实及探索该方案的疗效与安全性。
