BCL-2抑制剂在血液系统恶性肿瘤中的研究进展
2021-09-26王赫男王亮
王赫男 王亮
在目前的血液系统恶性肿瘤靶向治疗中,直接刺激癌细胞线粒体凋亡途径是一种新的治疗策略。B细胞淋巴瘤因子2(B-cell lymphoma-2,BCL-2)家族是细胞内源性凋亡信号转导通路中的关键凋亡因子,BCL-2家族蛋白功能缺失也是众多血液系统恶性肿瘤的特征之一。BCL-2是目前主要研究的拮抗凋亡的抗肿瘤靶点,可在多种内源和外源压力下保护肿瘤细胞逃避凋亡,在多种血液系统恶性肿瘤中均呈不同程度高表达,其相应靶点抑制剂也已有众多临床前及临床研究[1]。维奈克拉(Venetoclax,ABT-199)是第一个上市的BCL-2选择性抑制剂,目前主要被批准用于慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)和急性髓系白血病(acute myelocytic leukemia,AML)的治疗。为了更好地理解这一新型治疗策略的前景,本文就BCL-2抑制剂的作用机制、研发过程及其在血液系统恶性肿瘤中的关键临床研究数据作一简要综述。
1 BCL-2家族与血液系统恶性肿瘤
1.1 BCL-2蛋白家族及调控机制
BCL-2基因最早在滤泡性淋巴瘤(follicular lym-phoma,FL)t(14:18)染色体易位中被发现[2],其致癌机制与早期发现的受体酪氨酸激酶(receptor tyrosine kinase,RTK)、髓细胞增生原癌基因(myelocytomatosis oncogene,MYC)等不同,不是通过促进细胞增殖,而是通过抑制细胞凋亡使肿瘤细胞在没有高增殖的情况下累积。BCL-2是第一个被发现与细胞凋亡有关的哺乳动物基因,随后引发了一系列关于凋亡的研究,并因此逐渐认识到逃避细胞死亡是癌症的重要标志,也是许多血液系统恶性肿瘤的重要特征。
BCL-2蛋白家族主要调控内源性细胞凋亡过程,即调控线粒体/细胞色素c介导的凋亡通路。目前共发现了27个BCL-2家族蛋白成员,根据其功能可以分成拮抗和促进细胞凋亡两类[3]。拮抗细胞凋亡的蛋白共有6个,即BCL-XL、BCL-2、BCL-W、MCL-1、BCL-B和BFL-1,具有抑制凋亡通路作用[4]。促进凋亡蛋白有两类,一类是线粒体损伤的最终执行者,即BAX和BAK。当这两者被激活时可以形成寡聚体而作用于线粒体外膜,线粒体外膜被破坏后,细胞色素c被释放从而激活caspases完成凋亡过程。BCL-2及其他拮抗凋亡蛋白通过直接结合BAX和BAK起抑制凋亡作用。另一类促进凋亡蛋白是BH3-only亚类,其中又分为激活子(包括BID、BIM,可直接活化BAX/BAK)以及敏感子(BAD、BIK、NOXA、HRK、PUMA 和 BMF等)。BH3-only蛋白也是BCL-2等拮抗凋亡蛋白的天然拮抗剂。BH3-only蛋白接受应激信号刺激后(如DNA损伤、氧化应激等),可以激活激活子,然后直接活化BAX/BAK,从而激活caspases级联凋亡反应,同时激活敏感子与抗凋亡蛋白竞争性结合[5]。BCL-2蛋白家族调控内源性细胞凋亡过程见图1。
1.2 BCL-2家族拮抗凋亡蛋白在血液系统恶性肿瘤中的表达
拮抗和促进细胞凋亡的BCL-2家族蛋白之间的相互作用和动态平衡决定着细胞的生死,细胞是否开始凋亡过程取决于细胞内各种促进和拮抗凋亡信号的整合,正常情况下细胞凋亡过程被严格调控,而这一过程在很多血液系统恶性肿瘤中被破坏。在正常细胞中,BAX和BAK直接被BCL-2及其他相关蛋白抑制,而细胞应激信号如DNA受损诱发的TP53激活会促进BH3-only蛋白激活,然后通过直接结合BCL-2与BAX/BAK结合的位点达到中和BCL-2蛋白的目的。而BH3-only蛋白功能丢失可破坏细胞凋亡调控过程。在CLL中,一种常见的抑制凋亡机制是TP53功能缺失(可能由于17号染色体长臂缺失,del(17p)或/和TP53基因突变造成)。在CLL、骨髓瘤、侵袭性淋巴瘤、B细胞ALL中,del(17p)与预后较差及DNA损伤类化疗药物耐药相关,且TP53通路不能对细胞应激有所反应,从而降低BH3-only蛋白的表达和活性[6]。其他少见的机制包括基因突变、基因沉默等,这些同样能造成BH3-only蛋白功能丢失,从而影响细胞对应激信号的反应[7]。BCL-2及相关拮抗凋亡蛋白过表达也可以破坏细胞凋亡调控过程,且过表达机制呈多样性[8-16],见表 1。总之,BCL-2 几乎在所有的CLL、套细胞淋巴瘤(mantle cell lymphoma,MCL)和华氏巨球蛋白血症中高表达,而在多发性骨髓瘤(multiple myeloma,MM)和弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)中的表达水平差异较大。从机制上来说,拮抗细胞凋亡蛋白的高水平表达是细胞在应激下适应性反应的结果,因此BCL-2高表达的肿瘤细胞可在细胞应激下避免凋亡,理论上这些细胞应该对BCL-2抑制剂高度敏感。

表1 部分血液系统恶性肿瘤中BCL-2家族拮抗凋亡蛋白的表达情况Tab.1 The expression levels of BCL-2 family proteins in some hematological malignancies
2 BCL-2抑制剂的研发
BCL-2的功能可被BH3-only蛋白抑制,BH3-only蛋白结合BCL-2位点同时也是BAX与BCL-2的结合位点,因此一个合理的抗癌药物设计思路便是设计BH3类似物(图1),即通过模拟BH3-only蛋白与拮抗凋亡蛋白如BCL-2相结合,从而抑制BCL-2结合BAX/BAK的能力,达到促进细胞凋亡的目的。目前已有多种根据这一原理设计的BCL-2抑制剂处在临床前及临床研究阶段[1]。第一个BH3类似物是ABT-737,其与BCL-2、BCL-XL、BCL-W结合的亲和性很高,而且在体外实验中对FL和CLL细胞有较好的杀伤作用,但因口服时生物利用率欠佳而停止研发[17]。Navitoclax(ABT-263)就此方面做出了改进[18],且在临床前试验和早期临床试验中表现出对CLL和FL具有单药抗肿瘤作用[19],但因对BCL-XL具有抑制作用导致研发失败。BCL-XL是血小板正常生存的关键因子[20],但是Navitoclax会抑制BCL-XL,从而导致血小板凋亡,引发急性血小板减少,而且这一过程在用药后48~72 h即可发生。虽然如此,研发过程中Navitoclax在复发难治CLL中获得一定疗效,部分缓解(partial response,PR)率约为35%,中位无进展生存期(progression-free survival,PFS)约为25个月[21]。也正因为以上研究经验,学者们逐渐认识到BCL-2特异性的BH3类似物可能成为一种新型的抗癌药物,而维奈克拉正是在此背景下被研发出来。
3 维奈克拉:选择性BCL-2抑制剂
维奈克拉是第一个BCL-2选择性BH3类似物,也是目前该类型抗癌药物唯一上市的。同Navitoclax一样,大量临床前数据表明,维奈克拉通过诱发凋亡过程杀死血液系统肿瘤细胞,这一过程依赖于BAX/BAK,但其对BCL-2的亲和性是BCL-XL和BCL-W的100倍以上,体外实验也证明血小板对维奈克拉相对耐受[22]。维奈克拉的第一个临床试验[23]是在复发/难治CLL患者中进行,患者服药后8~24 h可观察到剂量依赖性的淋巴细胞计数减少,第一次服药后6 h及24 h时,外周CLL细胞可见caspases激活及细胞膜磷脂酰丝氨酸暴露,这也在体内印证了维奈克拉的抗肿瘤机制是促进细胞凋亡。
维奈克拉自2011年6月起开始进行临床试验,2016年之后临床试验数量逐渐增多。基于BCL-2在多种血液系统肿瘤中均有不同程度表达,维奈克拉也在多种血液系统肿瘤中开展单药或联合用药的临床试验,目前已有数百个相关临床试验正在进行中。
3.1 维奈克拉与CLL
BCL-2在所有CLL细胞中均高表达,且绝大多数CLL细胞依赖BCL-2生存。与此一致的是,维奈克拉单药在大部分复发/难治CLL患者中有效,但完全缓解(complete remission,CR)率较低[23]。维奈克拉已被美国FDA批准用于治疗成人CLL或小淋巴细胞淋巴瘤(small lymphocytic lymphoma,SLL)。而维奈克拉单药治疗CLL/SLL的有效性主要基于3个单臂试验结果:M13-982 研究[24](具有 del(17p)的 CLL,n=106,ORR=80%,CR+CRi=8%);M12-175 研究[23](经治CLL/SLL,n=67,ORR=71%,CR+CRi=7%,PR 率为64%,有效人群中83%缓解持续时间超过12个月);M14-032研究[25](经治CLL使用伊布替尼或Idelalisib后进展患者,n=109,ORR=70%,CR+CRi=1%,PR=69%)。此外,还有研究发现维奈克拉单药反应率独立于CLL基因亚型,但是在多变量分析中发现,提示预后不良的基因标志del(17p),TP53突变以及NOTCH1突变与疾病稳定时间较短相关,而达到CR、在外周血或骨髓中测不到微小残留病变(undetectable minimal residual disease,uMRD)的患者能获得更长时间的缓解[26]。
研究还发现,相比维奈克拉单药治疗,联合治疗似乎能提高治疗总反应率。目前尚无临床随机试验对比维奈克拉单药与维奈克拉联合利妥昔单抗或其他CD20单抗的疗效差异,但在一些早期临床试验中维奈克拉与利妥昔单抗联用的CR率(51%)和uMRD率(57%,骨髓中)优于单药治疗[27]。研究显示,维奈克拉联合利妥昔单抗在复发/难治CLL患者中可显著延长PFS,2年PFS可达85%,3年PFS为71%,且CLL患者不需要长期持续服用维奈克拉,在达到CR或uMRD的患者缓解持续时间很长[28-30]。这些研究推动了有限疗程维奈克拉与CD20单抗联合治疗的关键临床研究进展。如在复发/难治患者中,维奈克拉与利妥昔单抗联合治疗以及维奈克拉与奥比妥单抗联合用于一线治疗CLL的一项临床试验显示CR率(分别为27%和50%)和外周血uMRD率(分别62%和76%)均较高[31]。多项临床随机试验也表明(表2),在复发/难治CLL中,维奈克拉与利妥昔单抗联用在有效性与药物毒性方面均优于与苯达莫司汀及或妥昔单抗联用。在初治CLL患者中,作为一线用药,维奈克拉与奥比妥单抗联用在PFS方面优于苯丁酸氮芥与奥比妥单抗联用方案,但毒副作用相当,因此这两种用药方案在多个地区也已成为标准治疗方案。目前有较多临床试验(表2)在研究维奈克拉与伊布替尼及其他BTK抑制剂和/或包含CD20单抗联合用药方案,初步数据表明伊布替尼和维奈克拉联合方案具有较高的CR率(51%~74%),但反应率和药物安全性尚缺乏结果。还需要指出的是,目前维奈克拉的最佳使用疗程尚未达成一致,是选择目前推荐的固定疗程还是应该随着治疗反应评估而改变,仍未有定论。与之相关的问题还有缩短疗程是否有助于减少疾病进展时肿瘤耐药的发生,假如能减缓耐药,那么在结束疗程后,若疾病复发可以再次使用维奈克拉治疗。
3.2 维奈克拉与AML
BCL-2在AML中的表达具有异质性,体外实验中仅有一小部分样本对维奈克拉敏感[32-33],临床试验也得出类似结果。在Ⅰ期维奈克拉单药治疗复发/难治AML患者研究中,只有一小部分患者的原始细胞明显减少,仅19%达到CR/CRi且中位PFS很短[34]。这些数据表明维奈克拉对AML的作用并不像对CLL一样能精确打击肿瘤细胞,而是通过凋亡机制增强抗肿瘤作用,其作用机制可能更复杂。因此,在使用维奈克拉治疗AML中,联合其他药物至关重要。第一批研究的联合用药包括低剂量阿糖胞苷,去甲基化药物阿扎胞苷和地西他滨。在复发/难治AML中,联合用药的CR/CRi率高于单药治疗[35-36]。根据早期临床研究结果,维奈克拉联合低剂量阿糖胞苷、阿扎胞苷或地西他滨已被美国FDA批准作为治疗老年或不适合化疗AML患者的一线疗法,且已在Ⅲ期、随机、安慰剂对照临床试验中被证实[37]。在75岁以上或不适合诱导化疗的初治或经治(部分曾用去甲基化药物)AML患者中,低剂量阿糖胞苷基础上增加维奈克拉可提高OS和无事件存活率,CR率在维奈克拉联合治疗中也明显提高[38]。在同样患者群中,在阿扎胞苷基础上增加维奈克拉也能可提高OS及EFS[39]。在这两项研究中,中位OS均可提高4~5个月,且既往AML中的预后标志同样适用于维奈克拉为基础的治疗方案。总之,目前研究的热点集中关注维奈克拉能否在适合诱导化疗的AML患者一线治疗中具有地位。从机制上,维奈克拉在体外可诱导粒系祖细胞凋亡,体内实验也表明维奈克拉会引起粒细胞缺乏,因此一线治疗中加入维奈克拉会有严重的额外骨髓抑制作用,其用药时间也尚未有公论。
3.3 维奈克拉与淋巴瘤
维奈克拉在淋巴瘤的治疗中具有很大潜力,但BCL-2在不同淋巴瘤类型中表达差异较大,BCL-2过表达机制也不同,维奈克拉对不同类型淋巴瘤的治疗效果差异也很大。目前B细胞淋巴瘤中部分维奈克拉单药及联合治疗的临床试验结果(表2)显示,维奈克拉单药治疗效果不佳,但与BTK抑制剂等联合治疗具有协同作用。其中,在FL中BCL-2表达水平很高,但维奈克拉单药治疗的反应率很低[40],维奈克拉与苯达莫司汀/利妥昔单抗联用反应率也不理想[41],这一矛盾的原因尚不清楚。MCL对BCL-2抑制剂单药敏感,在复发/难治患者中具有75%的反应率;而维奈克拉与伊布替尼联用具有叠加效应,70%以上的患者达到CR,复查PET-CT提示病灶消失;30个月后,74%的维奈克拉有效患者未见复发,而且不需要长期服用药物维持[40,42]。此外,维奈克拉与奥比妥单抗、伊布替尼联用也取得了较好的试验结果[43]。在DLBCL中BCL-2表达具有高度异质性,因此维奈克拉单药治疗复发/难治DLBCL患者效果不佳(ORR=18%,CR=12%,mPFS=1月)[40],但维奈克拉与BTK抑制剂伊布替尼、R-CHOP方案及放疗联用具有协同效用[44]。
3.4 维奈克拉与MM
MM细胞大多表达高水平BCL-2,正常浆细胞也表达BCL-2。临床试验(表2)显示,维奈克拉单药有效很大程度上局限于t(11∶14)类型患者[45-47],这与临床前数据一致,即该亚型中BCL-2表达水平最高[48]。在一些非t(11∶14)类型但BCL-2/BCL-XL表达较高的MM患者中,同样可以看到维奈克拉的疗效。此外,维奈克拉联合用药时反应率和CR率更高[46]。但维奈克拉联合硼替佐米、地塞米松的疗法在非t(11∶14)或BCL-2/BCL-XL表达较高的MM患者中的安全性具有争议[49-50]。而相对BCL-2抑制剂,MCL-1抑制剂可能对更多MM患者有效,目前正在进行早期临床试验[51]。
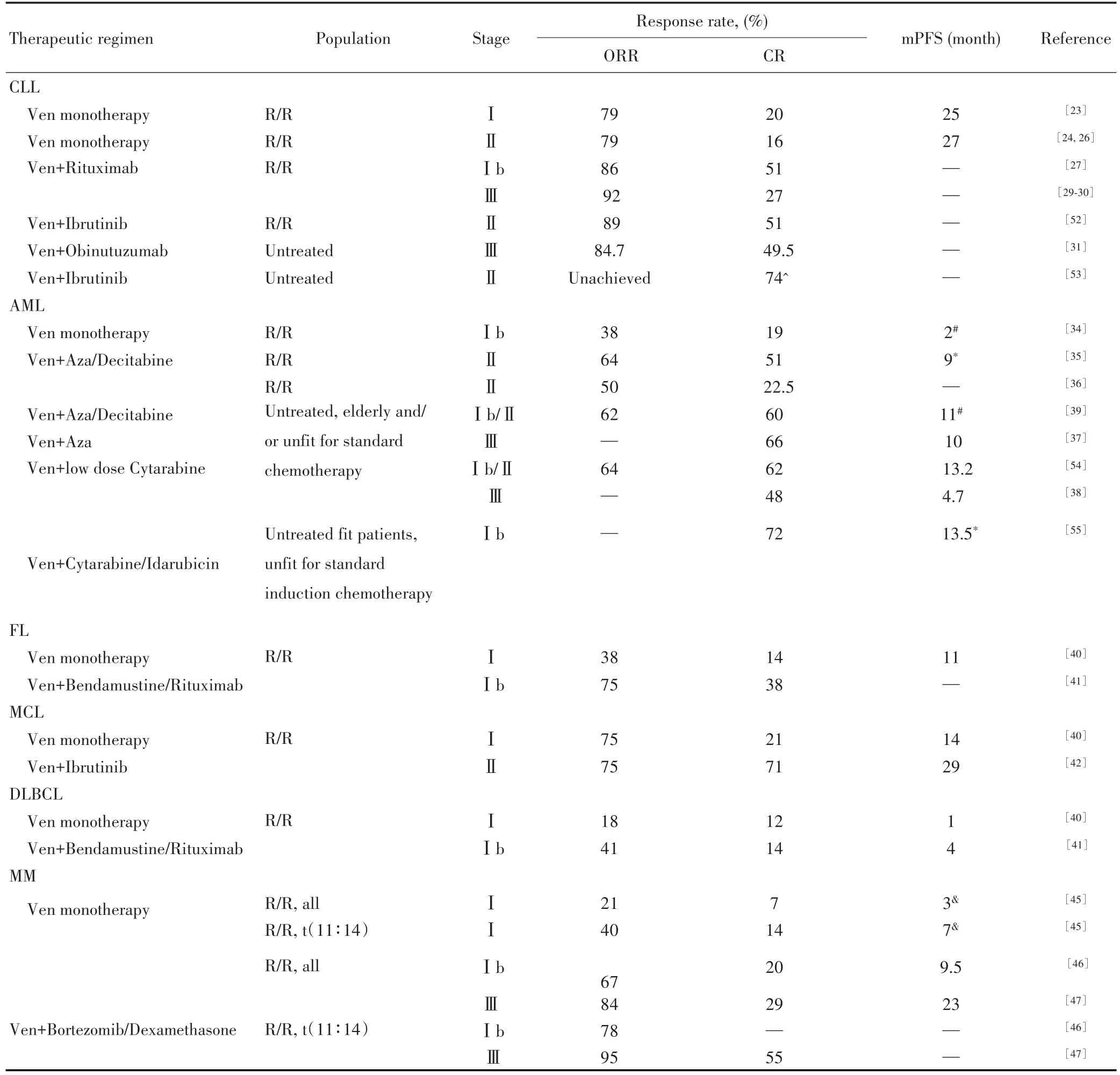
表2 维奈克拉在血液系统恶性肿瘤中的代表性临床试验结果Tab.2 Representative clinical trial results of Venetoclax in hematologic malignancies
3.5 维奈克拉与骨髓增生异常综合征
BCL-2在高危型骨髓增生异常综合征(myelodys-plastic syndromes,MDS)患者中过表达,体外实验表明抑制BCL-2可诱导MDS祖细胞凋亡[56-57]。目前去甲基化治疗是高危MDS患者的标准治疗方案,大约50%的患者有效,但是大多患者会发生疾病进展。维奈克拉在MDS中的研究方案与AML类似,目前维奈克拉联合去甲基化药物方案在初治及复发/难治MDS中的疗效正在进行Ⅰ期临床试验[58]。真实世界回顾性研究显示,44例复发/难治MDS患者中,维奈克拉联合阿扎胞苷或地西他滨方案总反应率为59%,中位起效时间为1.6个月,中位OS为19.5个月[59]。
4 其他BCL-2抑制剂
除维奈克拉外,目前有十余种新型BCL-2抑制剂正在进行临床前研究,对多种BCL-2阳性肿瘤的临床试验也在进行中。S55746、APG-2575是其中的佼佼者。S55746目前已进入临床试验阶段,在成人复发/难治非霍奇金淋巴瘤(non-Hodgkin lymphoma,nHL)中单药治疗的安全性及耐受性良好,初步证据表明其在多种nHL中均发挥作用,尤其在DLBCL中具有良好反应[60]。APG-2575是第一个在我国进入临床阶段的、本土研发的BCL-2抑制剂,作为单药或联合疗法,目前在全球范围内有9项临床试验正在进行,已获得4项FDA孤儿药认证,适应证分别为CLL、MM、华氏巨球蛋白血症及AML。动物实验显示中,APG-2575与BTK抑制剂或p53抑制剂联用在DLBCL中具有协同效应,能够显著增强抗肿瘤效果,延长生存时间[61]。APG-2575在复发/难治CLL/SLL的早期临床疗效也十分理想,15例复发/难治CLL/SLL患者中有12例获得PR,ORR约为80%;安全性方面,1 200 mg用药剂量也未观察到剂量限制毒性,无肿瘤溶解综合征发生[62]。
5 小结与展望
作为BCL-2抑制剂中第一个获批的抗肿瘤药物,维奈克拉在多种血液系统恶性肿瘤中均有良好的疗效,这些临床试验的用药经验有助于今后同类型药物的进一步开发。维奈克拉主要有以下特点:⑴维奈克拉具有细胞毒性,可以迅速杀死对其敏感的细胞,通常发生在第一次用药之后数小时内。⑵有关CLL、AML及淋巴瘤研究均表明,使用维奈克拉后达到CR的患者能获得更长的缓解时间。⑶为了达到最好的治疗效果,维奈克拉与其他药物联用必不可少,目前已证明维奈克拉可与多种不同类型的药物联用。⑷对维奈克拉敏感的肿瘤中,凋亡调节因子的遗传学或表观遗传学改变可能会引起继发的临床耐药,比如BCL-2突变可能引起维奈克拉与之结合减少,而这可能是导致长期维奈克拉治疗CLL患者晚期复发的主要原因,另外一些机制包括MCL-1过表达或BCL-XL表达上调,这些机制在CLL及MCL中已有报道。总之,目前针对BCL-2抑制剂的基础和临床研究方兴未艾,多种同类型药物正在研发中,在不同血液系统恶性肿瘤中这些新型BCL-2抑制剂与其他抗肿瘤药物或RNA/DNA抑制剂联用的疗效,以及维奈克拉在不同血液系统肿瘤中的治疗地位、药物联用方案、使用时间及耐药机制等值得进一步研究。
