TACE联合TKI及PD-1抑制剂在不可切除肝细胞癌患者转化治疗中的疗效
2021-09-26韦滔唐置鸿韦猛林有智陈洁白涛王小波齐鲁楠唐娟黎乐群吴飞翔
韦滔 唐置鸿 韦猛 林有智 陈洁 白涛 王小波 齐鲁楠 唐娟 黎乐群 吴飞翔,2
肝癌是常见的恶性肿瘤,在世界范围内每年约有90.6万新发病例及83万死亡病例,在我国肝癌位居肿瘤致死病因第2位[1-2]。手术是肝癌患者获得长期生存最重要的治疗手段。但肝癌起病隐匿,发现时大多数已处于中晚期,失去手术机会,5年生存率不足20%[3-4]。近年来随着局部治疗以及靶向治疗、免疫治疗的发展,肝癌的治疗模式发生了重大改变,联合治疗逐渐成为趋势,如局部治疗联合靶向治疗、靶向治疗联合免疫治疗等。部分患者甚至实现了由初始不可切除转化为可切除,从而改善了预后。最近一项肝动脉灌注化疗联合仑伐替尼及特瑞普利单抗治疗晚期肝癌的研究结果显示了较好的疗效[5],提示局部治疗联合靶向及免疫治疗在抗肿瘤机制上可能具有协同效应,但是目前尚未有经肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)联合酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)及程序性死亡受体-1(programmed death-1,PD-1)抑制剂的研究报道。本团队开展了一项TACE联合TKI及PD-1抑制剂应用于不可切除肝细胞癌转化治疗的临床研究,以期探索更有效的转化治疗方法。
1 资料与方法
1.1 一般资料
收集并分析2019年11月至2020年12月于本院肝脏胰腺病区接受TACE联合TKI及PD-1抑制剂治疗的不可切除肝细胞癌患者的临床资料。纳入标准:⑴年龄18~70岁;⑵不适合手术切除的巴塞罗那临床肝癌(BCLC)分期A、B、C期或中国分期Ⅰb、Ⅱa、Ⅱb、Ⅲa期[2,6-7];⑶肝功能 Child-Pugh A 级或B级(≤7分);⑷ECOG PS评分0~1分;⑸经组织病理学或临床确诊的肝细胞癌(根据原发性肝癌诊疗规范2019年版诊断)[2];⑹至少有1个可测量病灶(mRECIST标准);⑺接受TKI治疗1个月及以上,PD-1抑制剂治疗3次及以上。排除标准:⑴复发性或远处转移肝癌患者;⑵已知对TKI、PD-1抑制剂过敏患者;⑶已知有人类免疫缺陷病毒(HIV)感染史;⑷既往6个月内有消化道出血病史;⑸有器官同种异体移植史;⑹有任何活动性自身免疫性疾病或自身免疫疾病病史;⑺未控制的胸腔积液、心包积液,或中等量以上腹水;⑻有活动性感染;⑼不可控制的高血压病;(10)经评估不适宜采用TACE联合TKI及PD-1抑制剂治疗的其他情况。本研究通过广西医科大学附属肿瘤医院伦理委员会审批(LW2021051)。
1.2 治疗方案
TACE包括传统TACE(conventional TACE,cTACE)或药物洗脱微球TACE(drug eluting beads-TACE,DEB-TACE)。TKI包括仑伐替尼(口服,≥60 kg:12 mg/d;<60 kg:8 mg/d)或索拉非尼(口服,400 mg,每天2次)。PD-1抑制剂包括卡瑞利珠单抗(200 mg静脉注射,每3周1次)或信迪利单抗(200 mg静脉注射,每3周1次)。治疗期间每3~4周进行实验室检查1次,包括血常规、尿常规、肝功能、肾功能、肿瘤标志物、甲状腺功能、心肌酶谱标志物,评估药物不良反应。治疗后每2个月(±1周)进行腹部增强CT或MRI检查评估临床疗效。
1.3 手术治疗
术前进行血液及影像学检查,肿瘤达到转化成功标准后进行手术治疗。转化成功标准:⑴Child-Pugh评分<7分;⑵ECOG PS评分≤1分;⑶无肝外病变;⑷保留肝脏血管结构完整且剩余肝脏体积充足(非肝硬化患者>30%标准肝体积,肝硬化患者>40%标准肝体积)[8]。术后肝衰竭(post-hepatectomy liver failure,PHLF)采用ISGLS标准定义[9]。术后并发症采用Clavien-Dindo评估系统进行分类[10]。
1.4 观察指标和评价标准
主要研究终点为手术转化率,手术转化率定义为转化成功并行手术切除患者占所有患者的比例,手术转化率=(转化成功并手术切除例数/总例数)×100%。次要研究终点为肿瘤反应,包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),客观缓解率(ORR),疾病控制率(DCR),无进展生存时间(PFS),总生存时间(OS),治疗相关不良反应(treatment-related adverse events,TRAE)等。ORR=[(CR+PR)/总例数]×100%,DCR=[(CR+PR+SD)/总例数]×100%。PFS定义为入组时间至疾病进展或死亡的时间;OS定义为入组时间至末次随访或死亡的时间。肿瘤反应采用mRECIST标准进行评估[11]。不良反应采用CTCAE 5.0标准进行评估。
1.5 术后管理
手术后肝功能恢复至Child-Pugh A级或B级(≤7分),术后4~6周恢复TKI联合PD-1抑制剂治疗,时间为6个月。每2~3个月或肿瘤标志物升高怀疑肿瘤复发时进行腹部增强CT或MRI检查。
1.6 统计学方法
采用SPSS 26.0统计软件及Excel 2019版进行数据分析。连续性变量采用中位数(四分位数间距)或中位数(范围)进行描述,分类变量采用n(%)进行描述。采用Kaplan-Meier法计算中位总生存时间、中位无进展生存时间。
2 结果
2.1 基线特征
从2019年11月至2020年12月,本研究共纳入22例接受TACE联合TKI及PD-1抑制剂一线治疗的不可切除肝细胞癌患者,其中男性20例,女性2例;中位年龄为47岁(范围:42~56岁),其余基线资料详见表1。采用cTACE治疗6例、DEB-TACE治疗 7例、cTACE和DEB-TACE均使用9例;仑伐替尼治疗20例,索拉非尼治疗2例;卡瑞利珠单抗治疗16例,信迪利单抗治疗6例。

表1 22例不可切除肝细胞癌患者的基线资料Tab.1 Baseline characteristics of 22 patients with unresectable hepatocellular carcinoma
2.2 临床疗效
22例不可切除肝细胞癌患者中,10例达到转化成功标准,行手术切除,手术转化率为45.5%(10/22)。根据mRECIST标准进行最佳肿瘤反应(定义为所有时间点的最佳反应)评估,获得CR 5例、PR 13例、SD 2例、PD 2例,ORR为81.8%(18/22),DCR为90.9%(20/22)。中位无进展生存时间和中位总生存时间均未达到,见图1。靶病灶直径最佳变化瀑布图及靶病灶直径与基线靶病灶直径比率随时间的变化情况见图2。
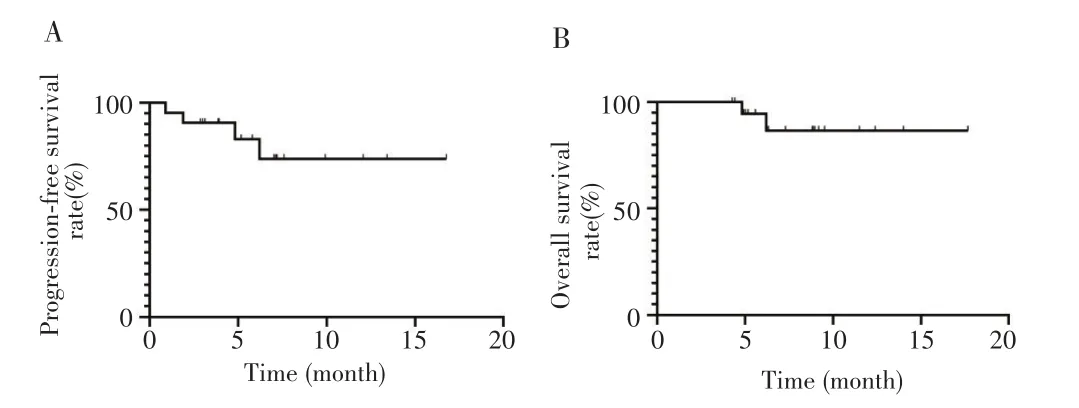
图1 22例不可切除肝细胞癌患者的生存曲线Fig.1 Survival curves of 22 patients with unresectable hepatocellular carcinoma
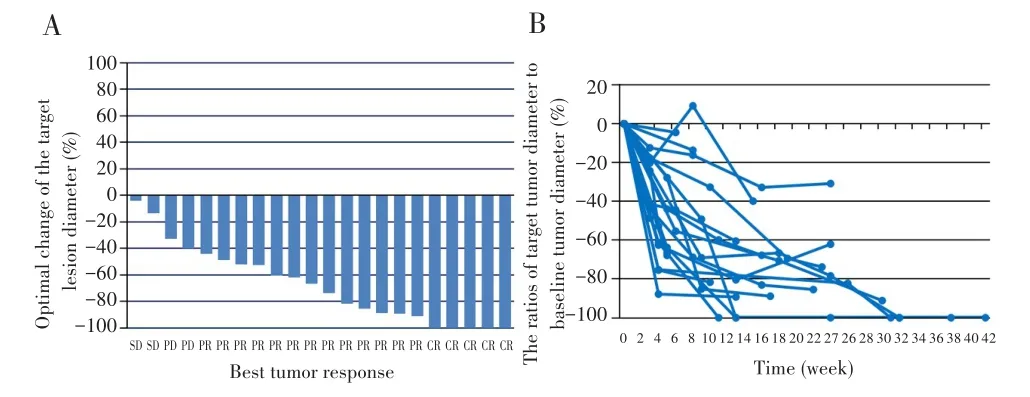
图2 靶病灶直径的变化情况Fig.2 Change of target lesion diameter
2.3 不良反应
22例患者中任意级别的TRAE发生率为100%(22/22),发生率较高的不良反应有谷草转氨酶增高(95%),谷丙转氨酶增高(86%),低白蛋白血症(77%),胆红素增高(68%)。掌跖红肿综合征及皮肤毛细血管增生症发生率分别为27%、14%。≥3级TRAE发生率为59%(13/22),经药物减量、停药、对症处理后均可缓解。不良反应发生情况见表2。

表2 治疗相关不良反应Tab.2 Treatment-related adverse events[n(%)]
2.4 转化治疗成功患者的特点
10例转化治疗成功患者中,男性9例,女性1例;中位靶病灶直径为13.0 cm(IQR:9.6~16.7 cm);单个肿瘤数目6例,多个4例;BCLC-A期1例,BCLC-B期1例,BCLC-C期8例;CNLC Ⅰb期1例,CNLC Ⅱb期1例,CNLCⅢa期8例;无门脉癌栓2例,Ⅰ型门脉癌栓1例,Ⅱ型门脉癌栓3例,Ⅲ型门脉癌栓3例,Ⅳ型门脉癌栓1例;接受cTACE治疗2例,DEB-TACE治疗4例,cTACE和DEB-TACE治疗均使用4例;接受仑伐替尼治疗8例,索拉非尼治疗2例;接受卡瑞利珠单抗治疗7例,信迪利单抗治疗3例;治疗后根据mRECIST评估标准术前影像学评估为CR 4例,PR 6例,10例转化治疗成功患者治疗前后的CT检查结果见图3。不可切除的原因主要包括:Ⅳ型PVTT(1例),Ⅲ型PVTT(3例),Ⅱ型PVTT(2例),Ⅱ型PVTT合并肝中静脉癌栓、Ⅰ型PVTT合并残肝体积不足、肝内多发病灶、残肝体积不足各1例。10例转化治疗成功患者的临床特点见表3。
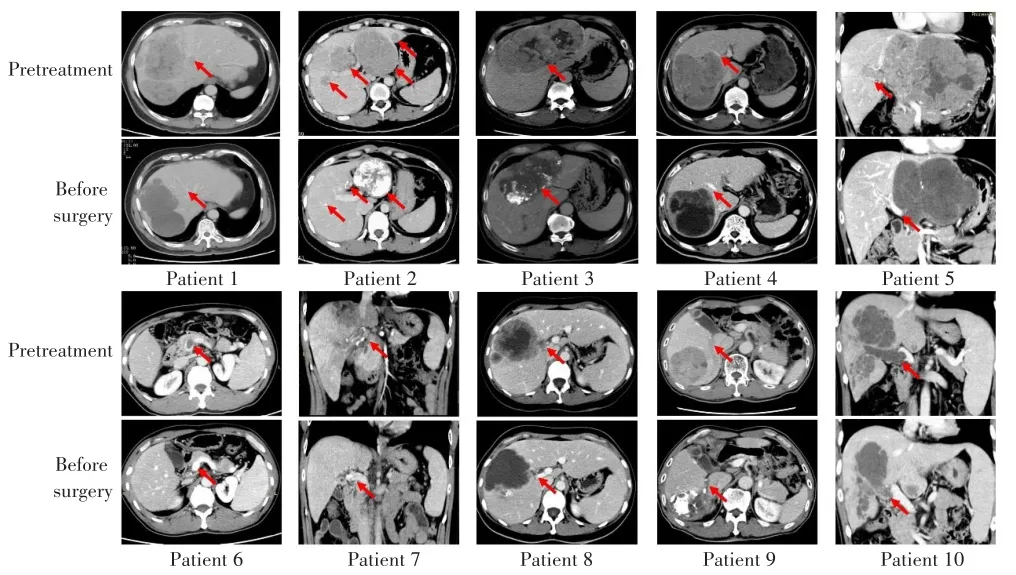
图3 10例转化治疗成功患者治疗前后的CT检查结果Fig.3 CT examination results of 10 patients with successful conversion therapy before and after treatment
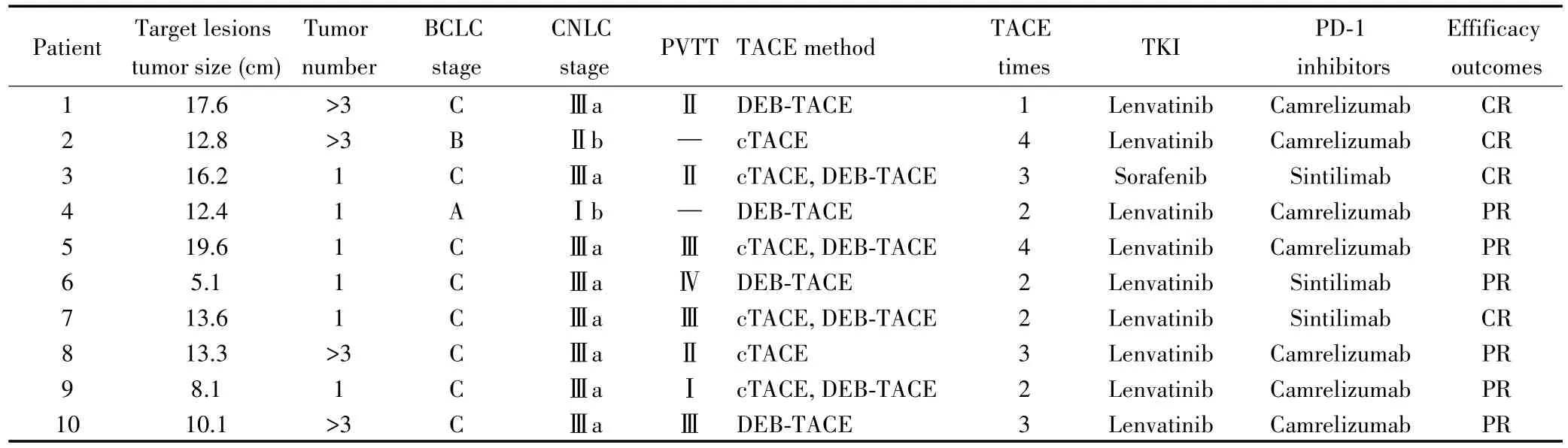
表3 10例转化治疗成功患者的特点Tab.3 Characteristics of 10 patients with successful conversion therapy
2.5 转化治疗成功患者的手术情况
10例转化治疗成功患者从开始治疗到手术的中位时间为4.7个月(IQR:3.4~8.4个月)。术前TKI、PD-1抑制剂中位停药时间分别为7 d(IQR:7~8 d)、35.5 d(IQR:23.5~47.8 d)。中位出血量为225 mL(IQR:100~425mL),中位手术时间为271 min(IQR:210~313 min),术后中位引流管拔管时间为6.0 d(IQR:4.8~8.5 d),术后中位住院天数为10.0 d(IQR:8.5~12.3 d)。1例患者术后出现胆漏(Clavien-DindoⅢa级)。术后获病理完全缓解(pathological complete response,pCR)3例。10例转化治疗成功患者的手术情况见表4。
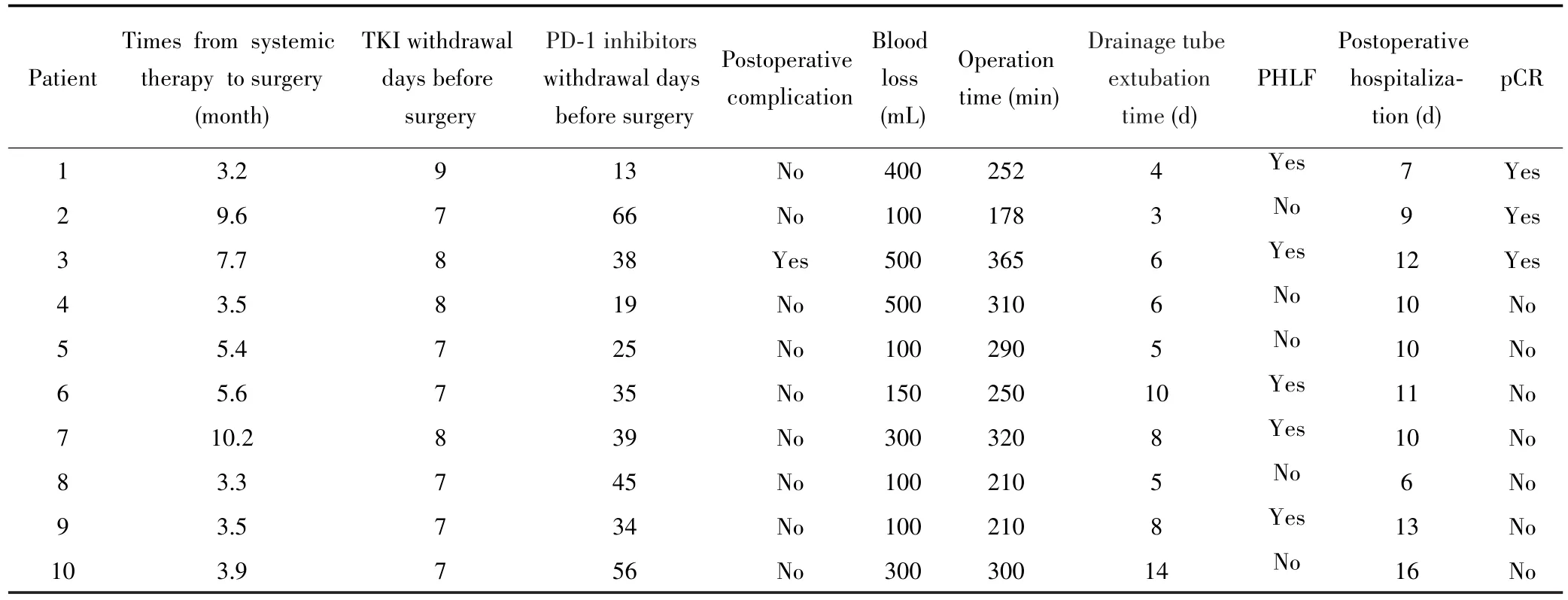
表4 10例转化治疗成功患者的手术前后情况Tab.4 Before and after the operation of 10 patients with successful conversion therapy
2.6 典型病例
1例患者(表3第7号患者)诊断为肝右叶原发性肝癌(BCLC-C期,CNLC-Ⅲa期),接受DEB-TACE联合仑伐替尼及信迪利单抗治疗,联合治疗6个月后达到转化成功标准,CT显示肿瘤无明显活性,PVTT由Ⅲ型降至Ⅱ型。但是患者因个人原因,暂不考虑手术,选择继续仑伐替尼联合信迪利单抗治疗。联合治疗8个月后,患者行右半肝切除术,术后病理HE染色仅门脉右支癌栓旁肝组织内见癌残留,门脉右支癌栓完全坏死,BCLC-C分期降至BCLC-A期。见图4。

图4 1例典型病例的CT及HE染色检查结果Fig.4 CT and HE staining examination results of a representative case
2.7 随访及生存情况
截至2021年5月6日,22例患者的中位随访时间为6.8个月(范围:4.3~17.7个月),随访期间因肺部感染死亡1例患者,因肿瘤进展死亡1例。10例转化治疗成功患者术后中位随访时间为3.5个月(范围:0.5~8.3个月),未见肿瘤复发和死亡患者。
3 讨论
TACE是不可切除肝癌最常用的治疗方法,既往研究报道TACE可使9.8%的患者获得转化手术机会[12],且TACE转化治疗后与可切除患者接受根治性手术的术后5年生存率相当[13]。但是单一TACE治疗仍具有一定局限性,例如单纯TACE治疗肿瘤坏死不完全,应答反应会随着反复多次TACE而下降,远期疗效不佳[14-15]。因此,需要进一步探索更有效的治疗方式,以提高疗效。近年来,肝癌系统治疗的研究取得了突破性进展,如TKI药物索拉非尼、仑伐替尼相继被批准用于晚期肝癌的一线治疗[16-17],PD-1抑制剂纳武利尤单抗、帕博利珠单抗被批准用于晚期肝癌的二线治疗[18-19]。虽然单一药物治疗显示出了一定疗效,但是难以从根本上改善晚期肝癌患者的预后。近年来,陆续有几项研究表明,TKI联合PD-1或PD-L1抑制剂治疗中晚期肝癌取得了较好的效果。例如IMbrave-150研究(阿替利珠单抗联合贝伐珠单抗)、KEYNOTE-524研究(仑伐替尼联合帕博利珠单抗)、RESCUE研究(阿帕替尼联合卡瑞利珠单抗)将不可切除肝癌的ORR进一步提升至33.2%~46%[20-22],为转化治疗提供了更多机会。ZHU等[23]研究表明,TKI联合PD-1抑制剂治疗不可切除肝癌可获得10.2%(6/59)的手术转化率。YANG等[24]采用立体定向放疗联合仑伐替尼及PD-1抑制剂治疗转移性肝细胞癌,手术转化率为23.7%(9/38)。HE等[5]采用肝动脉灌注化疗联合仑伐替尼及特瑞普利单抗也使晚期肝癌获得12.7%(9/71)的手术转化率。本研究结果显示,对于不可切除肝癌患者,接受TACE联合TKI及PD-1抑制剂治疗具有良好的抗肿瘤活性和临床疗效,ORR为81.8%(18/22),疾病控制率为90.9%(20/22),45.5%(10/22)初始不可切除的肝癌转化为可切除肝癌并接受了肝切除术。这一结果证明TACE联合TKI及PD-1抑制剂是不可切除肝癌患者一种有效的转化治疗方案。接受TACE联合TKI及PD-1抑制剂治疗的患者可以观察到较好的治疗效果,可能是由于TACE、TKI和PD-1抑制剂之间具有协同作用。TACE导致缺氧可使VEGF及PD-L1表达增加,促进肿瘤生长[25-28]。而TKI可以阻断VEGF等信号传导通路[29],PD-1抑制剂可以阻断PD-1与PD-L1结合[30],从而实现机制上的互补。
在不良反应方面,本研究中TACE联合TKI及PD-1抑制剂的联合治疗方案未见产生新的或意料之外的治疗相关不良反应,与单独使用这些治疗或联合治疗的不良反应发生情况基本一致[16-17,21-22]。但是治疗相关不良反应发生率与≥3级不良反应的发生率高于上述方法,其中原因可能是没有排除治疗相关不良反应后一过性的肝功能损害,但经过对症治疗后短时间可恢复。
一项大范围肝切除术治疗肝癌的研究结果显示,大范围肝切除术中位术中出血量为400 mL(范围:50~2 000 mL),中位手术时间为210 min(范围:155~255 min),术后中位住院天数为9 d(范围:5~23 d)[31]。另一项TKI联合PD-1抑制剂用于不可切除肝癌转化治疗的研究结果显示,转化治疗的术中平均失血量为(950±746)mL,术后平均住院天数为14 d(范围:11~68 d),肝衰竭发生率为 50.0%[23]。本研究中转化治疗的中位手术时间为271 min(IQR:210~313 min),中位出血量为225 mL(IQR:100~425 mL),术后中位引流管拔管时间为6 d(IQR:4.8~8.5 d),术后中位住院天数为 10 d(IQR:8.5~12.3 d),肝衰竭的发生率为50%,证明TACE联合TKI及PD-1抑制剂转化治疗后的大范围肝切除术是安全的。此外,肝癌切除术后复发转移率高达40%~70%[2],其中门静脉癌栓是术后复发的高危因素[32]。本研究经CT检查发现有4例患者癌栓降型,2例患者癌栓术后病理完全坏死,提示转化治疗可达到癌栓降型的效果,并可能改善预后,值得进一步研究证实。
综上所述,TACE联合TKI及PD-1抑制剂用于不可切除肝癌安全有效,是一种可行的转化治疗策略。本研究也存在一定局限性:第一,本研究所使用的TACE方法、TKI种类、PD-1抑制剂种类组合不统一,因此尚不能确认最佳的组合方式;第二,转化治疗术后随访时间较短,长期疗效仍需随访观察;第三,本研究是单中心研究,样本量较小,研究结果仍需大样本多中心的随机对照研究验证。
利益冲突本文所有作者均声明不存在利益冲突。
