活性氧(ROS)对类风湿性关节炎骨破坏的影响研究①
2021-09-25郭婉怡袁蓓张铌雪孔祥英苏晓慧林娜中国中医科学院中药研究所北京100700
郭婉怡 袁蓓 张铌雪 孔祥英 苏晓 慧林娜(中国中医科学院中药研究所,北京100700)
关节周围的软骨破坏和骨质侵蚀是类风湿性关节炎(rheumatoid arthritis,RA)的主要病理特征,也是RA患者致残的主要原因[1]。约75% RA患者在发病的头两年即发生骨质破坏,60%患者5年内会出现不同程度的关节畸形及骨质侵蚀。一旦骨质遭到破坏,则意味着其病理改变进入不可逆期。因此,延缓甚至阻断骨质破坏是RA治疗的重要策略之一。
现代研究证明氧化应激在RA病情进展中具有重要作用,其中活性氧(reactive oxygen species,ROS)作为氧化应激的产物,大量存在于RA患者的关节腔内,通过临床试验证实ROS可作为RA患者病情进展的一个潜在标记物[2-3]。当RA关节局部炎症反应加速,产生ROS超过生理承受能力时,其不仅可以损伤蛋白质、脂质、核酸等,而且还能作为重要的内源性信号调节因子,扩大滑膜炎症反应[4-7]。以往研究证实,ROS对于RA滑膜成纤维细胞的增殖以及炎症因子的产生有很明显的促进作用,抑制ROS可以显著下调RA滑膜成纤维细胞分泌的炎症因子IL-1、IL-6和IL-33等[8-9]。然而,ROS与RA骨破坏的关系如何,ROS能否调控破骨细胞的形成和分化等相关问题尚待明确。本文拟通过建立CIA大鼠模型检测ROS的水平及体外破骨细胞分化体系考察ROS的变化规律,来揭示ROS与RA骨破坏的关系,为抗RA骨破坏药物研发提供依据。
1 材料与方法
1.1 材料
1.1.1 动物SPF级雄性C57BL/6小鼠,6~8周龄;SPF级雄性SD大鼠,体重(150±20)g。动物均购于北京华阜康生物科技股份有限公司[许可证号SYXK(京)2015-0041],饲养于中国中医科学院中医基础理论研究所实验动物中心,日光灯照明,空调控温,实验操作符合中国中医科学院中医基础理论研究所实验动物福利伦理审查委员会标准2018-066。适应性饲养5 d用于实验。
1.1.2 主要试剂与仪器N-乙酰半胱氨酸(N-acetyll-cysteine,NAC)购自英国Abcam公司;α-MEM培养基(货号:SH30265.01)和优质胎牛血清(货号:ST30-3302)购自Gibco公司;Trizol试剂(批号:15596018)购自美国Invitrogen公司;逆转录试剂盒(批号:K1622)购自美国Thermofisher公司;CTSK(组织蛋白酶K)、MMP-9(基质金属蛋白酶9)、TRAP(抗酒石酸酸性磷酸酶)、GAPDH(磷酸甘油醛脱氢酶)引物序列由Life Technologies公司合成;RANKL、M-CSF(批号分别为315-11、315-02)购自美国Peprotech公司;2 mg/ml牛Ⅱ型胶原溶液和不完全弗氏佐剂(IFA)(货号分别为20022、7002)购自Chondrex公司;苏木精、伊红染色液(货号分别为ZLI-9610、ZLI-9613)购自北京中杉金桥生物技术有限公司;Masson三色染色液(货号:DC0032)购自北京雷根生物技术有限公司。全自动酶标仪(型号:MK3型)、二氧化碳培养箱(型号371型)和荧光定量PCR仪(型号:ABI7500型)购自Thermofishe公司;低速台式离心机(型号:TD5A-WS型)购自长沙湘仪离心机仪器有限公司;倒置荧光显微镜(型号:CKX31型)、正置显微镜(型号:BX50)购自日本Olympus公司。
1.2 方法
1.2.1 大鼠CIA模型的建立将16只SD大鼠随机平分为空白组、CIA模型组,每组8只。建立模型:取适量牛Ⅱ型胶原溶液与等体积的不完全弗氏佐剂(IFA)充分混合乳化,制得浓度为l mg/ml的牛Ⅱ型胶原乳剂;每只大鼠尾根部皮内注射0.2 ml。初次免疫7 d后,进行二次免疫,每只大鼠尾根部皮内注射0.1 ml。二次免疫后每48 h观察1次并记录大鼠四肢发病状况。空白组在相同部位皮内注射等量生理盐水。
1.2.2 动物取材及组织病理切片检测一免后第30天进行取材,右后肢放在组织固定液中固定72 h,用10%乙二胺四乙酸二钠(EDTA-2Na)脱钙液脱钙处理1个月,常规脱水,石蜡包埋并切片,将切片脱蜡至水,进行HE染色、Masson染色和TRAP染色。镜下观察大鼠关节炎症细胞浸润、滑膜增生、软骨和骨基质破坏及TRAP阳性细胞形成等情况,采集图像,进行分析。
1.2.3 关节组织中ROS生成的检测将切片常规脱蜡,经抗原修复、0.1%Triton X-100破膜、0.3%H2O2甲醇溶液抑制内源性过氧化物酶处理后,加入DHE-ROS荧光探针,最后DAPI染核3 min并进行封片,激光扫描共聚焦显微镜下观察拍照。
1.2.4 体外破骨细胞分化模型的建立小鼠脱颈法处死,置于75%酒精中消毒,无菌分离双侧后肢股骨与胫骨,于超净台内用PBS洗涤3次,再使骨髓腔充分暴露,用装有无血清α-MEM培养基的5 ml注射器反复吹洗骨髓腔至发白,吹散细胞团进行过滤,后将其吸入15 ml离心管,1 500 r/min离心5 min,弃上清;加入红细胞裂解液混匀,静置2 min,1 500 r/min离心5 min,弃上清;无菌PBS清洗1次,完全培养基重悬细胞进行计数,最后用含20 ng/ml M-CSF的 培 养 基 稀 释 细 胞2.5×105个/ml接 种 于24孔板中,每孔1 ml。培养72 h后Control组继续使用M-CSF诱导,而RANKL组和给药组在含M-CSF的基础上加入RANKL诱导,细胞隔天换液,诱导时间分别为48 h、96 h。
1.2.5 TRAP染色细胞诱导培养的同时给予NAC(给药剂量1、2.5、5 mmol/L)干预48 h、96 h后,将贴有细胞的玻片取出,PBS洗3次,4%多聚甲醛固定液室温固定10 min,去离子水洗3次;玻片浸入预热到37℃的TRAP染色液,避光温育1 h;去离子水洗3次;再用苏木素染色1 min,PBS洗3次;自然干燥,中性树胶封片;光镜下观察拍照,以TRAP阳性多核细胞(细胞核≥3)为破骨细胞。
1.2.6 鬼笔环肽染色细胞诱导培养的同时给予NAC(给药剂量1、2.5、5 mmol/L)干预48 h、96 h后,将贴有细胞的玻片取出,PBS洗3次,4%多聚甲醛固定液室温固定10 min,PBS洗3次,用0.1%Triton X-100细 胞 穿 孔15 min,5%BSA封 闭1 h,PBS洗3次;罗丹明-鬼笔环肽避光染色30 min,PBS洗3次;再用DAPI染色3 min,PBS洗3次,吸去多余水分,用抗荧光淬灭封片液封片后于激光扫描共聚焦显微镜下观察拍照。
1.2.7 RT-PCR检测细胞诱导培养48 h、96 h后,PBS漂洗3次,Trizol法提取细胞总mRNA,核酸定量仪检测RNA浓度。然后按照逆转录试剂盒说明书将RNA逆转录为cDNA,应用SYBR Premix Ex TaqⅡ试剂盒进行实时荧光定量PCR检测。PCR扩增程序:94℃预变性5 min;随后94℃15 s及60℃30 s,40个循环,按2-ΔΔCt计算TRAP、MMP-9、CTSK基因相对GAPDH的表达。
1.2.8 免疫荧光染色检测细胞诱导培养48 h、96 h后,将贴有细胞的玻片取出,PBS洗3次,4%多聚甲醛固定液室温固定10 min,PBS洗3次,用0.1% Triton X-100细胞穿孔15 min,PBS洗3次,加入相应浓度的一抗MMP-9、CTSK,4℃避光孵育过夜;次日PBS洗3次,加入二抗避光孵育1 h,PBS洗3次;罗丹明-鬼笔环肽避光染色30 min,PBS洗3次;再用DAPI染色3 min,PBS洗3次,吸去多余水分,用抗荧光淬灭封片液封片后于激光扫描共聚焦显微镜下观察拍照。
1.2.9 体外破骨细胞分化中ROS的检测细胞诱导培养48 h、96 h后,将贴有细胞的玻片取出,PBS洗3次,在37℃下加入荧光探针DCFH-DA避光孵育30 min,PBS洗3次后抗荧光淬灭封片液封片,于激光扫描共聚焦显微镜下拍照,每张玻片随机取10个位置视野,采用Image J进行荧光阳性细胞荧光强度统计,3个复孔取均值,结果以阳性细胞荧光强度/视野表示。
1.3 统计学处理Image J软件对采集图像进行统计处理,采用GraphPad Prism 8.0统计软件对所得数据进行统计分析,组间比较采用单因素方差分析(one-way ANOVA)。P<0.05为差异有统计学意义。
2 结果
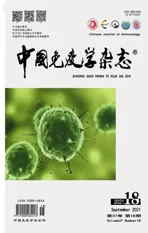
2.1 CIA模型大鼠炎症关节骨破坏情况如图1A所示,CIA大鼠关节红肿明显,病程后期红肿处甚至发生变形。此外,Masson、HE和TRAP染色结果显示,空白组(Control)大鼠关节结构良好,关节软骨表面光滑平整,软骨和软骨下骨边界清晰,TRAP阳性染色较浅;而CIA大鼠的Masson染色可见关节腔内侵入大量纤维化组织,潮线附近有大量火焰状突起的红染,软骨和软骨下骨边界不清晰;HE染色可见明显的炎症细胞浸润,滑膜细胞异常增生,软骨和骨小梁大面积被侵袭;TRAP染色可见软骨和骨小梁交界处TRAP阳性染色明显,破骨细胞数目明显增多,结果如图1B~D。
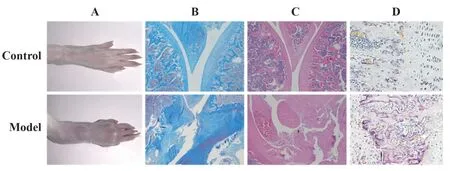
图1 CIA模型大鼠炎症关节骨破坏情况Fig.1 Situation about bone destruction of inflammatory joints in CIA model rats
2.2 CIA大鼠关节组织中ROS的表达结果如图2所示,ROS荧光染色后细胞核呈现蓝染,胞中ROS呈现红染。空白组关节组织ROS荧光强度比较弱,CIA造模后,关节骨破坏处表现强ROS阳性染色,即ROS在CIA大鼠关节中大量表达。
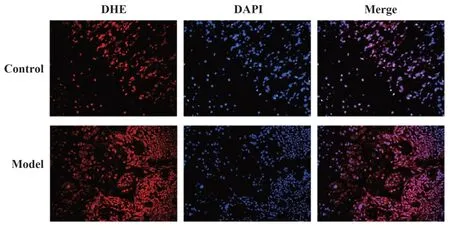
图2 DHE荧光探针检测大鼠关节组织ROS的表达(×400)Fig.2 Detection of ROS expression in rat joint by DHE fluorescence probe(×400)
2.3 RANKL诱导48 h和96 h后BMMs向破骨细胞分化情况与单独M-CSF诱导组相比RANKL诱导组均可见TRAP阳性细胞,其中以96 h组诱导的破骨细胞分化最成熟,细胞体积最大、胞内细胞核多,TRAP阳性细胞数量也多;48 h组诱导的次之,结果见图3A。此外,对各组细胞进行鬼笔环肽染色,M-CSF组未见伪足生成,其余两组均可见明显的伪足和褶皱区,其中以96 h组形成的肌动蛋白环最明显,且可见细胞内的大量细胞核,结果见图3B。
图3 RANKL体外诱导BMMs向破骨细胞分化形成情况(×200)Fig.3 Induce BMMs into osteoclasts with RANKL in vitro(×200)
2.4 RANKL诱导48 h和96 h后溶骨相关基因的表达情况如图4A所示,与M-CSF组相比,48 h、96 h组的TRAP、MMP-9、CTSK mRNA表达均显著升高,且随着RANKL诱导时间持续增强,组间差异具有统计学意义(P<0.01)。免疫荧光检测结果也表明MMP-9、CTSK蛋白在破骨细胞中大量表达,见图4B。
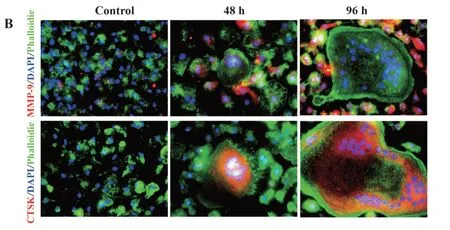
图4 体外破骨细胞分化中溶骨相关活性基因的表达情况Fig.4 Expression of osteoclast specific genes in osteoclast differentiation in vitro
2.5 RANKL诱导48 h和96 h后破骨细胞分化体系中ROS的变化利用DCFH-DA荧光染色检测细胞内原位ROS的表达,如图5所示。ROS多聚积于肌动蛋白环处,RANKL诱导48 h、96 h后细胞内ROS荧光密度值显著高于M-CSF组,且呈时间依赖性持续增强,说明在破骨细胞体外分化过程中ROS表达水平呈逐渐递增趋势。
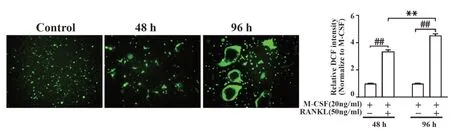
图5 破骨细胞分化中ROS的变化(×200)Fig.5 Detection of ROS expression in osteoclasts(×200)
2.6 ROS抑制剂NAC对体外RANKL诱导破骨细胞分化的影响在RANKL诱导破骨细胞分化的同时,给予不同浓度的NAC干预96 h,结果显示RANKL组出现大量TRAP阳性多核细胞(核≥3个),鬼笔环肽染色后RANKL组可见明显肌动蛋白环形成,且观察到细胞内的大量细胞核。而给予NAC干预后明显抑制了破骨细胞的形成,且中高剂量组未见典型的TRAP阳性细胞形成,与RANKL组比较差异有统计学意义(P<0.01),见图6。说明ROS介导破骨细胞的分化,抑制ROS产生可明显抑制破骨细胞分化。
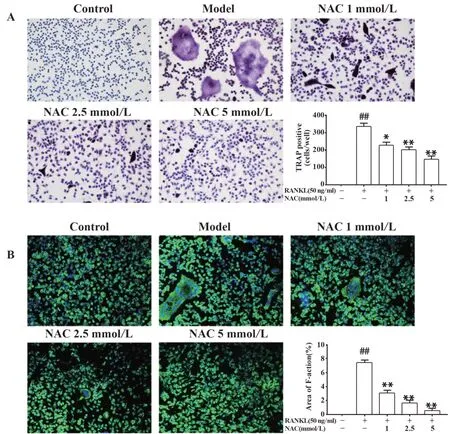
图6 TRAP和免疫荧光染色法观察体外破骨细胞分化情况Fig.6 Osteoclast differentiation in vitro was observed by TRAP and immunofluorescence staining
3 讨论
RA是一种以关节骨破坏为典型病理特征的慢性、炎症性、免疫系统性疾病,而破骨细胞的增殖、活化被认为是导致RA骨损伤和骨代谢紊乱的关键因素[10-11]。最近研究表明在RA的发病和治疗过程中,骨破坏与氧化应激之间存在密切的相关性,其中作为氧化损伤重要产物的ROS可能是促进破骨细胞分化的重要物质[12]。ROS泛指氧来源的自由基和非自由基,包含了超氧阴离子(O2-)、过氧化氢(H2O2)、羟自由基(OH-)、臭氧(O3)和单线态氧(1O2)等,由于它们含有不成对的电子,因而具有很高的化学反应活性[13]。正常情况下,生理水平的ROS能调控细胞内环境稳态、信号转导、增殖分化、凋亡等生理活动,而高水平的ROS则破坏氧化还原平衡,可致氧化损伤、功能障碍、疾病甚至细胞死亡[14-15]。也有大量研究表明各种急、慢性炎症疾病的病理过程都和过量的ROS刺激息息相关[16-19]。为进一步探索ROS与RA骨破坏的相关性,本实验首先通过建立CIA大鼠模型,制作病理切片,采用DHE荧光探针检测关节组织中ROS的表达水平,发现骨破坏严重的炎症关节中的ROS表达显著上调,这提示ROS可能参与破骨细胞的分化形成过程。Nrf2是细胞抗氧化应激反应的关键因子,与野生型小鼠相比Nrf2敲除小鼠显示骨组织中破骨细胞数显著增加,ROS等氧化产物表达增加,抗氧化酶水平降低[20],这间接反映了ROS参与破骨细胞的形成。为了进一步验证这一发现,采用RANKL诱导BMMs向破骨细胞分化建立体外破骨细胞分化模型,免疫荧光染色检测其分化不同阶段(即48 h和96 h)中ROS的变化水平,结果发现ROS在这两个阶段中的生成呈趋势性显著升高,组间差异显著,这和动物实验结果相符合。TRAP主要反映了破骨细胞的活性及骨吸收能力,是破骨细胞的典型标志物;CTSK是一种降解Ⅰ型胶原蛋白的半胱氨酸蛋白酶,参与骨基质溶解,与骨量的调节密切相关;MMP-9主要功能是降解或重建细胞外基质,参与骨质和矿物质的降解,是主要的骨溶解性蛋白酶之一。本实验通过RTPCR法检测破骨细胞分化中溶骨相关标志性基因TRAP、MMP-9和CTSK,发现随着ROS的表达增加,TRAP、MMP-9和CTSK的表达也是逐步增加,两者的变化趋势高度吻合,ROS可能贯穿破骨细胞分化的始终。此外,文献调研发现ROS的清除剂诸如脂联素、番茄红素等能明显抑制ROS等氧化产物的表达来影响破骨细胞骨吸收能力[21-22]。本实验在RANKL诱导破骨细胞分化的同时,加入ROS经典抑制剂NAC干预后,发现NAC以剂量依赖性抑制破骨细胞的形成和分化。因此,ROS可能是诱导破骨细胞分化引发骨破坏的潜在“催化剂”。
综上所述,氧化应激产生的活性氧ROS在破骨细胞形成和分化过程中起到了不可替代的作用,通过抑制ROS从而抑制破骨细胞的形成和活化为抗RA药物研发提供了一个崭新的方向。本研究结果有助于将抗氧化应激药物应用于RA骨破坏的治疗,为扩大抗氧化药物的适应症提供实验依据。