三氧化硫酸雾气溶胶低温脱除实验研究
2021-09-24米晨锋马素霞
米晨锋, 马素霞
(太原理工大学 电气与动力工程学院, 太原 030024)
目前,燃煤电厂排放的SO2和NOx已有严格的国家标准,但SO3排放却缺少相应的控制标准[1],燃煤机组加装选择性催化还原(SCR)脱硝装置后,一部分SO2被氧化成SO3,连同燃煤本身产生的SO3随着烟气进入湿法脱硫塔内,并与H2O以均相成核或异向成核的方式形成酸雾气溶胶[2-4]。生成的SO3酸雾气溶胶粒径为亚微米级,跟随性好,难以捕捉,增加了空气预热器腐蚀和堵塞风险。同时,这种酸雾气溶胶排入大气时,因温度骤降而凝结为酸雾液滴,经阳光折射和散射作用呈现白色、灰色或蓝色,被称为烟羽。燃煤电厂的烟羽是引起雾霾的元凶之一,会造成视觉污染,给人们的身心健康带来危害[5]。
目前,针对SO3酸雾气溶胶的脱除主要有2种技术路线:第一种是协同控制技术,主要采用的方法有低低温电除尘、湿式电除尘[6]以及湿法脱硫除尘技术;另一种是碱性脱除剂喷射技术,其原理是在烟道的合适位置(如炉内、电除尘器之前、空气预热器之前和SCR脱硝装置之前)喷射碱性脱除剂与酸雾气溶胶发生化学反应来脱除SO3[7],常用的碱性脱除剂有Mg(OH)2、Ca(OH)2和NaHSO3等,反应温度均在300 ℃左右。目前国内外鲜有关于低温下酸雾气溶胶脱除方面的研究,吴昊[8]通过水汽相变凝结的方法增大SO3酸雾气溶胶的粒径,从而对酸雾气溶胶进行物理脱除,揭示了SO3酸雾气溶胶在热泳力、扩散泳力和布朗运动下的运动规律和长大特性。常景彩[9]通过SO3与空气中的水蒸气结合形成酸雾气溶胶的方法进行低温脱除实验,但因制备方法粗糙,酸雾气溶胶粒径较大,与脱硫塔后粒径有较大差距。笔者旨在通过实验研究,探寻40~60 ℃(湿法脱硫塔出口温度)低温环境下不同温度、摩尔比、碱性脱除剂种类、碱性脱除剂入射角度和雾化气体积流量等对酸雾气溶胶脱除特性的影响。
1 实验系统与方法
1.1 实验系统
实验系统原理图如图1所示,系统由SO3发生装置、酸雾气溶胶生成装置和脱除装置以及硫酸根检测装置4部分组成。
本实验用N2、O2、SO2来模拟烟气的配置,其中N2为平衡气,与SO2和O2一起流经管式炉,经过V2O5的高温(480 ℃)催化,生成SO3气体,SO3的沸点较高,所以SO3气体全程由200 ℃的加热带进行保温然后通入酸雾气溶胶生成装置。生成装置的另外两路分别是水蒸气和空气,水蒸气由特制的水蒸气发生器提供,通过蠕动泵控制流量,产生的水蒸气与SO3气体在酸雾气溶胶生成装置中形成酸雾气溶胶,全程保温130 ℃;空气由空气压缩机加压,并被加热至50~70 ℃后通入酸雾气溶胶生成装置,从而控制其整体温度。

1-N2气瓶; 2-SO2气瓶; 3-O2气瓶; 4-阀门; 5-质量流量计; 6-预混罐; 7-温度控制器; 8-管式炉; 9-V2O5催化剂; 10-空气压缩机; 11-水蒸气发生器; 12-加热带; 13-酸雾气溶胶生成装置; 14-雾化喷头; 15-碱性脱除剂溶液; 16-蠕动泵; 17-控温装置; 18-采样枪; 19-蛇形冷凝管; 20-吸收瓶; 21-吸水瓶; 22-抽气泵; 23-后处理装置。
酸雾气溶胶发生装置入口处从上到下的气体分别为SO3、空气和水蒸气。由于空气体积流量(120 L/min)占酸雾气溶胶发生装置总气量的主要部分,在水蒸气发生器的前段,空气将SO3与水蒸气分隔开,避免了SO3与水蒸气在入口处直接混合,在水蒸气发生器的后段,SO3与水蒸气分散均匀,混合后的酸雾气溶胶粒径更接近湿法脱硫塔后酸雾气溶胶的粒径。
酸雾气溶胶脱除装置由长1 m的水平主烟道和双流体雾化喷头组成,主烟道通过加热带控制实验温度,在入口处设有一个雾化喷头,碱性脱除剂(如Na2CO3、NaHCO3和NaOH)通过雾化喷头形成喷雾液滴,以不同的入射角度喷入直管段中,与主流的酸雾气溶胶进行混合,发生化学反应,从而实现对酸雾气溶胶的脱除。
酸雾气溶胶浓度测量方法——控制冷凝法是国内外技术相对成熟,且有标准(GB/T 21508-2008 《燃煤烟气脱硫设备性能测试方法》)遵循的SO3取样方法,通过高温采样枪进行取样,经石英过滤器过滤杂质,再进入蛇形冷凝管,控制水浴温度在酸露点及水露点温度以下,使酸雾气溶胶冷凝成酸雾液滴并被蛇形冷凝管收集。利用分光光度计测量与氯化钡反应之后的样液浑浊度来测量硫酸根浓度,进而换算出SO3的质量浓度[10]。
1.2 实验计算
1.2.1 脱除效率
碱性脱除剂对SO3的脱除效率η为:
(1)
式中:ρSO3,in、ρSO3,out分别为脱除装置入口和出口烟气中SO3的质量浓度,mg/m3。
1.2.2 主要化学反应
实验中主要化学反应如下:
Na2CO3+H2SO4=Na2SO4+H2O+CO2
(2)
2NaOH+H2SO4=Na2SO4+2H2O
(3)
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2
(4)
本实验中的反应为酸碱中和反应,碱性脱除剂溶液经雾化喷头形成小液滴后,在脱除装置中与酸雾气溶胶进行化学反应。
以反应式(2)为例,摩尔比=n(Na2CO3)∶n(H2SO4),其中n为物质的量。
2 实验结果与分析
2.1 温度对脱除效率的影响
温度对于任何化学反应都是重要的影响因素,温度越高,化学反应所需的活化能越低,反应越容易发生。图2给出了温度对脱除效率的影响,其中碱性脱除剂为Na2CO3,SO3初始质量浓度为75 mg/m3。以摩尔比为2时为例,当温度低于52 ℃时,脱除效率与温度基本呈正相关,当温度从40 ℃提高至52 ℃时,脱除效率提高21%;温度为54~60 ℃时,脱除效率为64.5%左右,提升温度对脱除效率基本无影响。根据Arrhenius定律,化学反应速率是影响反应的主要因素,当温度低于临界温度(52 ℃)时,温度升高导致反应物能量增大,活化分子数增多,化学反应速率加快,脱除效率升高。但继续提高温度时,化学反应速率对脱除效率的控制已达极限,此时化学反应速率不再是影响脱除效率的主要因素,喷雾液滴与碱性脱除剂的碰撞概率和脱除装置中模拟烟气的停留时间成为主要控制因素。

图2 温度对脱除效率的影响Fig.2 Effect of temperature on removal efficiency
同理,当摩尔比为3和4时,最大脱除效率对应的温度分别为55 ℃和58 ℃,脱除效率的变化规律与摩尔比为2时脱除效率的变化规律基本一致。
2.2 摩尔比对脱除效率的影响
图3给出了摩尔比对脱除效率的影响,其中碱性脱除剂为Na2CO3,温度为55 ℃。由图3可知,当SO3初始质量浓度(即脱除装置入口烟气中SO3的质量浓度)为75 mg/m3,摩尔比为1、2、3和4时,脱除效率分别为55%、64%、69%和70%。随着摩尔比的增大,脱除效率整体呈现递增趋势,但增长率却在下降。当摩尔比从1增大到2时,脱除效率提高了16%,当摩尔比继续增大到3时,脱除效率增长率只有7%,当摩尔比从3增大到4时,脱除效率基本持平。这说明低摩尔比时,增大摩尔比可以提高碱性脱除剂浓度,进而提高脱除效率,但是当摩尔比增大到一定程度时,单位体积内的碱性脱除剂摩尔数对于喷雾液滴已经饱和,增大摩尔比,脱除效率不再提高,反而会造成碱性脱除剂的浪费。此时喷雾液滴与酸雾气溶胶的碰撞概率成为制约脱除效率的主要因素,脱除效率可能与2种反应物的混合方式有关,或与喷雾液滴的物理性质有关。

图3 摩尔比对脱除效率的影响Fig.3 Effect of molar ratio on removal efficiency
在摩尔比为1时,高SO3初始质量浓度(150 mg/m3)比低SO3初始质量浓度(75 mg/m3)的脱除效率高18%,其原因是SO3初始质量浓度提高,单位体积内的酸雾气溶胶也随之增多,进而提高了碱性脱除剂与酸雾气溶胶的碰撞概率,所以脱除效率较高。随着摩尔比的增大,酸雾气溶胶与碱性脱除剂的碰撞概率不再受摩尔比的影响,不同SO3初始质量浓度的脱除效率也接近一致。
2.3 碱性脱除剂种类对脱除效率的影响
图4给出了碱性脱除剂种类对脱除效率的影响,其中碱性脱除剂为Na2CO3、NaOH和NaH-CO3。由图4可知,NaHCO3的脱除效率略高于其他2种碱性脱除剂,但差距不大。
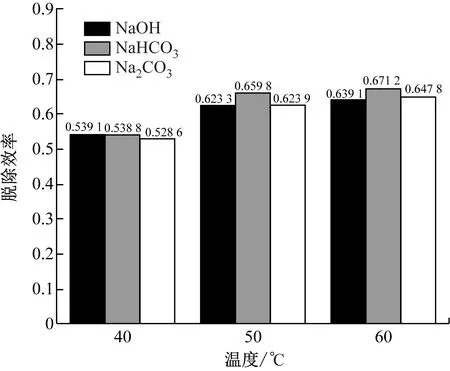
图4 碱性脱除剂种类对脱除效率的影响Fig.4 Effect of types of alkaline sorbents on removal efficiency
2.4 入射角度对脱除效率的影响
通过改变碱性脱除剂的入射角度,使其与主流空气的夹角分别呈45°、70°、90°、110°和135°,通过考察不同入射角度对喷雾液滴在脱除装置中扩散程度的影响,进而分析入射角度对脱除效率的影响(见图5,其中碱性脱除剂为Na2CO3,摩尔比为2,温度为55 ℃)。

图5 入射角度对脱除效率的影响Fig.5 Effect of incident angle on removal efficiency
由图5可知,当入射角度为90°时,即碱性脱除剂入射方向垂直于主流方向,脱除效率为64.5%,在所有入射角度中90°时的脱除效率最低。入射角度为135°时,脱除效率为72.81%(比90°入射角度时的脱除效率提高13%),高于入射角度为45°时的脱除效率(67.91%)。这是因为当碱性脱除剂喷雾液滴进入主流管段后,喷雾液滴在主流方向上的受力各不相同。其中,135°入射角度时喷雾液滴进入管段后沿主流方向的分速度与主流速度相反,由于气液间的相互耦合作用导致的动量传递,喷雾液滴沿主流截面竖直方向的速度变化最为剧烈,相较于其他入射角度,喷雾液滴受到的扰动最强,扩散体积最大,故脱除效率最高。90°入射角度时喷雾液滴进入主流管段后,无主流方向的分速度,受到的上下扰动最小,故脱除效率最低。
2.5 雾化气体积流量对脱除效率的影响
图6给出了雾化气体积流量对脱除效率的影响,其中碱性脱除剂为Na2CO3,摩尔比为2,温度为55 ℃。由于采用的是双流体雾化喷嘴,雾化气体积流量对于喷嘴产生的碱性脱除剂粒径大小起决定性作用,这会影响碱性脱除剂与酸雾气溶胶的接触面积和碰撞概率,从而影响脱除效率。

图6 雾化气体积流量对脱除效率的影响Fig.6 Effect of volume flow rate of atomized gas onremoval efficiency
由图6可知,当雾化气体积流量从7.5 L/min增加到12.5 L/min时,脱除效率升高了10%,雾化气体积流量为12.5 L/min时基本达到最大脱除效率,其原因是雾化气体积流量增加,破碎效果增强,雾化喷头产生的喷雾液滴粒径减小,小粒径喷雾液滴的总表面积较大,与酸雾气溶胶的反应面积变大,总反应速率增大,故脱除效率呈上升趋势。但当雾化气体积流量继续增加时,制约化学反应的主要因素不再是反应面积,所以脱除效率上升并不明显,基本保持不变。
3 结 论
(1) 温度对脱除效率的影响至关重要,本文中酸雾气溶胶最佳脱除温度为54~58 ℃。
(2) 增大碱性脱除剂与H2SO4的摩尔比会提升脱除效率,摩尔比为3时基本达到最大脱除效率。
(3) Na2CO3、NaOH和NaHCO3对酸雾气溶胶的脱除效果基本一致,其中NaHCO3的脱除效果略好于其他2种碱性脱除剂。
(4) 碱性脱除剂入射角度为135°时,喷雾液滴充满整个空间的体积分数最大,脱除效果最好。
(5) 增加雾化气体积流量会使喷雾液滴粒径减小,提升脱除效率,雾化气体积流量为12.5 L/min时基本达到最大脱除效率。
