鞣花酸对缺血性脑卒中大鼠的保护作用
2021-09-24陈敏纯张婧一张雨晨闫抗抗刘生元
陈敏纯, 张婧一, 张雨晨, 叶 丹, 闫抗抗, 刘生元
(西北大学附属医院/西安市第三医院药剂科,陕西 西安 710018)
缺血性脑卒中严重危害人类健康,其致病率、死亡率在全球居首位[1]。由于其病理机制复杂,迄今尚无理想的治疗药物和措施。寻找安全、疗效显著、作用机制确切的脑卒中防治药物成为治疗该疾病的迫切需求。目前,以抗氧化应激为靶点治疗缺血性脑卒中的药物研究日趋成为医药领域研究热点。近年来的研究发现,PGC-1α/Nrf2是抗脑缺血损伤和神经退行性疾病的重要生存通路,PGC-1α/Nrf2通路参与调控氧化应激功能累及的多种因子、多个环节的复杂反应从而挽救神经元损伤[2-3]。鞣花酸是一种多酚物质,广泛存在于石榴、赤芍、柯子等食药中,具有抗炎、抗氧化应激、抗凋亡作用[4-5],课题组前期研究证实它具有抗动脉粥样硬化血管保护作用[6],但能否调控PGC-1α/Nrf2信号通路,抑制氧化应激,从而发挥脑保护作用尚不清楚。本研究以大鼠中动脉栓塞为缺血性脑卒中模型(MCAO),考察鞣花酸对缺血性脑卒中抗氧化应激的保护作用,并探讨其调控机制,为将其开发成新型安全防治缺血性脑卒中药物提供理论依据,同时揭示相关作用机制。
1 材料
1.1 仪器、药物与试剂 脱水机、组织摊烤片机(武汉俊杰电子有限公司,JT-12J、JK-6);病理切片机(德国Leica公司,RM2016);显微镜(日本奥林巴斯公司,BX53型);离心机(湖南湘仪实验室仪器开发有限公司,HI650);全自动酶标仪(美国Thermo scientific公司,Multiskan MK3);蛋白免疫印迹系统(美国Bio-Rad公司)。鞣花酸(美国Sigma-Aldrich公司)。TUNEL细胞凋亡检测试剂盒(美国Roche Applied Science公司);抗荧光淬灭封片剂(美国Southernbiotech公司);DAPI(上海碧云天生物技术有限公司);CD34(英国Abcam公司);总超氧化物歧化酶(T-SOD)测试盒、丙二醛(MDA)测试试剂盒(南京建成生物工程研究所);PGC-1α抗体(武汉三鹰生物技术有限公司);Nrf2抗体(美国Affinity公司)。
1.2 动物 SPF级SD大鼠,雄性,体质量180~220 g,8~10周龄,购自空军军医大学实验动物中心,实验动物生产许可证号SCXK-(陕)-2014-002。大鼠自由取食和饮水,适应性饲养1周后进行实验。
2 方法
2.1 分组、造模与给药 大鼠适应性饲养7 d后开始实验,40只大鼠随机分为5组,即正常组、模型组、鞣花酸低剂量组(50 mg/kg)、鞣花酸中剂量组(100 mg/kg)、鞣花酸高剂量组(150 mg/kg),每组8只。正常组不插入线栓,其余操作同模型组,缺血性脑卒中模型制作参考Qiang等[7]报道,分离大鼠颈总动脉和颈内外动脉,将线栓插入颈内动脉约18 mm处,阻塞颅内中动脉,缺血2 h后取出线栓。应用Garcia评分,按照每项反应程度对清醒后大鼠进行1、2、3分评定,选取1~2分者作为模型。大鼠造模成功后,鞣花酸溶于生理盐水中每天灌胃给药1次,连续7 d,正常组和模型组给予生理盐水灌胃。
2.2 神经功能评分 给药结束后,大鼠进行Garcia评分,根据自主运动情况、提起鼠尾悬空时四肢活动的对称情况、前爪伸展情况、攀爬和抓持铁网的能力、身体感觉反应、触碰胡须的反应,按照程度进行1、2、3分评定。
2.3 脑梗死体积检测 神经功能评分后,麻醉大鼠,断头取脑,沿冠状面进行切片(厚度约2 mm),浸泡于TTC中,孵育30 min后多聚甲醛固定2 h,计算脑梗死面积。
2.4 脑组织病理学观察 大鼠脑组织块进行脱水、透明、石蜡包埋及切片处理,采用苏木素染色5 min,1%水溶性伊红染液染色2 min,发现细胞核呈蓝色,细胞浆、肌纤维、胶原纤维和红细胞呈不同程度的红色,照相倍数为200倍。

2.6 在体细胞凋亡检测 大鼠脑组织块进行脱水、透明、石蜡包埋、切片处理后,滴加蛋白酶K工作液反应30 min,PBS洗涤3次后加入50 μL TUNEL反应混合液,37 ℃避光孵育60 min,再滴加DAPI避光孵育5 min,对标本进行染核。荧光显微镜下观察组织切片上凋亡的细胞呈红色荧光,蓝色为细胞核,照相倍数为400倍。
2.7 脑组织中PGC-1α、Nrf2蛋白表达检测 提取脑组织蛋白并进行蛋白浓度定量,配制电泳胶,用微量加样器将制备好的蛋白样品和MAKER加入上样孔,各样品总蛋白量为40 μg,进行电泳分离,切下目的条带进行转膜。将PVDF膜浸泡于一抗孵育液中,4 ℃孵育过夜,再将PVDF膜浸泡于二抗孵育液中,37 ℃摇床孵育2 h,显色曝光,用BandScan分析胶片灰度值。

3 结果
3.1 神经功能评分 正常组大鼠神经功能正常,模型组神经功能影响最严重,与模型组比较,鞣花酸组神经功能改善(P<0.05),高剂量给药组神经功能优于低、中剂量给药组。如表1所示。
3.2 脑梗死体积 正常组大鼠脑组织无梗死体积,模型组大脑梗死体积最大,高达(42.28±2.79)%,与正常组比较差异具有统计学意义(P<0.05);而鞣花酸给药组脑梗死灶缩小,与模型组比较差异有统计学意义(P<0.05),以高剂量组最小,说明鞣花酸对缺血性脑卒中大鼠具有神经保护作用,改善脑神经功能,缩小脑梗死灶。如表1所示。
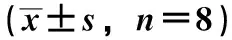
表1 大鼠神经功能评分及脑梗死体积
3.3 脑组织病理学变化 正常组神经元细胞形态基本正常,组织致密,细胞排列整齐,胞核位于细胞中央;模型组脑组织疏松,肿胀明显,细胞数量减少,排列紊乱,神经元胞核固缩,颜色深染;鞣花酸高剂量组病理学变化较模型组改善。如图1所示。

图1 大鼠脑组织HE染色(×200,n=8)Fig.1 Brain tissues of rats by HE staining (×200,n=8)
3.4 氧化应激水平 如图2所示,与正常组比较,模型组MDA水平增高(16.28±1.31)nmol/mL(P<0.05);而给予鞣花酸药物处理后,与模型组比较,MDA水平降低(P<0.05),高剂量组效果最优[(12.79±2.31)nmol/mL],表明鞣花酸具有降低脂质过氧化作用。与模型组比较,鞣花酸组增加SOD活性(P<0.05),高剂量组效果最优[(113.565 ±19.23 U/mL)],说明鞣花酸有抗氧化作用。

注:与模型组比较,*P<0.05;与正常组比较,#P<0.05。图2 大鼠脑组织氧化应激水平(n=8)Fig.2 Levels of oxidative stress in brain tissues of rats(n=8)
3.5 在体细胞凋亡 如图3~4所示,正常组无细胞凋亡;模型组凋亡指数最高[(45.23±2.12)%],凋亡细胞密集分布;给药组TUNEL阳性凋亡表达降低(P<0.05),高剂量组下降至25.31%。

图3 鞣花酸对MCAO模型大鼠TUNEL阳性细胞数的影响(×400,n=8)Fig.3 Effect of ellagic acid on the number of TUNEL positive cells of MCAO rat models(×400,n=8)

注:与模型组比较,*P<0.05;与正常组比较,#P<0.05。图4 鞣花酸对MCAO模型大鼠抗细胞凋亡的影响(n=8)Fig.4 Effects of ellagic acid on the number of TUNEL positive cells of MCAO rat models(n=8)
3.6 脑组织PGC-1α、Nrf2蛋白表达 如图5所示,与正常组比较,模型组PGC-1α、Nrf2蛋白表达增加(P<0.05),而给药组PGC-1α、Nrf2高于模型组(P<0.05)。

注:与模型组比较,*P<0.05;与正常组比较,#P<0.05。图5 鞣花酸对MCAO模型大鼠PGC-1α、Nrf2蛋白表达影响(n=8)Fig.5 Effects of ellagic acid on the expressions of PGC-1α and Nrf2 proteins in MCAO rat models(n=8)
4 讨论
中医药在治疗缺血性疾病方面显示出了独特的优势,临床疗效确切[8],认为瘀血阻滞、热毒壅盛是缺血性脑卒中的主要病机,故以行气营血、清热解毒为主要治法[9]。赤芍性微寒,味苦,有破血行气、清热解毒、引血下行的功效。课题组前期从赤芍中分离鉴定出一种有效成分鞣花酸具有抗动脉粥样硬化血管保护作用,本研究显示鞣花酸对缺血性脑卒中大鼠有保护作用,可显著改善MCAO模型大鼠的缺血梗死灶,恢复神经功能,缓解缺血灶组织病理学变化。
脑缺血损伤机制众多,至今尚未完全清楚,以往研究发现,氧化应激损伤在神经细胞凋亡中发挥重要作用。脑缺血缺氧后,细胞内产生大量的活性氧(ROS),爆发的ROS激活了线粒体凋亡通路,同时使线粒体DNA致突变,转录有缺陷的电子传递链组分,导致ROS瀑布式的增长,加重细胞凋亡。MDA反映的是ROS与不饱和脂肪酸发生过氧化反应的程度,其有细胞毒性作用,本研究显示鞣花酸降低MDA水平。SOD是体内清除ROS重要的抗过氧化物酶,缓解细胞氧化应激损伤,减少神经细胞凋亡,鞣花酸增加SOD活性。TUNEL结果也显示鞣花酸降低在体细胞凋亡,且抗凋亡作用呈剂量依赖,表明鞣花酸可调节机体抗氧化应激损伤作用。
以往研究证明脑缺血损伤可增加脑组织的PGC-1α表达,若PGC-1α被抑制则加重脑损伤,表明PGC-1α具有神经保护作用[10]。PGC-1α靶向激活雌激素受体相关受体(ERR)家族蛋白,ERRα促Nrf2高表达,激活下游一系列信号转录,修复受损神经元细胞[11]。PGC-1α是线粒体生物合成的重要调控因子,也是线粒体保护的重要靶蛋白。神经元细胞中PGC-1α高表达可增加神经元细胞树突棘的数量并促进突触分化[12]。在氧化应激条件下,刺激血管内皮细胞PGC-1α表达能减少线粒体内ROS积累,稳定线粒体膜电位,减少细胞凋亡[13]。Han等[14]研究发现PGC-1α促进了线粒体抗氧化剂(SOD、Prx3、GPx1)和解偶联蛋白(UCP2、UCP4和UCP5)的表达,进而降低ROS的产生。Nrf2是结合抗氧化反应元件(ARE)的主要转录因子,激活下游信号因子ARE,启动抗氧化基因表达,激活许多维持氧化还原稳态的关键基因,如GSH-Px和SOD抗氧化系统的相关基因[15]。这些信号因子参与调控ROS代谢,蛋白酶体功能等。当Nrf2耗竭完,或表达异常下降,致AER介导抗氧化酶基因表达失败[16]。PGC-1α/Nrf2信号通路是双向环路相互作用,ROS解毒系统可诱导PGC-1α高表达。本实验显示,与模型组比较,鞣花酸给药组增加脑组织PGC-1α、Nrf2表达,提示它可能为PGC-1α激活剂,其抗氧化应激作用通过调控PGC-1α/Nrf2信号通路表达发挥。
综上所述,鞣花酸通过激活PGC-1α/Nrf2信号通路,调控氧化应激,修复受损神经元细胞,发挥抗缺血性脑卒中作用。
