移植BMSC来源的Leydig样细胞对DEHP损伤小鼠睾丸功能的修复作用及其机制
2021-09-24康永明方琨宋攀杨璐辰刘正欢王临春史率克董强
康永明,方琨,宋攀,杨璐辰,刘正欢,王临春,史率克,董强*
1四川大学华西医院泌尿外科,成都 610041;2四川遂宁市中心医院泌尿外科,四川遂宁 627000
邻苯二甲酸二(2-乙基己基)酯[di(2-ethylhexyl)phthalate,DEHP]是塑料制品生产中常用的增塑剂[1],广泛存在于人类接触物中,如包装袋、医疗器械及装修材料等[2-3]。DEHP经接触、摄入或吸入等途径进入体内,对人类和动物的激素合成、分泌及代谢产生影响[4-5]。睾酮是一种主要由睾丸产生的类固醇激素,由睾丸间质细胞(Leydig细胞)合成并分泌[6]。DEHP可损伤雄性生殖系统的主要靶器官睾丸[7],使睾酮分泌降低。研究发现,DEHP可诱导肝细胞[8]、卵巢颗粒细胞[9]及精母细胞[10]等发生凋亡。此外,有研究发现,DEHP可诱导睾丸组织发生氧化应激,当活性氧簇(reactive oxygen species,ROS)基团产生蓄积时,细胞器受到破坏后功能受损,可影响溶酶体活性,最终导致细胞死亡[11]。目前,雄激素低下的治疗常采用外源性睾酮补充、干细胞移植及Leydig细胞移植等方法[12-14],可促进受损睾丸功能的恢复[15],但存在不符合睾酮生理节律需求、种子细胞来源不足、排异反应及伦理等相关问题。本课题组对DEHP损伤Leydig细胞功能的机制进行了探索[16],并在体外实验中成功诱导骨髓间充质干细胞(BMSCs)向Leydig样细胞分化[17-18]。此类细胞具有表面突起、胞质丰富、核仁清晰的特征,且具备分泌睾酮的功能。本研究旨在通过移植BMSCs来源的Leydig样细胞,探讨其对DHEP受损睾丸功能的修复作用及相关机制,以期为细胞移植治疗雄激素低下提供新的选择并奠定理论基础。
1 材料与方法
1.1 实验动物 33只4周龄清洁级健康雄性C57小鼠(合格证号:202008224),体重10~20 g,平均15 g,购自成都达硕实验动物有限公司,饲养于四川大学华西科技园动物实验中心。实验过程符合国家及单位有关动物管理和使用的规定。
1.2 DEHP损伤C57小鼠模型建立及指标检测 将6只青春期C57小鼠适应环境1周,随机分为DEHP组与对照组,按10 ml/(kg.d)计算玉米油灌胃量,DEHP组选用DEHP[900 mg/(kg.d)试剂溶解于玉米油中]灌胃[16],对照组则以等量玉米油灌胃,共4周。灌胃结束后获取小鼠眶静脉血行血清睾酮检测;获取双侧睾丸,行HE及TUNEL染色以了解睾丸组织病理变化;ELISA检测睾丸组织中丙二醛(MDA)、谷胱甘肽(GSH)含量及超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性;Western blotting检测睾丸组织中caspase-3、caspase-8、caspase-9、Bax及Bcl-2蛋白表达情况。
1.3 C57染毒小鼠分组及细胞移植 将27只4周龄C57小鼠给予DEHP[900 mg/(kg.d)]喂养4周。使用Percoll液分离法及全骨髓贴壁法提取并纯化小鼠BMSCs,对提取的BMSCs进行鉴定后,体外诱导BMSCs分化为Leydig样细胞并鉴定其功能。随机将DEHP染毒小鼠分为Leydig样细胞移植组(注射BMSC来源的Leydig样细胞悬液)、BMSC移植组(注射第3代BMSCs细胞悬液)及对照组(注射等量生理盐水),每组9只。调整Leydig样细胞及BMSCs的密度为1×106/ml;麻醉下阴囊皮肤消毒,使用微量注射器吸取细胞悬液,每侧睾丸直接注射细胞悬液0.2 ml。细胞移植完成后常规饲养。
1.4 移植后睾酮、凋亡蛋白及氧化应激指标检测
在移植后7、14、21 d获取小鼠眶静脉血进行血清睾酮测定。获取双侧睾丸,行ELISA检测MDA、GSH含量及SOD、GSH-Px活性。获取移植后7 d的睾丸行HE、TUNEL染色观察小鼠睾丸生精小管及细胞凋亡情况,睾丸匀浆后采用Western blotting检测caspase-3、caspase-8、caspase-9、Bax及Bcl-2蛋白的表达情况。
1.5 统计学处理 采用SPSS 24.0软件进行统计分析。计量资料以±s表示,血清睾酮、凋亡蛋白、氧化应激指标符合正态分布,DEHP组与对照组间比较采用t检验。细胞移植后Leydig样细胞移植组、BMSC移植组及对照组的凋亡蛋白、氧化应激指标符合正态分布,组间比较采用方差分析,进一步两两比较时采用LSD-t检验;细胞移植后血清睾酮水平组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 C57小鼠DEHP染毒后睾酮、睾丸病理组织学、细胞凋亡及氧化应激指标变化
2.1.1 血清睾酮变化情况 DEHP染毒组小鼠眶静脉血清睾酮水平较对照组明显降低,差异有统计学意义[(0.508±0.087) ng/mlvs. (1.819±0.049) ng/ml,P<0.01]。
2.1.2 睾丸病理组织学改变 HE染色结果显示,对照组睾丸中未见空泡形成,曲细精管排列密集、层次清晰,曲细精管之间的Leydig细胞散在分布;DEHP染毒组睾丸组织中出现空泡,曲细精管膨胀、排列紊乱,可见生精细胞脱落,Leydig细胞呈团簇状或瘤样聚集(图1)。
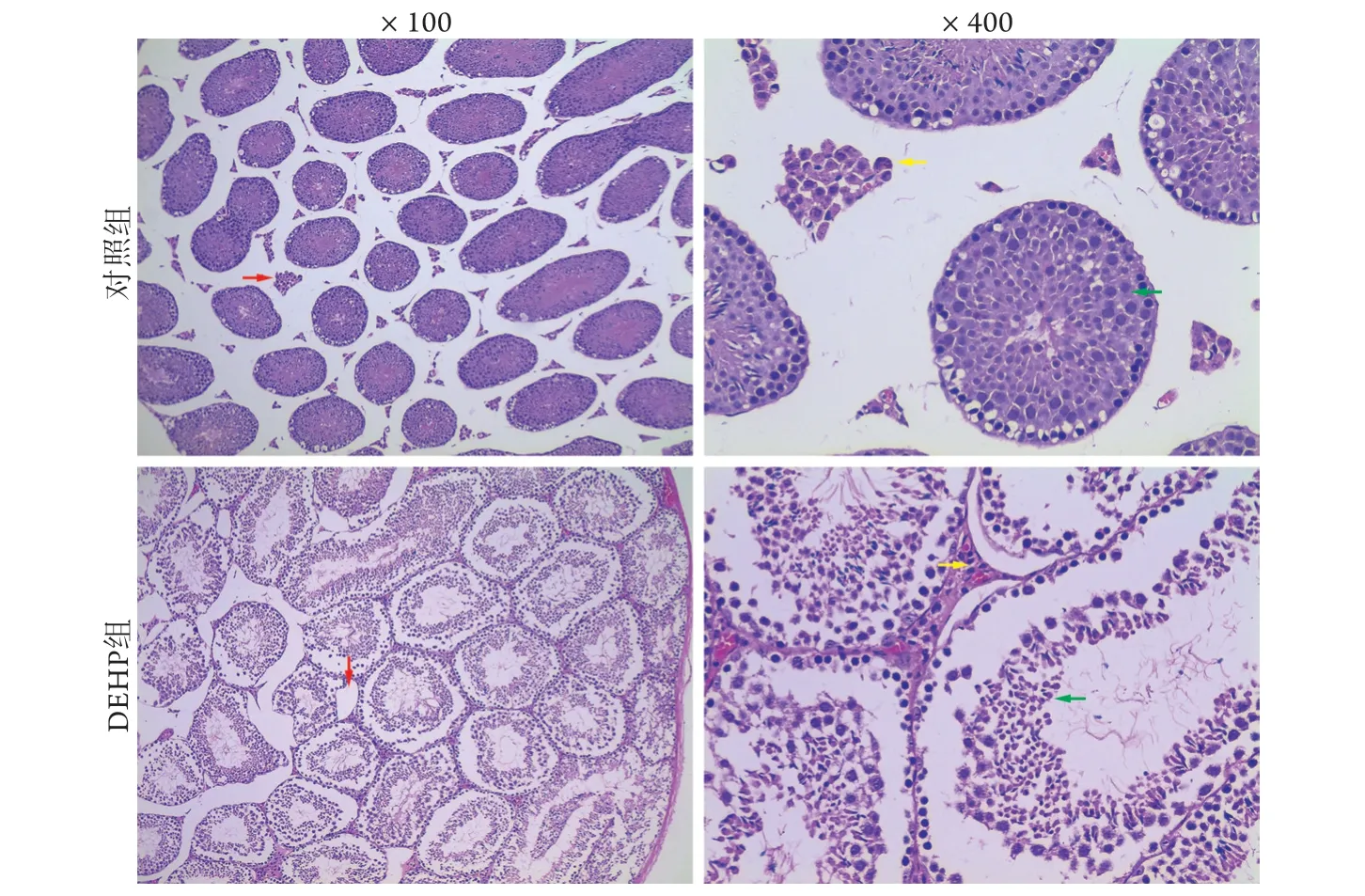
图1 DEHP组与对照组小鼠睾丸组织病理学改变(HE染色)Fig.1 Testicular histopathology of mice in DEHP and control groups (HE staining)
2.1.3 睾丸组织细胞凋亡情况 TUNEL染色结果显示,DEHP组睾丸组织可见部分细胞核呈碎块状,凋亡小体形成,呈细胞凋亡的特征性改变,对照组睾丸组织未见细胞核碎裂及凋亡小体(图2)。
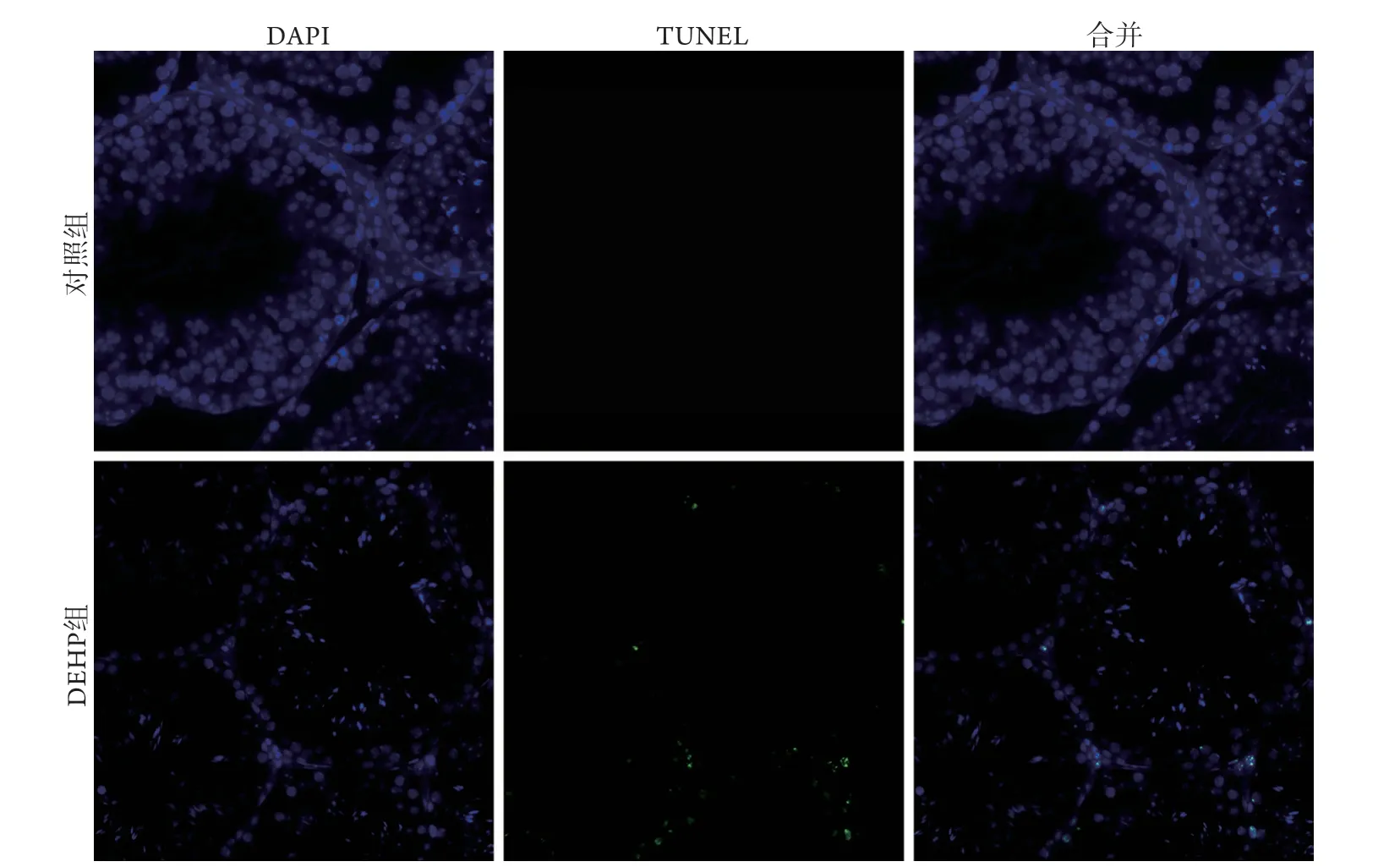
图2 DEHP组与对照组小鼠睾丸组织TUNEL染色结果(×400)Fig.2 TUNEL staining of mouse testes in DEHP and control groups (×400)
2.1.4 DEHP对小鼠睾丸组织MDA、GSH-Px、SOD、GSH的影响 ELISA检测结果显示,与对照组比较,DEHP组小鼠睾丸组织中MDA含量明显增高(P<0.01),GSH含量明显降低(P<0.01),SOD、GSH-Px活性亦明显降低(P<0.001,表1)。
表1 DEHP组与对照组小鼠睾丸组织MDA、GSH-Px、SOD、GSH比较(±s, n=3)Tab.1 Comparison of MDA, GSH-Px, SOD and GSH of mouse testes in DEHP and control groups (±s, n=3)
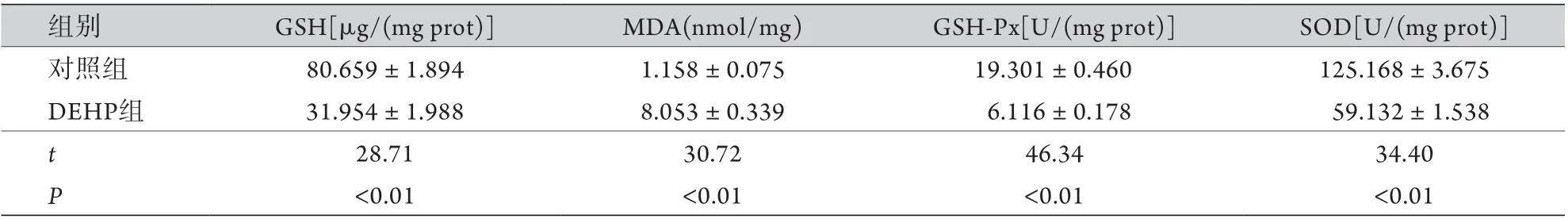
表1 DEHP组与对照组小鼠睾丸组织MDA、GSH-Px、SOD、GSH比较(±s, n=3)Tab.1 Comparison of MDA, GSH-Px, SOD and GSH of mouse testes in DEHP and control groups (±s, n=3)
DEHP. 邻苯二甲酸二(2-乙基己基)酯;MDA. 丙二醛;GSH-Px. 谷胱甘肽过氧化物酶;SOD. 超氧化物歧化酶;GSH. 谷胱甘肽
组别 GSH[μg/(mg prot)] MDA(nmol/mg) GSH-Px[U/(mg prot)] SOD[U/(mg prot)]对照组 80.659±1.894 1.158±0.075 19.301±0.460 125.168±3.675 DEHP组 31.954±1.988 8.053±0.339 6.116±0.178 59.132±1.538 t 28.71 30.72 46.34 34.40 P<0.01 <0.01 <0.01 <0.01
2.1.5 DEHP对小鼠睾丸组织凋亡相关蛋白表达的影响 Western blotting检测结果显示,与对照组比较,DEHP组睾丸组织内caspase-3、caspase-8、caspase-9及Bax蛋白表达水平升高,Bcl-2蛋白表达水平下降,差异均有统计学意义(P<0.05或P<0.01,图3)。
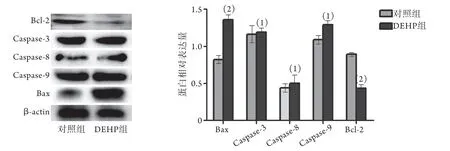
图3 DEHP对小鼠睾丸组织凋亡相关蛋白表达的影响Fig.3 Effect of DEHP on apoptosis protein in mouse testes
2.2 细胞移植后检测
2.2.1 血清睾酮水平测定 ELISA检测结果显示,与对照组及BMSC移植组比较,Leydig样细胞移植组7、14、21 d时血清睾酮水平均明显升高(P<0.05);而BMSC移植组则在14、21 d时睾酮水平明显高于对照组(P<0.05)(表2)。
表2 细胞移植后各组不同时间点血清睾酮水平比较(ng/ml, ±s, n=3)Tab.2 Comparison of serum testosterone levels in each group at different time points after cell transplantation (ng/ml, ±s, n=3)
表2 细胞移植后各组不同时间点血清睾酮水平比较(ng/ml, ±s, n=3)Tab.2 Comparison of serum testosterone levels in each group at different time points after cell transplantation (ng/ml, ±s, n=3)
与对照组比较,(1)P<0.05;与BMSC移植组比较,(2)P<0.05。
组别 7 d 14 d 21 d对照组 0.379±0.030 0.341±0.057 0.424±0.034 BMSC移植组 0.532±0.039 0.617±0.016(1) 0.677±0.012(1)Leydig样细胞移植组 1.735±0.080(1)(2) 2.284±0.056(1)(2) 2.502±0.248(1)(2)
2.2.2 各组睾丸组织病理学改变 细胞移植后7 d,HE染色结果显示,对照组中睾丸组织中可见空泡形成、曲细精管膨胀;Leydig样细胞移植组与BMSC移植组的细胞形态恢复未见明显差异,均可见生精细胞层数增多,排列规则,未见空泡,层次分明(图4)。
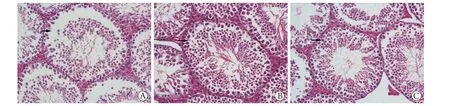
图4 细胞移植后7 d各组睾丸组织病理学改变(HE ×400)Fig.4 Pathological changes of testicular tissue 7 days after cell transplantation in each group (HE ×400)
2.2.3 睾丸组织细胞凋亡情况 细胞移植7 d后TUNEL染色结果显示,与对照组(2.52%±0.56%)比较,Leydig样细胞移植组(0.62%±0.10%)及BMSC移植组(0.91%±0.12%)细胞凋亡率均明显降低(P<0.01),且Leydig样细胞移植组细胞凋亡率较BMSC移植组更低(P<0.01,图5)。
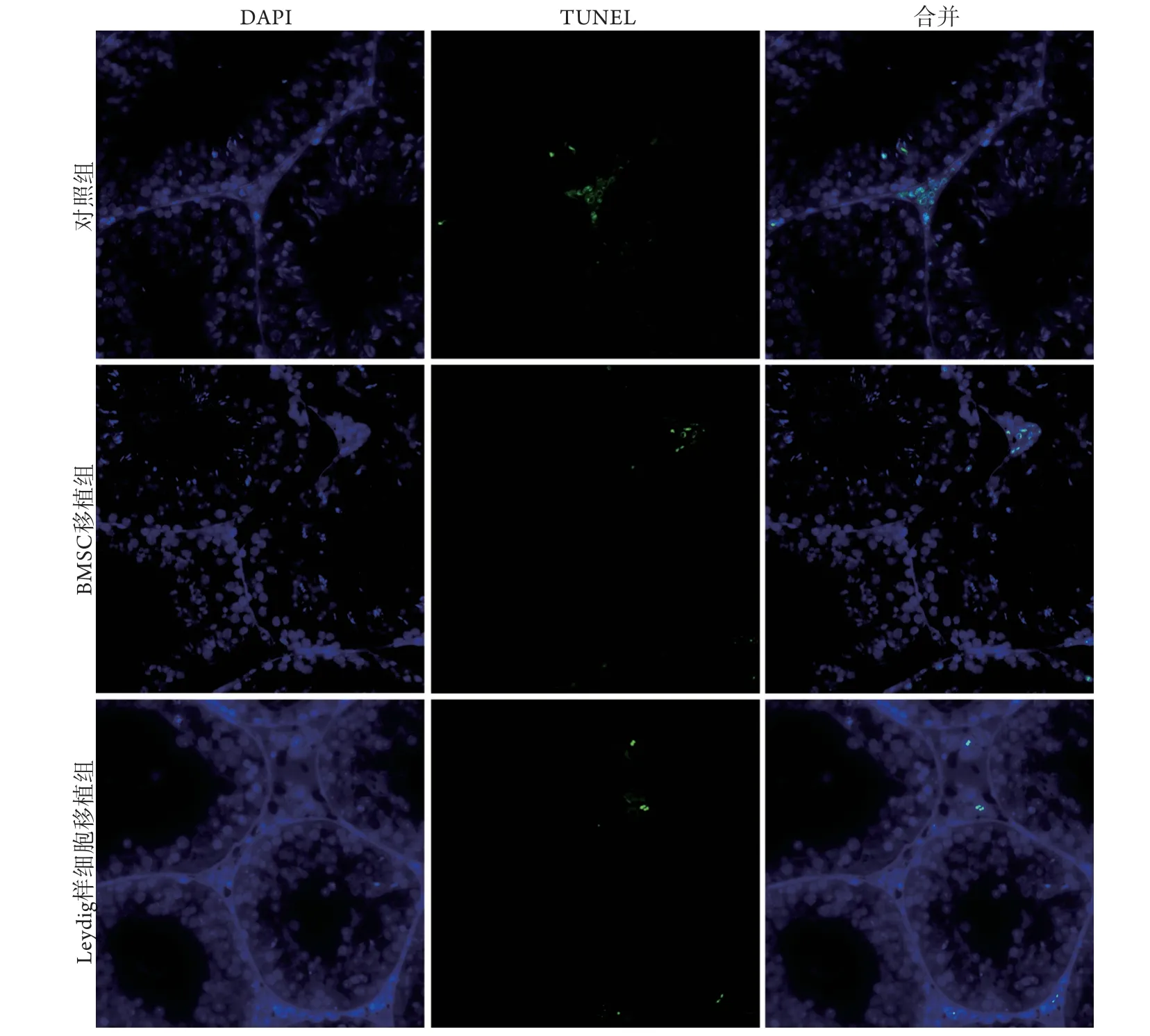
图5 移植后7 d各组睾丸组织细胞凋亡情况(TUNEL)Fig.5 Changes of testicular tissue apoptosis 7 days after transplantation (TUNEL)
2.2.4 细胞移植后小鼠睾丸组织氧化应激指标比较
ELISA检测结果显示,与对照组比较,移植后7、14、21 d,Leydig样细胞移植组及BMSC移植组睾丸组织内SOD、GSH-Px活性明显增强,MDA含量明显降低,细胞内GSH含量明显增高,差异均有统计学意义(P<0.01或P<0.05);且与BMSC移植组比较,Leydig样细胞移植组在各检测时间点SOD、GSH-Px活性明显增强,GSH含量明显增高,MDA含量明显降低,差异均有统计学意义(P<0.05)(图6)。

图6 移植后各组不同时间点睾丸组织氧化应激指标比较Fig.6 Oxidative stress of testis tissue at different time points after cell transplantation in each group of mice
2.2.5 各组小鼠移植后睾丸组织中凋亡相关蛋白表达水平比较 细胞移植后7 d Western blotting检测结果显示,与对照组比较,Leydig样细胞移植组睾丸内caspase-3、caspase-8、caspase-9、Bax蛋白表达水平均明显降低,Bcl-2蛋白表达水平明显升高(P<0.05);与对照组比较,BMSCs细胞移植组睾丸内caspase-3、caspase-8、caspase-9蛋白表达水平均明显降低,Bcl-2蛋白表达水平明显升高(P<0.05);而Leydig样细胞移植组睾丸内caspase-3、caspase-8、caspase-9、Bax蛋白表达水平明显低于BMSCs细胞移植组,Bcl-2蛋白表达水平则明显高于BMSCs细胞移植组,差异均有统计学意义(P<0.05)(图7)。
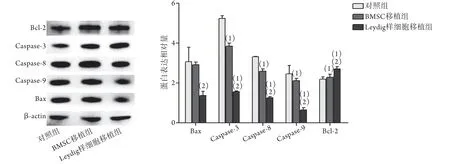
图7 移植后7 d各组小鼠睾丸组织中凋亡蛋白表达水平比较Fig.7 Apoptotic proteins of testes tissue 7 days after cell transplantation in each group of mice
3 讨 论
随着塑料制品等的广泛使用,DEHP对环境的污染日益严重[19]。人和动物通过皮肤、消化、呼吸等方式接触DEHP后可出现免疫系统、神经系统、生殖系统等的相关毒性反应。雄性生殖系统的主要靶器官睾丸也受到了DEHP的影响[7]。睾丸的两大主要功能是合成分泌雄激素和产生精子,其中Leydig细胞合成分泌雄性激素,生精细胞产生精子;而支持细胞为间质细胞提供营养,调节精子产生并参与构成血睾屏障,还可诱导免疫豁免,从而对精子发生和间质细胞功能进行调控[20]。动物实验表明,DEHP染毒后会损害雄性生殖系统的发育及功能,Radke等[19]及Skinner等[21]发现,孕期DEHP暴露后的第一代雄性仔鼠会出现隐睾,同时可能出现附睾损害、青春期发育延迟。Barakat等[22]发现,DEHP染毒后可出现精子数量减少、密度降低。Abdel-Maksoud等[23]发现,DEHP可导致大鼠睾丸发育异常,曲细精管膨胀,且睾丸系数与DEHP剂量存在相关性。多种因素和多个基因可调控睾丸间质细胞凋亡,其中caspase通路在Leydig细胞凋亡中起重要作用[24]。线粒体、死亡受体及内质网通路均为caspase的活化途径。线粒体通路的关键蛋白为caspase-9,对内源性凋亡通路的激活起关键作用,最终引起一系列反应而导致细胞凋亡[24]。Sun等[11]发现,小鼠DEHP染毒后睾丸组织内caspase-3、caspase-8、Bax蛋白水平升高,Bcl-2蛋白水平降低,表明DEHP可诱导小鼠睾丸组织细胞出现凋亡。Ha等[25]发现,在DEHP干预下细胞Bax基因表达上调和Bcl-2基因表达下调,可加速支持细胞的凋亡。Sun等[11]发现,DEHP染毒后的精子细胞内caspase-3、caspase-8及Bax蛋白水平明显升高,Bcl-2蛋白水平明显降低,提示精子细胞发生凋亡与DEHP染毒有关。本研究对C57小鼠进行DEHP染毒后,睾丸组织TUNEL染色结果显示睾丸间质细胞凋亡,且Western blotting检测结果显示睾丸组织中caspase-3、caspase-8、caspase-9及Bax蛋白水平明显升高,Bcl-2蛋白水平明显降低,提示DEHP染毒后睾丸组织细胞凋亡增加;此外,DEHP染毒后睾丸组织MDA含量明显增加,GSH水平明显降低,SOD、GSH-Px活性受到抑制,提示DEHP染毒后睾丸组织发生了氧化应激反应,血清睾酮水平降低,提示睾丸功能出现毒性损害,与多数学者的研究结果一致[11]。
目前,治疗性腺功能减退症主要通过药物及细胞移植两种途径实现[26]。本研究通过移植BMSC来源的Leydig样细胞至DEHP染毒C57小鼠睾丸内,观察睾丸功能修复情况,从组织细胞凋亡及氧化应激的角度探讨细胞移植后睾丸功能的修复机制。Peak等[27]指出BMSCs及脂肪组织来源干细胞(adipose-derived stem cells,ADSC)等移植到鼠睾丸内可存活并表现出Leydig细胞功能。Yang等[15]在D-半乳糖衰老大鼠模型中注入脂肪来源间充质干细胞,发现睾丸间质细胞凋亡减少,睾酮分泌增加,提示ADSC可阻止ROS产生,并使睾丸间质细胞凋亡减少。Wang等[28]发现,大剂量DEHP可使雄性SD大鼠血清促卵泡刺激素(follicle-stimulating hormone,FSH)、黄体生成素(luteinising hormone,LH)和睾酮水平下降,抑制GSH-Px及SOD活性,且使凋亡蛋白Bax、caspase-3的mRNA表达明显升高。本研究通过移植BMSC来源的Leydig样细胞至DEHP染毒小鼠睾丸,发现细胞移植后睾丸组织学上表现为生精细胞形态恢复,排列逐渐规则,TUNEL染色提示睾丸组织细胞凋亡减少;细胞移植后血清睾酮水平逐渐升高,细胞凋亡信号通路相关蛋白caspase-3、caspase-8、caspase-9及Bax表达水平明显降低,而Bcl-2表达水平明显升高,提示细胞移植后睾丸组织凋亡情况得到改善;此外,氧化应激指标MDA含量降低,GSH含量升高,GSH-Px及SOD活性恢复,提示细胞移植后氧化应激反应减轻。以上结果均提示BMSC来源的Leydig样细胞移植能够修复DEHP染毒小鼠睾丸功能,并减轻睾丸组织的凋亡及氧化应激,下一步本课题组将继续研究睾丸功能改变及修复的基因机制。
综上所述,DEHP可引起青春期C57小鼠睾丸损伤,导致睾丸组织细胞凋亡增加,氧化应激反应增强。BMSC来源的Leydig样细胞作为一种新的Leydig细胞来源,移植至DEHP染毒C57小鼠睾丸后,可恢复睾丸的睾酮分泌功能,使睾丸组织细胞凋亡减少、氧化应激反应减轻,并修复DEHP引起的睾丸损伤。因此,移植BMSC来源的Leydig样细胞有望成为一种治疗睾丸功能低下的新方法。
