单孔腹腔镜手术治疗小儿小肠黏膜下血管畸形致肠梗阻1例报告*
2021-09-24王浩清孙德霞
王浩清 姜 斌 孙德霞 黄 磊
(南京医科大学附属儿童医院普外科,南京 210008)
小儿小肠黏膜下血管畸形是良性的小肠血管病变,发生率约占小肠肿瘤的0.05%[1]。患儿通常由于不能准确表述病史、临床症状隐匿、检查配合度差等原因,临床上很少被及时发现。在患儿发育过程中,血管畸形也会伴随生长进而导致严重的并发症,如肠梗阻、肠套叠、消化道大出血等[2]。2020年9月我科采用单孔腹腔镜治疗1例儿童小肠黏膜下血管畸形致肠梗阻,现报道如下。
1 临床资料
女,11岁,因“反复呕吐伴腹痛2月余,加重3 d”于2020年8月25日就诊我院。患儿2个月前出现呕吐伴腹痛,非喷射性,当地医院完善腹部CT提示不完全性肠梗阻,胃镜检查提示中度慢性浅表性胃炎,CRP 18.65 mg/L, WBC 22.13×109/L,Hgb 107 g/L,予以“头孢西丁,西米替丁”等治疗5 d出院,但仍偶有呕吐,可自行缓解。近3 d呕吐伴腹痛加剧,不能缓解,来我院急诊就诊,腹部B超提示左中下腹局部结肠壁肿胀增厚伴近段结肠扩张。急诊以“呕吐待查”收入消化内科。既往体健。查体:神志清楚,精神萎靡,腹部膨软,脐上压痛,无反跳痛,无肌紧张,肠鸣音3次/min,四肢肌力正常。辅助检查:粪钙卫蛋白1158 μg/g(我院正常范围<50 μg/g)。全消化道造影:不完全性肠梗阻,梗阻点位于空肠中远端,近段肠管扩张明显(图1)。腹部MRI平扫+增强:右下腹局部小肠壁增厚、肠腔狭窄伴近段肠管扩张,增强后系膜处可见明显增强(图2~4)。
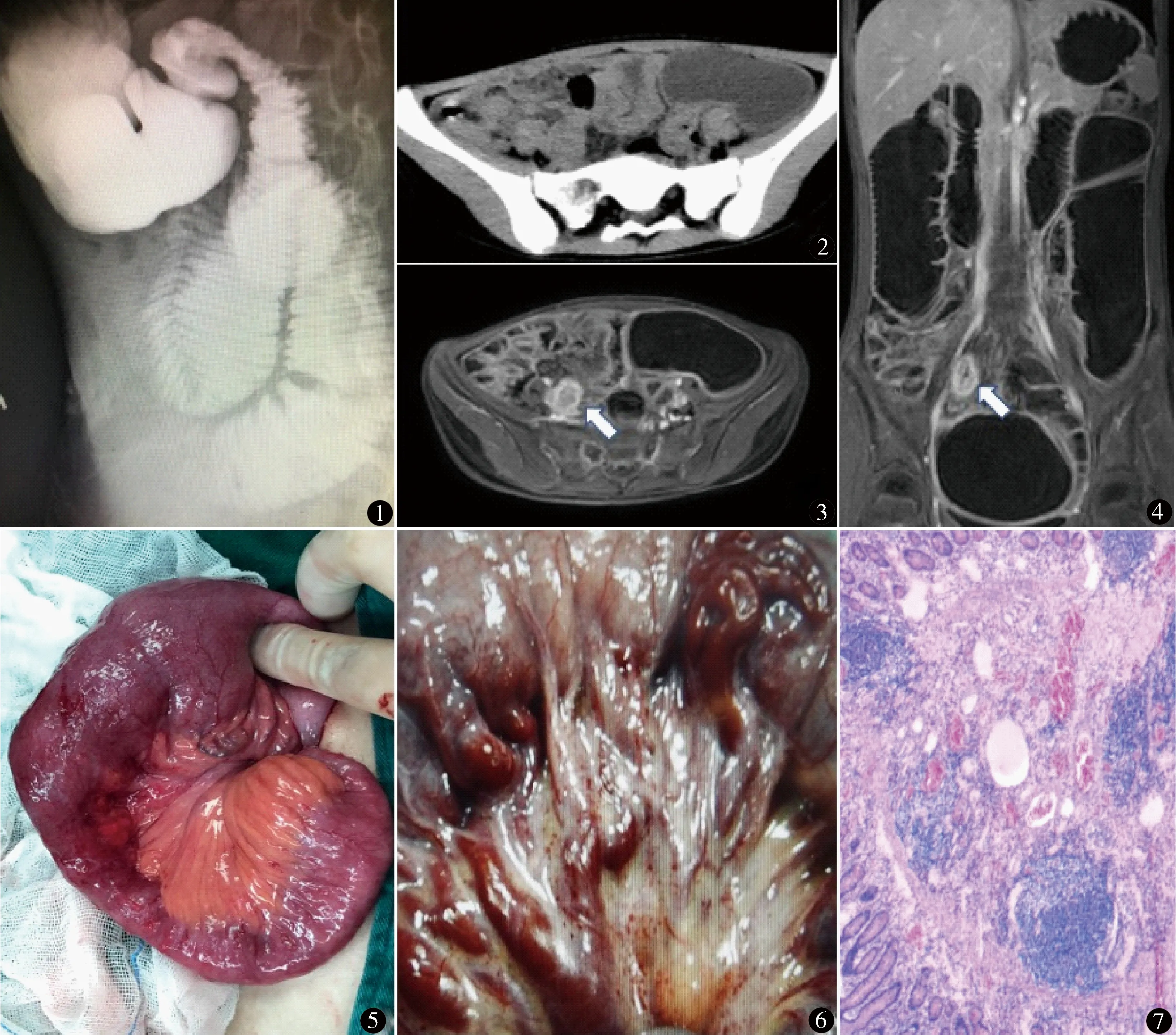
图1 全消化道造影可见十二指肠及近端空场扩张明显,2 h观察扩张的空肠仍可见,部分远端小肠可显影无扩张 图2 全腹部CT平扫可见小肠及系膜增厚,狭窄肠管位于空肠 图3,4 全腹部MRI增强提示空肠中段肠腔狭窄,累及长度约4 cm,近端肠腔明显扩张,远端肠腔充盈不佳,狭窄段肠管系膜明显强化,系膜处部分血管扩张明显 图5 术中可见回肠近段扩张水肿,远段为正常肠管,交接处可见明显狭窄段,此处系膜可见多处异常扩张血管 图6 肉眼可见狭窄段肠管及其系膜表面大量异常扩张的血管及其分支 图7 显微镜下可见多种不同大小和壁厚的扩张血管,形状不规则,其结构影响肠黏膜下层、固有肌层和浆膜层(HE染色 ×200)
患儿入院后完善相关检查,禁食、胃肠减压、抗感染、保护胃黏膜等治疗2周,症状未见好转。术前讨论后于2020年9月9日全麻下仰卧位行单孔腹腔镜探查术。患儿取平卧位,气管插管全麻。放置胃管及尿管,消毒铺单。术者站于患者左侧,助手站于患者头侧。经脐部做长约3 cm纵行切口,置入单孔腹腔镜手术入路系统。气腹压力维持在12 mm Hg。探查腹腔肠管,以盲肠为初始标志,自下往上探查小肠至屈氏韧带,通过无损伤抓钳对肠管系膜进行交替抓持,尽量不要钳夹肠管,纵观小肠全貌和双侧系膜。术中探查见距离屈氏韧带60 cm处一段回肠管腔狭窄,长约4 cm,近段肠管及系膜水肿增厚,肠腔扩张明显,蠕动性差,狭窄段系膜增厚,肉眼可见其表面分布大量异常扩张血管及其分支(图5,6),部分聚集成团,超声刀标记病变肠管。除去气腹,然后扩大脐部切口大小约4 cm,将病变肠管拖至腹腔外,肠钳夹住病变肠管两端,血管闭合器处理此处系膜及血管后切除病变肠管,两断端5-0 PDS线行端端吻合,浆膜层加固,检查肠管无漏无狭窄,还纳腹腔。手术时间2 h,出血量15 ml。术后5 d排气,少量饮水未见不适,逐渐过渡正常饮食。术后10 d出院。考虑病情复杂性,术后病理送我院及外院,均诊断为小肠黏膜下血管畸形(图7)。免疫组化:CD31(血管+),CD34(血管+),SMA(血管壁+),Glut-1(-),D2-40(-),Ki67(5%+)。随访8个月,未见并发症,患儿体重增加3 kg。
2 讨论
小儿小肠黏膜下血管畸形主要发生在空、回肠,临床症状缺乏特异性。发病机制假说常见有3种:先天性血管发育异常;胃肠黏膜慢性缺血;后天获得性退行性改变[3]。目前,与小儿发病相关的以第一种假说为主[4]。小肠血液供给主要来源于肠系膜上动、静脉及其分属支。病变脉管在发育过程中自浆膜面延伸至黏膜面的过程中,其管径维持恒定,血管增多迂曲,恒径脉管搏动产生机械压力使覆盖其上的黏膜变薄,形成黏膜下隆起性病变[5]。本例患儿小肠在发育过程中受到畸形血管压迫导致肠腔狭窄,因瘤体增大产生压迫进而导致反射性呕吐,特点是呕吐时间不固定,为非喷射性,多见于进食后,且进行性加重,多数患儿合并有慢性贫血、营养不良等症状,通过药物及食物治疗症状不能缓解。早期呕吐症状容易忽视,临床上极易误诊而导致治疗的延误,最终进展为肠梗阻[6]。
小肠黏膜下血管畸形早期诊断极其困难,因临床症状不典型,辅助检查的局限性,确诊主要依靠术后病理[7]。目前,该病治疗方案包括:保守治疗、内镜治疗及手术治疗。对于已诊断为肠道血管畸形的患儿且无症状者可选择定期随诊;部分症状较轻的患儿,应用血管生成抑制剂如沙利度胺治疗仅见个案报道[8,9],疗效和机制尚待进一步研究;对于保守治疗失败者可采用内镜检查或者血管造影确认病灶位置,进而通过血管栓塞、内镜下电凝、注射硬化剂、金属夹、激光等治疗血管畸形[10,11];对于已多次内镜治疗无效、突发危及生命的大出血以及诊断未明而症状加重的患儿,首选方法是病变肠管节段性切除[12]。
本例单孔腹腔镜术中探查小肠时需注意使用无损抓钳抓持肠管系膜缘,尽量不要直接钳夹肠管,以免造成肠壁损伤。观察时从回盲部开始向空肠起始部分段检查,注意不要遗漏两侧系膜缘的探查以免造成漏诊。需注意肠管有无扩张及颜色的改变,管腔内有无可疑的积血和积液。怀疑腔内有病变时,可通过扩大脐部切口将该段肠管提出后利用触感进一步辨识。术者需耐心探查直到观察到Treitz韧带的解剖学标志。本例在探查到距离屈氏韧带60 cm处一段回肠时发现可疑病变(图5,6),然后扩大脐部切口提出病变肠管进一步确认,在腹腔外进行肠切除肠吻合。如果肠管直径较粗,有全腔镜下肠吻合的器械和经验,也可以不提出肠管在腹腔内进行操作。
综上所述,小肠血管畸形因临床症状不典型早期确诊较为困难,对于既往无手术史的患儿,出现肠梗阻表现,临床症状经保守治疗不能缓解时,应警惕小肠血管畸形可能,及时行消化道造影、腹部MRI、小肠内镜、小肠血管DSA甚至单孔腹腔镜探查,明确是否有血管病变及肿物的存在,避免误诊。对于不明原因肠梗阻经保守治疗不成功,内镜诊断明确为小肠血管畸形电凝后再次出血治疗效果不佳,小肠血管DSA发现病变血管且栓塞失败的小肠血管畸形,或并无条件行小肠镜及DSA检查者均可考虑单孔腹腔镜探查。该术式具有恢复快,并发症少,切口小而且美观等优点,短期随访未见明显并发症。
