副干酪乳杆菌HD1.7在乙酸胁迫下转录组学研究
2021-09-24葛菁萍平文祥
葛菁萍,康 杰,平文祥,*
(黑龙江大学 a.农业微生物技术教育部工程研究中心;b.生命科学学院 黑龙江省普通高校微生物重点实验室,哈尔滨 150080)
0 引 言
细菌素是由核糖体合成的具有杀菌和抗癌功能的小分子多肽。因此细菌素对多种病原微生物和食品腐败菌生长具有良好的抑制作用。近10 a,细菌素在生物医学领域应用的文献占多数[1],其中大部分涉及革兰氏阴性菌产生的细菌素研究。细菌素对革兰氏阳性菌的研究尚处于起步阶段,主要集中在乳酸菌上。细菌素产生伴随着乙酸产生[2],说明乙酸代谢与细菌素产生之间有一定的联系。细菌素可作为定殖肽、抗菌肽和信号肽来调节微生物的生态功能[3]。作为竞争者的代理人,细菌素将入侵一个新的群体[4]。竞争者在成功建立自己的群落之后,细菌素可以防止其它物种入侵,并通过调节细胞间竞争来调节种群动态[3]。
当细胞在有氧条件处于快速生长时,细菌、真菌和高等生物细胞均可通过某些机制产生发酵产物,如有机酸,以调节细胞碳代谢和能量流动,进而调节细胞的生长和代谢,称为“溢流代谢(overflow metabolism)”[5]。而且细菌的溢流代谢被认为是当中心代谢(糖代谢、脂肪酸代谢、氨基酸代谢)出现饱和时,重新启用的一种独立于中心代谢的路径[6]。溢流代谢对细菌是有益的,这些发酵产物(乙醇、乙酸、乳酸等)能够为细胞提供种群竞争的有力武器,使其在生态竞争中获利,同时作为一种备用的碳源,调节细胞的群体行为[7]。
乙酸代谢调节细胞内的生理活动,细菌素调节细胞外的生理活动。最重要的是,两者密不可分。在革兰氏阳性菌中,许多生物学特性都受到乙酸代谢的调节,如生物膜形成[8]、细菌素生产和显示毒力[9]。细菌通过乙酸代谢间接调节细菌素的产生和生态功能。通过不同浓度乙酸胁迫副干酪乳杆菌HD1.7后,通过转录组学技术检测分析,对细菌素浓度和差异基因展开研究,进一步探讨乙酸对副干酪乳杆菌HD1.7生长代谢的影响。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
副干酪乳杆菌HD1.7由黑龙江大学微生物重点实验室从酸菜发酵液中分离获得,能够产生天然的细菌素;枯草芽孢杆菌ATCC 11774也由该实验室提供,用于细菌素测定过程中的指示菌株;冰乙酸购自天津市恒兴化学试剂制造有限公司。总RNA提取试剂盒(R1200)购自北京索莱宝科技有限公司;ChamQTM Universal SYBR® qPCR Master Mix(Q711-02)购自南京诺唯赞生物科技有限公司;TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(AT341-02)试剂盒购自北京全式金生物技术有限公司。
1.1.2 培养基
MRS液体培养基(g·L-1):蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,葡萄糖20 g,K2HPO42 g,Na2SO30.1 g,NaAc 5 g,MgSO40.2 g,MnSO40.05 g,吐温-80 1 mL,柠檬酸铵2 g,pH值调至5.5,121 ℃灭菌15 min,作为副干酪乳杆菌HD1.7种子液培养基;BP培养基(g·L-1):牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂20 g。pH值调至7.0,121 ℃灭菌15 min,作为枯草芽孢杆菌ATCC 11774种子液培养基;水琼脂:琼脂20 g,水1 000 mL,121 ℃灭菌15 min,作为抑菌试验的下层培养基。
1.1.3 仪器
紫外可见分光光度计(UVmini-1240) 岛津国际贸易上海有限公司;荧光定量PCR仪(ABI7500) 美国Life Technologies公司;高效液相色谱仪(LC20A) 岛津国际贸易上海有限公司;pH Meter (FE20 pH Meter) 梅特勒-托利多(上海)有限公司。
1.2 实验方法
1.2.1 副干酪乳杆菌HD1.7的乙酸胁迫试验
将活化后的副干酪乳杆菌HD1.7以1%接种量接种于MRS培养基中,37 ℃、140 rpm培养至12 h,分别添加2 g·L-1、6 g·L-1和10 g·L-1乙酸,继续摇瓶发酵至60 h,每隔12 h取样。
1.2.2 细菌素浓度检测
1) 细菌素粗制液制备:将每个时间点发酵液进行5 000 rpm、4 ℃离心10 min,上清液经0.22 μm细菌滤器除菌,过滤后的上清液即为含有细菌素的粗制液。
2) 细菌素浓度测定:琼脂扩散法检测发酵上清液的抑菌活性。①将30 mL水琼脂倒入直径14 cm的培养皿中,作为下层培养基,待凝固后摆放牛津杯;②将浓度为107CFU·mL-1的指示菌悬液,以1%比例加入70 mL已融化的BP半固体培养基中,倒在水琼脂上,作为上层培养基;③待上层培养基凝固后,无菌条件下,将牛津杯垂直拔出,在平板底部做好标记;④取0.2 mL细菌素粗制液样品加入到点样孔中;⑤将平板放入4 ℃冰箱正置1 h,使待测样品充分渗透进入半固体培养基中,然后移入37 ℃培养箱中,正置培养18 h,测量抑菌圈大小;⑥将样品抑菌圈直径与对照抑菌圈直径差值代入标准曲线方程,可得到细菌素浓度。
1.2.3 理化指标检测
将每个时间点发酵液稀释100倍进行12 000 rpm、4 ℃离心10 min,取上清液通过液相色谱仪检测代谢产物,如葡萄糖、乳酸和乙酸;将每个时间点发酵液稀释10倍,通过紫外可见分光光度计测定OD600 nm值;通过pH Meter测定每个时间点发酵液pH值。
1.2.4 转录组学检测
将活化后的副干酪乳杆菌HD1.7以1%接种量接种于MRS培养基中,37 ℃、140 rpm培养至12 h,分别添加2 g·L-1(简写为Ace2试验组)、6 g·L-1(简写为Ace6试验组)和10 g·L-1(简写为Ace10试验组)乙酸,未加乙酸的为CK组,进行3次平行试验,培养至24 h。发酵液转入2 mL离心管中,12 000 rpm、4 ℃离心10 min,弃上清,菌体马上-80 ℃冰箱冷冻,送样测序。
1.2.5 数据分析
所有数据用Origin2020b (OriginLab Corp,美国) 进行分析并作图;转录组数据中差异基因筛选标准为FC>1.50和P value<0.05;使用基迪奥在线平台进行GO和KEGG富集分析(https://www.omicshare.com/tools/)。
2 结果与分析
2.1 乙酸胁迫对副干酪乳杆菌HD1.7的影响
副干酪乳杆菌HD1.7单独培养产生5.48±0.10 g·L-1乙酸,选择添加2 g·L-1、6 g·L-1和10 g·L-1乙酸,初步探究乙酸溢流对副干酪乳杆菌HD1.7生长代谢的影响见图1。乙酸胁迫能提高细菌素浓度,但存在阈值,如6 g·L-1乙酸。Ace2试验组、Ace6试验组和Ace10试验组细菌素浓度分别为54.86±1.08 AU·mL-1、99.46±7.82 AU·mL-1和100.35±8.72 AU·mL-1,分别比对照组提高了27.88%、131.84%和133.92%。
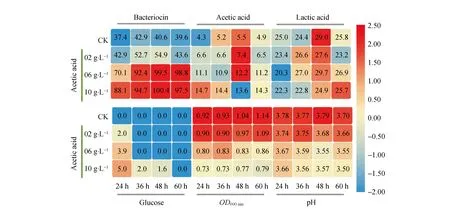
图1 不同浓度乙酸对副干酪乳杆菌HD1.7发酵的影响
Ace2试验组和Ace6试验组(乙酸浓度分别为7.40±0.17 g·L-1和12.17±0.21 g·L-1)未影响到自身产生乙酸(对照组最大乙酸浓度为5.48±0.10 g·L-1)的能力,而Ace10试验组(最大乙酸浓度为14.70±0.20 g·L-1)减弱了自身乙酸代谢,自身乙酸产量降低了14.55%,另外Ace10试验组也降低了乳酸代谢。乙酸胁迫下,葡萄糖消耗速率出现减弱,CK组在24 h时葡萄糖已经消耗完,Ace10试验组在24 h时葡萄糖还剩4.98±0.19 g·L-1。而且随着乙酸浓度增加,OD600 nm值和pH值都出现一定程度下降。
2.2 比较差异基因
相比CK组,Ace2试验组差异基因数为36,其中上调基因为33,下调基因为3; Ace6试验组差异基因数为269,其中上调基因为131,下调基因为138;Ace10试验组差异基因数为296,其中上调基因为209,下调基因为87(图2)。随着乙酸浓度增加,差异基因数也增加。Ace2、Ace6和Ace10试验组相同的差异基因有5个,分别为ydjP、glmS、cspLA、oppA和ykfC;Ace6和Ace10试验组相同的差异基因有90个(图3)。Ace6和Ace10试验组细菌素均被诱导增加,而且细菌素浓度基本一致,因此这90个基因中可能和细菌素被诱导产生相关,以后试验可进一步筛选出和诱导细菌素产生相关的基因。
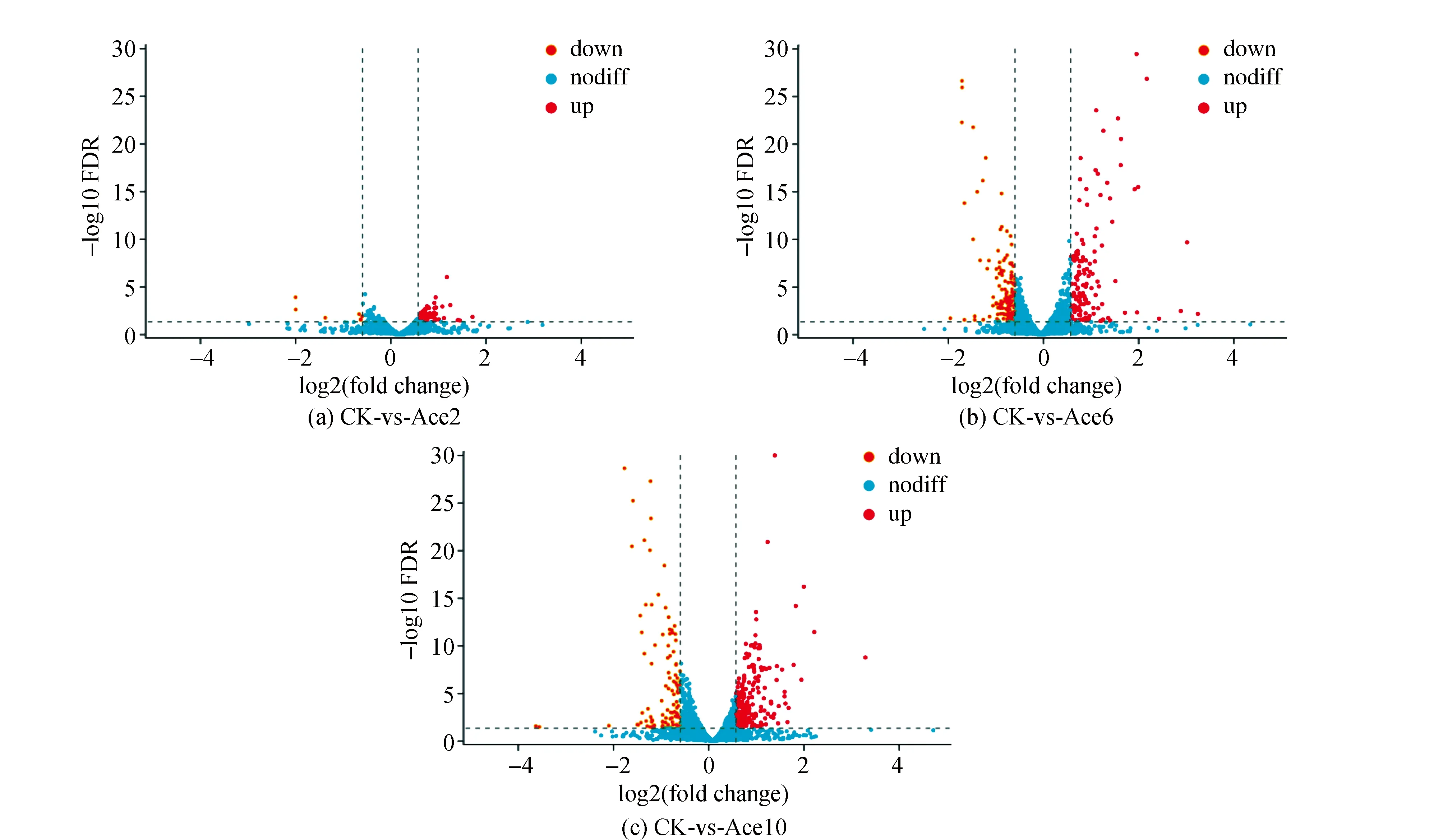
图2 不同浓度乙酸处理下的差异基因
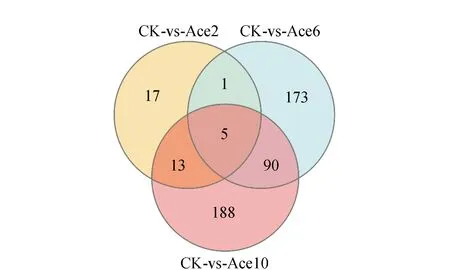
图3 比较不同浓度乙酸处理下的差异基因
2.3 差异基因GO富集分析
差异基因GO富集分析结果分为3部分,见图4。由图4可见,分别为细胞组分、分子功能和生物学过程。在细胞组分方面,Ace2试验组富集的组分种类多;而Ace10试验组富集的组分种类少,但组分内差异基因数多。而且Ace2试验组富集的组分种类包括Ace10试验组富集的组分种类。Ace6试验组没有富集到显著的结果。可能说明少量乙酸对细胞组分影响范围更广,但程度低。在分子功能方面,Ace2试验组富集到4个方面;Ace6试验组富集到3个方面;Ace10试验组富集到7个方面。Ace2试验组、Ace6试验组和Ace10试验组富集结果中,存在一个交集,为核苷碱基跨膜转运蛋白活性(nucleobase transmembrane transporter activity)——它能改变胞外核苷碱基向胞内运输的能力,富集结果中为上调基因,说明添加乙酸有助于细胞吸收胞外核苷碱基。另外也有多种连接酶活性分子功能也被富集到,可能说明酸胁迫时,细胞在节约能量条件下,更多吸收胞外核苷,有助于基因表达。在生物学过程方面,Ace6试验组和Ace10试验组富集结果更广,前10的富集结果见图4,主要集中在基因表达。另外Ace10试验组还明显富集到大分子代谢过程和蛋白质代谢过程。
综上所述,添加乙酸明显改变细胞内基因表达过程,但Ace2试验组改变的范围和程度较小;Ace10试验组改变的范围和程度较大,而且大分子代谢过程和蛋白质代谢过程也发生改变。
2.4 差异基因KEGG富集分析
差异基因KEGG富集分析结果见图4。由图4可见,Ace2试验组富集的通路为核糖体、RNA降解和维生素B6代谢;Ace6试验组富集的通路为嘧啶代谢、丙氨酸代谢、天冬氨酸代谢、谷氨酸代谢、嘌呤代谢;Ace10试验组富集的通路为核糖体代谢、嘌呤代谢、嘧啶代谢、丙氨酸代谢、天冬氨酸代谢、谷氨酸代谢、脂肪酸生物合成、脂肪酸代谢、碳青霉烯生物合成。因此Ace2试验组主要集中在基因表达方面;Ace6试验组主要集中在基因表达和氨基酸代谢方面;Ace10试验组主要集中在基因表达、氨基酸代谢和脂肪酸代谢方面。
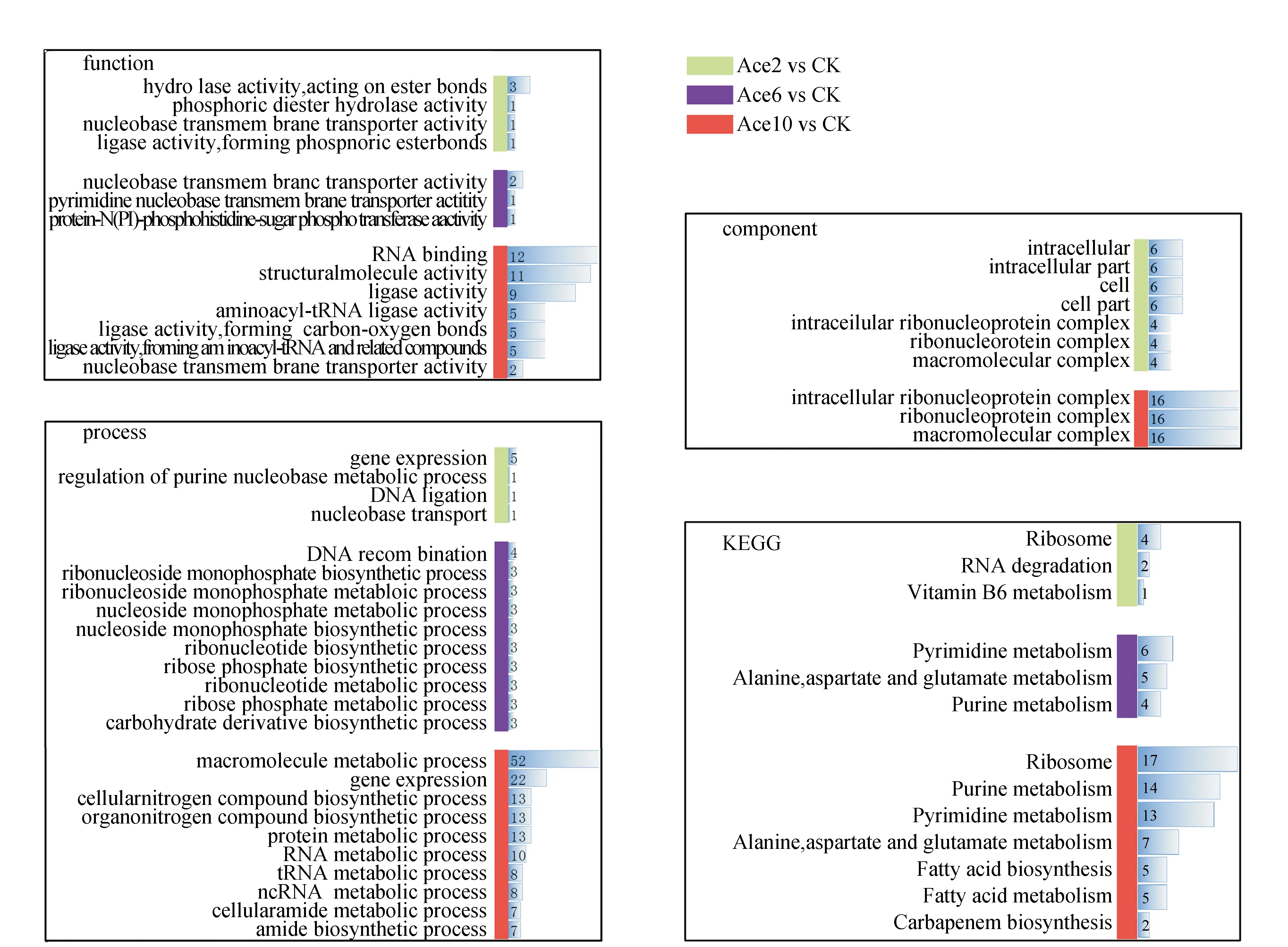
注:CK为对照组;Ace2、Ace6、Ace10为分别添加2、6、10 g·L-1乙酸的试验组。横坐标为基因数;黑色字体分析方法阈值p值<0.05;红色字体分析方法阈值q值<0.05。
综上所述,表明酸胁迫使胞内相关基因表达发生改变,在此基础上,6 g·L-1乙酸使胞内氨基酸代谢发生改变;10 g·L-1乙酸进一步使胞内脂肪酸代谢发生改变。
3 讨 论
乙酸代谢是中枢代谢核心环节,不同浓度乙酸会使细菌产生不同的生理变化。当细菌素增加时,伴随着乙酸浓度增加[10],说明乙酸代谢和细菌素调控系统存在相关性。乙酸排泄以ATP形式产生能量,群体感应系统使用ATP作为其磷酸基团供体(组氨酸蛋白激酶自动磷酸化一个保守的组氨酸残基)[11-12],激活的群体感应系统进一步调控细菌素产生。乙酸代谢不仅为群体感应系统提供磷酸基团,而且胞外乙酸胁迫能触发群体感应系统[13],同时乙酸进入胞内发生电离,氢离子能结合σ因子(σ因子是一种全局转录调控因子,间接调控细菌素产生)蛋白,使其蛋白结构稳定和成熟,易于发挥转录调控因子功能[14]。这是因为其蛋白含有组氨酸,氢离子能使组氨酸质子化,氢离子通过组氨酸开关的pH敏感性耦合到信号识别和基因调节。因此,乙酸胁迫通过多种途径影响细菌素产生。
过量的乙酸胁迫可能会扰乱中心代谢的通量,不利于葡萄糖利用,进一步影响生长[15],与本文研究结果一致。本试验得出6 g·L-1乙酸胁迫影响了氨基酸代谢。胞内乙酸电离后,阴离子的存在增加了内部渗透压,为了维持渗透压,细胞内其他阴离子(最突出的是谷氨酸)的浓度减少[16-17],由此产生的阴离子库的扰动可能会影响新陈代谢的功能,从而影响生长。
4 结 论
与CK组相比,Ace2、Ace6和Ace10试验组细菌素浓度分别提高了27.88%、131.84%和133.92%;转录组学数据中差异基因数分别为36、269和296。Ace6试验组显著改变胞内氨基酸代谢,说明胞外11.10±0.19 g·L-1乙酸已经影响到胞内阴离子池的浓度。Ace10试验组显著影响胞内脂肪酸代谢,表明乙酸浓度为14.70±0.20 g·L-1时,能改变副干酪乳杆菌HD1.7自身乙酸代谢能力。
