首发重性抑郁障碍血NLRP3炎症小体及炎症因子水平研究☆
2021-09-22刘雨佳张秀森邓亚洁何漪庞剑月李恒芬
刘雨佳 张秀森 邓亚洁 何漪 庞剑月 李恒芬
重性抑郁障碍(major depressive disorder,MDD)神经免疫变化受到广泛关注,但具体机制尚不清楚[1-2]。NOD样受体热蛋白结构域相关蛋白3(NOD-like receptors family pyrin domain containing 3,NLRP3)炎症小体是固有免疫的组成部分,其激活可导致 Caspase-1成熟及白介素(interleukin,IL)-1β和IL-18活化[3]。ALCOCER-GÓMEZ 等[3]发现,NLRP3炎症小体及其相关炎症因子可能与首次发作 MDD(first-episode major depressive disorder,F-MDD)有关,目前国内鲜有类似研究。F-MDD除炎症免疫改变外,可能还存在神经元损伤[4],而这种损伤或许与免疫增强有关[5]。当前研究发现伴精神病性症状的重性抑郁障碍(psychotic depression,PD)患者与不伴精神病性症状重性抑郁障碍(non-psychotic depression,NPD)患者具有不同的临床特征[6],可能也存在不同的炎症改变。本研究拟采用病例对照的研究方法,探讨F-MDD中NLRP3炎症小体及其相关炎症因子的水平,并分析F-MDD炎症改变与精神病性症状的相关性。
1 对象与方法
1.1 研究对象患者组为2019年4月至2019年12月郑州大学第一附属医院精神医学科住院的F-MDD患者。纳入标准:①符合《精神障碍诊断与统计手册第五版》(Diagnostic and Statistical Manual of Mental Disorders,Fifth Edition,DSM-5)MDD 诊断标准,且为首次发作;②汉族,18~65岁;③24项汉密尔顿抑郁量表(Hamilton depression scale,HAMD-24)总分≥21分;④未接受过抗抑郁药物治疗或物理治疗,若已用过抗抑郁药治疗,确保入组前1周已自行停药;⑤近2周内无感染性疾病史;⑥无免疫系统疾病史及应用免疫抑制剂或免疫增强剂史;⑦无严重躯体疾病。排除标准:①有精神活性物质滥用史;②有脑器质性精神障碍或其他精神障碍病史;③痴呆患者。共纳入64例患者。依据DSM-5中重性抑郁障碍是否同时伴有幻觉、妄想的相关条目,将患者组分为PD组和NPD组。
对照组来自于同期社会招募的健康志愿者。纳入标准:①不符合DSM-5任何疾病诊断标准,HAMD-24总分<7分;②汉族,18~65岁;③近2周内无感染性疾病史;④无免疫系统疾病史及应用免疫抑制剂或免疫增强剂史;⑤无严重躯体疾病。排除标准:同患者组。共纳入40名健康对照。
本研究经郑州大学第一附属医院伦理委员会批准(伦理审查编号:2020-KY-211)。所有入组人员签署知情同意书。
1.2 研究方法
1.2.1 一般资料与临床特征收集 采用自编表收集一般资料及临床特征,包括性别、年龄、受教育程度、既往史等,并使用HAMD-24评估患者疾病的严重程度。
1.2.2 疾病诊断 由1名精神科医师使用简明国际神经精神障碍访谈(mini-international neuropsychiatric interview,MINI)中文版[7]对所有研究对象进行结构式访谈,然后参照DSM-5诊断标准进行临床诊断,再由1名副高及以上职称的精神科医师复核。
1.2.3 血液样本采集 所有研究对象均于入组时采集肘静脉血5 mL于抗凝管中,静置30 min后,4℃,3000 r/min离心10 min,分离出血浆,同时提取外周血单个核细胞(peripheral blood mononuclear cells,PBMC),-80℃保存待测。
1.2.4 炎症因子和神经元损伤标志物检测 利用酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)方法检测血浆 IL-1β、IL-18、Tau 蛋白、神经丝蛋白轻链 (neurofilament light,NFL),使用江莱生物公司提供的ELISA试剂盒(货号分别为 JL13662、JL19261、JL14405、JL32728,试剂盒检测灵敏度依次为最低检测浓度<0.1 pg/mL、<1.0 pg/mL、<1.0 pg/mL、<10 pg/mL)。利用蛋白印迹实验(western-blot)检测 PBMC中 NLRP3炎症小体、Caspase-1蛋白水平,采用BCA法蛋白定量,结果比较时采用NLRP3相对含量(NLRP3表达水平/内参水平)和 Caspase-1相对含量(Caspase-1表达水平/内参水平)。
1.3 统计学方法采用SPSS 21.0进行数据分析。HAMD-24总分、Caspase-1等资料正态分布,以±s描述,组间比较用两独立样本t检验,多组比较采用方差分析;年龄、NLRP3炎症小体、IL-18、IL-1β、NFL、Tau蛋白等资料为非正态分布,以M(QL,QU)描述,组间比较采用 Mann-Whitney U检验,多组比较采用Kruskal-Wallis H检验,两两比较采用Bonferroni校正。性别、婚姻状况、受教育程度等组间比较采用检验。以有无精神病性症状为因变量(NPD=0,PD=1),将比较分析中有统计学差异的变量纳入多因素logistic回归,采用逐步向前法,分析PD的影响因素。检验水准α=0.05,双侧检验。
2 结果
2.1 社会人口学资料和临床特征患者组年龄18~55岁,对照组年龄 18~37岁,两组年龄、性别、受教育程度、婚姻之间差异不具有统计学意义(P>0.05)。PD组、NPD组、对照组的年龄、性别、婚姻、受教育程度差异不具有统计学意义(P>0.05)。PD组与NPD组婚姻状况的差异具有统计学意义(=3.954,P=0.047),年龄、性别、受教育程度差异不具有统计学意义(P>0.05)。见表1。

表1 各组社会人口学资料和临床特征
2.2 NLRP3炎症小体及其相关炎症因子与神经元损伤标志物水平患者组血浆IL-18(Z=-3.832,P<0.001)、IL-1β(Z=-2.362,P=0.018)水平均高于对照组,差异具有统计学意义,两组NLRP3炎症小体、Caspase-1、NFL、Tau蛋白水平差异不具有统计学意义(P>0.05)。PD 组、NPD 组、对照组间 IL-18(=16.145,P<0.001)、IL-1β(=6.493,P=0.039)水平差异具有统计学意义。两两比较,PD组IL-18(Z=-3.675,P<0.001)、IL-1β(Z=-2.423,P=0.015)水平高于对照组,NPD组IL-18高于对照组(Z=-2.916,P=0.004)。其余两两比较差异均无统计学意义(P>0.05)。见表 2。
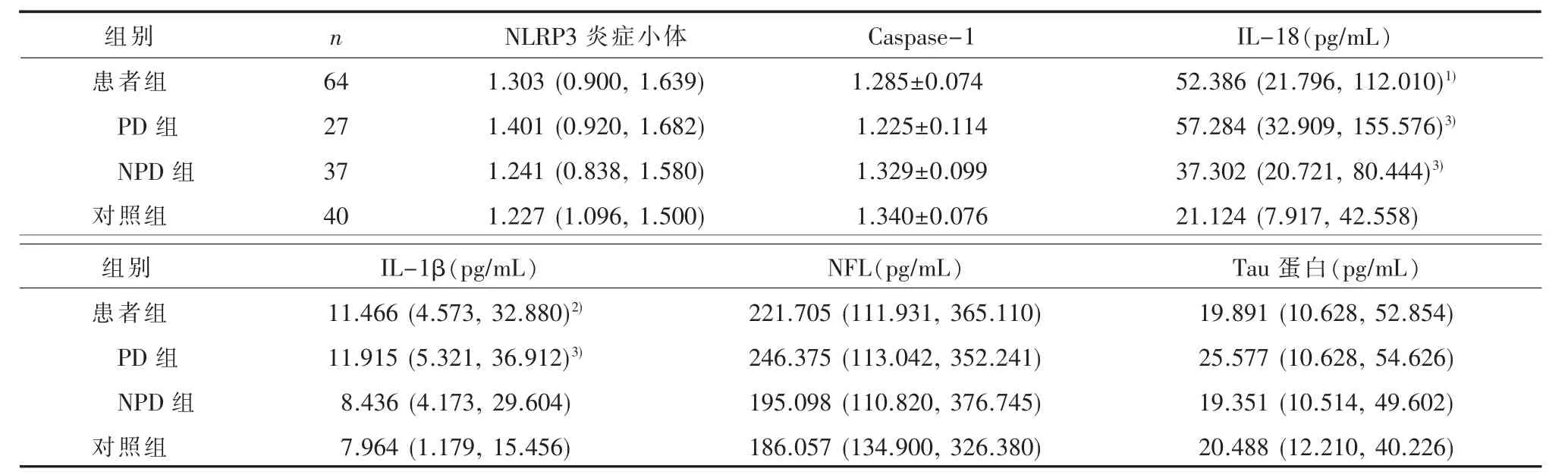
表2 各组NLRP3炎症小体及其相关炎症因子与神经元损伤标志物水平
2.3 首发重性抑郁障碍伴精神病性症状的影响因素多因素logistic回归分析显示,与患者伴PD相关联的因素为婚姻状况(OR=0.171,95%CI:0.032~0.911,P=0.038)、IL-18 水平(OR=1.023,95%CI:1.003~1.044,P=0.025),见表 3。
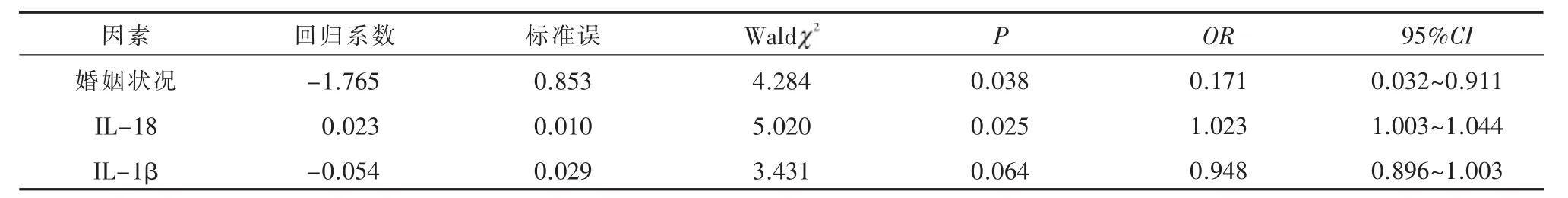
表3 首发重性抑郁障碍伴精神病性症状的影响因素
3 讨论
本研究发现患者组血浆IL-18、IL-1β水平高于对照组,提示F-MDD存在IL-18、IL-1β介导的免疫激活倾向。ALCOCER-GÓMEZ等[3]研究发现MDD存在IL-18、IL-1β的激活,本研究与其结果一致,动物实验[8]也支持这一观点。本研究未发现患者组和对照组间NLRP3炎症小体、Caspase-1有差异,这与ALCOCER-GÓMEZ等[3]的研究结果不一致,可能与样本量以及抑郁严重程度不同有关。有研究将NLRP3炎症小体、Caspase-1、IL-18、IL-1β视作一个通路[9],但本研究却发现其在FMDD中的变化并不一致,可能是因为IL-18、IL-1β在F-MDD中参与的炎症通路较多,而NLRP3炎症小体、Caspase-1只是其上游的一个节点,提示F-MDD存在多种炎症免疫改变。
有研究发现MDD患者的外周炎症因子 (如IL-1β、IL-6等)可增加神经元凋亡[5],干扰神经形成[10]。NFL和Tau蛋白是细胞骨架的重要组成部分,参与神经元的发育和功能维持,可作为反映神经元损伤的生物标志物[11-12]。本研究为探究F-MDD发生炎症改变的同时是否存在神经元损伤,对NFL、Tau蛋白进行研究,结果显示NFL和Tau蛋白水平在患者组和对照组间的差异不具有统计学意义,该结果与AL SHWEIKI等[13]研究结果相一致。
PD组与NPD组炎症激活水平不同,存在免疫异质性。本研究结果显示,与对照组相比,PD组患者 IL-1β、IL-18水平升高,NPD组患者仅 IL-18升高,PD组与NPD组炎症免疫改变不同,提示F-MDD不同亚型之间存在异质性,RANTALA等[14]研究支持这一结论。进一步对PD的影响因素进行logistic回归分析,结果显示,已婚、IL-18水平越高,F-MDD伴精神病性症状的可能性越大。辛立敏等[6]研究显示,与NPD患者相比,PD患者具有更多已婚的特点,本研究结果与之一致。
本研究发现F-MDD患者存在由IL-18、IL-1β介导的免疫激活状态,已婚、IL-18高水平可能与F-MDD伴精神病性症状有关。而本研究中NLRP3炎症小体变化尚不突出,可能是样本量少、观察指标多呈偏态分布所致,后续研究可通过增加样本量、对F-MDD进行亚型分析来进一步探讨。
致谢:衷心感谢郑州大学第一附属医院生物样本库和国家人类遗传资源共享服务平台 (平台编号:2005DKA21300)在本研究血液样本保存中提供的帮助。
