橙汁饮料中橙与橘成分双重实时荧光定量PCR检测技术
2021-09-22陈茵茵陈丹霞韩志杰丁清龙
陈茵茵 李 娟 周 露 陈丹霞 韩志杰 丁清龙
(1. 广东省食品检验所,广东 广州 510000;2. 广东食品药品职业技术学院,广东 广州 510000)
随着人们生活水平的提高,果汁的需求量和消费量逐年增加,果汁掺假事件也频繁发生。据统计[1],世界上约有60%~80%的果汁饮料存在不同程度的掺假现象。消费者很难通过外观、口感识别这些虚假标识、高价果汁掺杂低价果汁等的掺假果汁饮料。橙汁是国际上消费最广的果汁之一,其销量占全球果汁销量的50%以上[2]。但由于市面上橙类的价格要普遍高于橘类,存在部分不法商贩向橙汁中掺杂橘汁的行为。
目前中国对橙汁的鉴别标准有NY/T 290—1995 《绿色食品橙汁和浓缩橙汁》、GB/T 12143—2008《饮料通用分析方法》、GB/T 21731—2008 《橙汁及橙汁饮料》、GB/T 21730—2008《浓缩橙汁》,但均是通过感官和一些常规的理化指标来鉴别橙汁。为此,国内外学者研究了多种橙汁品质鉴别的方法,如:① 理化鉴别(测定糖[3-4]、有机酸[5]、氨基酸[6]等);② 特定有机物鉴别(测定果胶、黄酮类物质[7]等);③ 无机物鉴别(测定稳定同位素[8-9]等);④ 利用先进的设备测定特定成分鉴别(如液相色谱[10-11]、电感耦合等离子体质谱[12]、电子舌[13]等)。但由于水果成分易受品种、产地、季节、环境等因素的影响,以及果汁中掺杂的其他化学成分,给化学成分鉴定造成了困难[14]。
随着分子生物技术的发展,常规PCR、实时荧光PCR、DNA条形码等分子生物学方法已经被应用到果汁真伪鉴别中,如:Ng等[15]利用分子生物学方法鉴定鲜榨和还原橙汁;梁宇斌等[16]建立了果汁中柑橘属植物成分的SYB Green实时荧光PCR检测方法;刘伟红等[17]建立了柑橘属植物成分的普通PCR检测方法等。以上学者的研究均基于单一水果品种的靶向检测,未能区分柑橘属植物成分中的橙和橘成分,在果汁鉴伪中未能鉴别是否是高价果汁掺杂低价果汁。
试验拟设计并筛选橙、橘成分检测引物、探针,并建立双重实时荧光定量PCR的方法检测橙汁饮料中的橙与橘成分,以期实现橙汁饮料中橙和橘成分的检测。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
美国新奇士、印度伦晚脐橙、埃及橙、南非夏橙、广西砂糖橘、云南丑柑、柑橘、沃柑、黑加仑、红树莓、黄树莓、黄桃、蓝莓、葡萄鲜果及橙汁饮料(如表1所示):京东超市。

表1 橙汁饮料信息
1.1.2 主要试剂
深加工食品DNA提取试剂盒:北京天根生化科技有限公司;
异丙醇:分析纯,东莞市嘉诚化工有限公司;
无水乙醇:分析纯,佛山月月红化工有限公司;
2×Super Real Pre Mix (Probe):北京天根生化科技有限公司;
液氮:广州盛盈化工有限公司。
1.2 仪器与设备
生物安全柜:1379型,赛默飞世尔科技(中国)有限公司;
涡旋混匀器:MS型,德国IKA公司;
台式离心机:Centrifuge 5430型,德国艾本德股份公司;
冷冻离心机:Stratos型,赛默飞世尔科技(中国)有限公司;
恒温孵育装置:IKA F2.0型,德国IKA公司;
微量核酸蛋白测定仪:Nano型,日本岛津公司;
超低温冰箱:BioPlus RF 930型,丹麦GRAM公司;
实时荧光PCR仪:QuantStudio 6 Flex型,赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 实时荧光定量PCR扩增产物合成 实时荧光定量PCR扩增引物和探针如表2所示,均由生工生物工程(上海)股份有限公司合成。

表2 引物和探针
1.3.2 DNA提取
(1) 水果样品前处理:取适量水果放入洁净的预先预冷的研钵中,加入适量的液氮进行研磨,反复重复此步骤至样品被研磨成粉末状态,迅速将样品移至预冷离心管中。不同水果之间的前处理要避免交叉污染,处理后的样品存放于超低温冰箱中备用。
(2) 果汁饮料前处理:取适量混匀后的果汁饮料于50 mL离心管中,4 ℃冷冻离心15 min(9 000~10 000 r/min),弃上清,留沉淀或底部浊汁备用。
(3) DNA提取:优化试剂盒法。① 取经过前处理后的水果样品约500~700 mg、果汁饮料约1 mL于离心管中,加入异丙醇1 mL,混匀后在室温放置10 min,随后放入离心机于12 000 r/min离心10 min,弃上清,重复此步骤1次;② 加入500 μL缓冲液 GMO1和20 μL Proteinase K(20 mg/μL),旋涡振荡1 min,混合均匀;③ 在56 ℃恒温条件下孵育3 h,孵育过程每隔15 min振荡混合;④ 加入200 μL缓冲液GMO2,充分混匀,涡旋振荡1 min后,室温静置约10 min;⑤ 12 000 r/min离心5 min,并将上清液转移至洁净无菌离心管中;⑥ 向上清液中加入0.7倍体积的异丙醇,混合均匀,置于-20 ℃冰箱内静止30 min,12 000 r/min离心5 min,弃上清,保存沉淀;⑦ 向沉淀物加入700 μL 70%乙醇,混合均匀,静止10 min,12 000 r/min离心5 min,弃上清液,重复此步骤1次;⑧ 打开离心管管盖,在室温条件下放置5~10 min,直至彻底晾干离心管中残余的乙醇;⑨ 加入50~100 μL的洗脱缓冲液TE,旋涡振荡1 min,最终得到DNA溶液。
1.3.3 DNA提取效果验证
(1) 纯度验证:利用Nano核酸蛋白分析仪对提取的各个基因组DNA纯度(OD260 nm/OD280 nm)以及各自的浓度进行测定,识别DNA提取过程是否受到污染。
(2) 可扩增性验证:参照SN/T 1204—2016《植物及其加工产品中转基因成分实时荧光PCR定性检验方法》对所提取的DNA样品进行检测,以确定所提取DNA样品的可扩增性。所使用的引物和探针见表3,反应体系见表4,反应程序见表5。

表3 植物通用引物和探针

表4 PCR 扩增反应体系
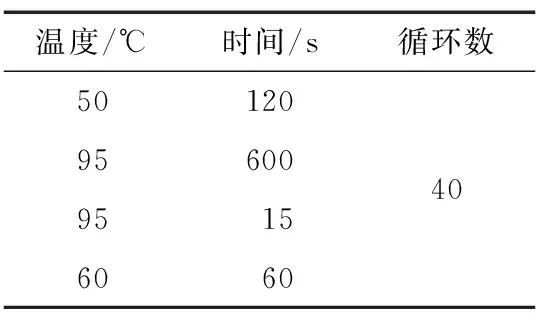
表5 PCR 扩增反应程序
1.3.4 R22引物、探针通用性和特异性验证 使用美国新奇士、印度伦晚脐橙、埃及橙、南非夏橙、广西砂糖橘、云南丑柑、柑橘、沃柑8种柑橘属植物作为验证样品,无菌超纯水为空白对照,验证R22引物和探针对扩增柑橘属植物的通用性。使用黑加仑、红树莓、黄树莓、黄桃、葡萄、蓝莓6种常见的非柑橘属水果作为验证样品,砂糖橘和新奇士作为阳性对照,无菌超纯水作为空白对照,以确定引物和探针的特异性。反应体系见表6,反应程序见表5。
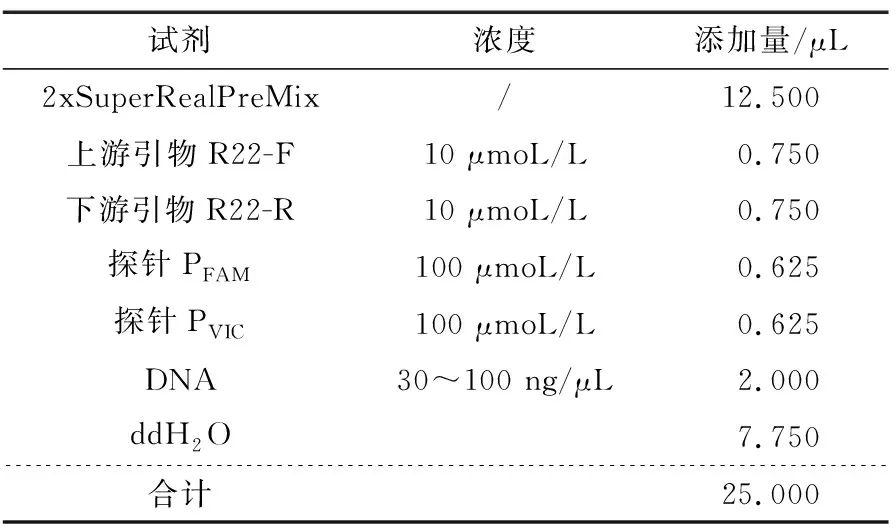
表6 PCR 扩增反应体系
1.3.5 模拟橙汁掺杂柑橘汁试验 制备鲜榨纯橙样品(新奇士)和纯柑橘样品(青橘),将橙汁与柑橘汁按不同比例混合掺杂(V橙汁∶V柑橘汁分别为0∶10,1∶9,2∶8,3∶7,4∶6,5∶5,6∶4,7∶3,8∶2,9∶1,10∶0)。对混合的果汁进行DNA提取和双重实时荧光PCR扩增试验。
1.3.6 双重实时荧光PCR法可行性验证 对市售饮料进行DNA提取和双重实时荧光PCR扩增检测,验证双重实时荧光PCR方法的可行性。
2 结果与分析
2.1 DNA提取质量
2.1.1 DNA纯度 用Nano核酸蛋白分析仪对美国新奇士、伦晚脐橙、埃及橙、南非夏橙、广西砂糖橘、云南丑柑、柑橘、沃柑、黑加仑、红树莓、黄树莓、黄桃、蓝莓、葡萄14种纯水果DNA进行纯度和质量浓度测定,所有样品的DNA纯度(OD260 nm/OD280 nm)均在1.7~2.1范围之间,纯度较好,DNA提取过程不存在污染,结果见表7。
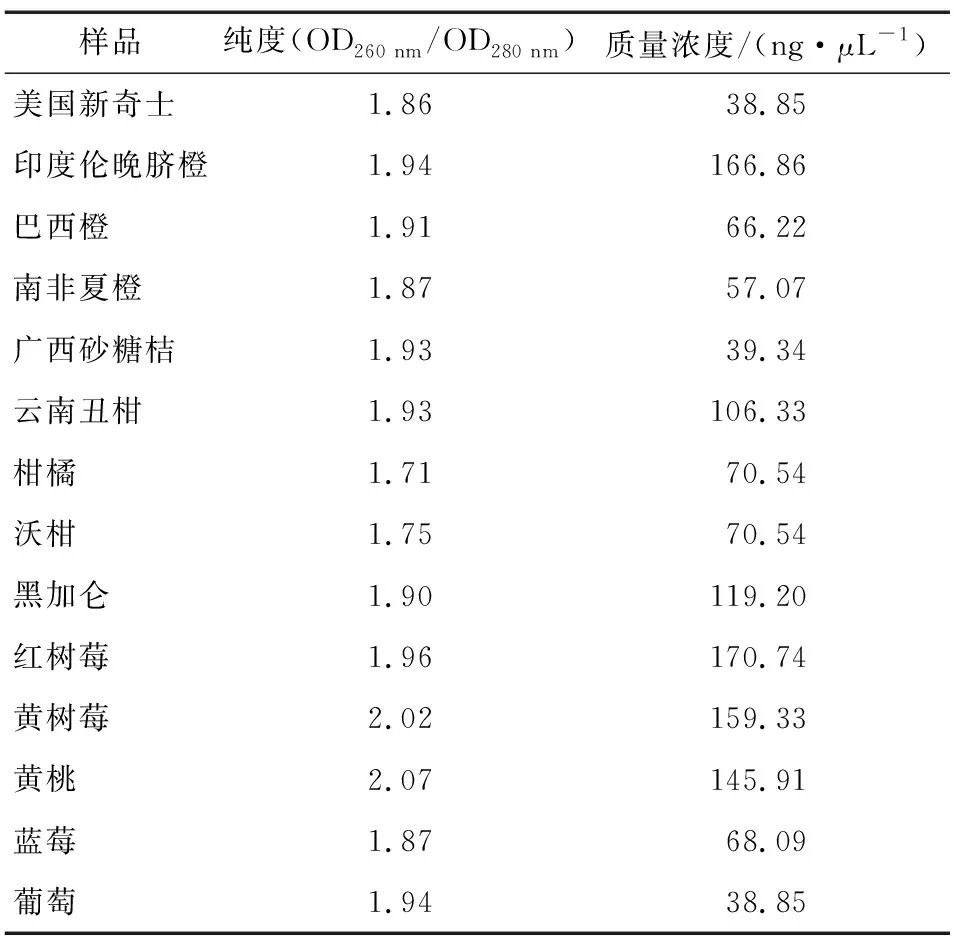
表7 纯水果样品纯度及质量浓度
2.1.2 DNA可扩增性 应用植物通用18S rRNA基因引物和探针对所提取的DNA样品进行扩增,如图1所示,所有样品均扩增出典型的S型荧光曲线,阴性对照和空白对照均正常,结果表明所有样品均有适合PCR扩增的DNA。

A. 黄树莓 B. 红树莓 C. 黑加仑 D. 广西砂糖桔 E. 黄桃 F. 云南丑柑 G. 埃及橙 H. 葡萄 I. 沃柑 J. 伦晚脐橙 K. 美国新奇士 L. 柑橘 空白. 超纯水 阴性对照. 牛肉
2.2 R22引物、探针通用性
为确定所设计和筛选的R22引物和探针的通用性,首先使用典型的、具有代表性的纯橙样品(美国新奇士)和纯橘样品(广西砂糖桔)来确定R22引物和探针对橙和橘的典型扩增曲线图谱,结果见图2。纯橘样品仅在FAM通道有扩增曲线,CT值约为14.51,荧光值约为3 373 161.750,在VIC通道无荧光扩增曲线。纯橙样品在VIC通道和FAM通道均有扩增曲线,CT值分别为22.97,23.24,荧光值分别为976 360.625,356 213.219,两通道荧光比值(FAM/VIC)约为0.36,在0.5±0.2的范围内。
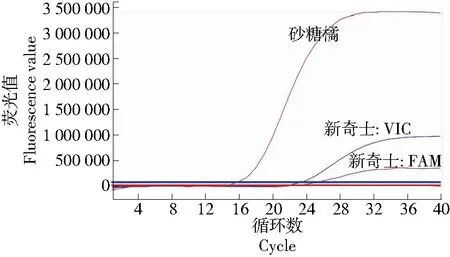
图2 纯橙样品、纯柑橘样品的荧光扩增图谱
使用橙类的其他栽培品种(伦晚脐橙、埃及橙、南非夏橙)和橘类的其他栽培品种(云南丑柑、柑橘、沃柑)验证R22引物和探针的通用性,结果见图3。
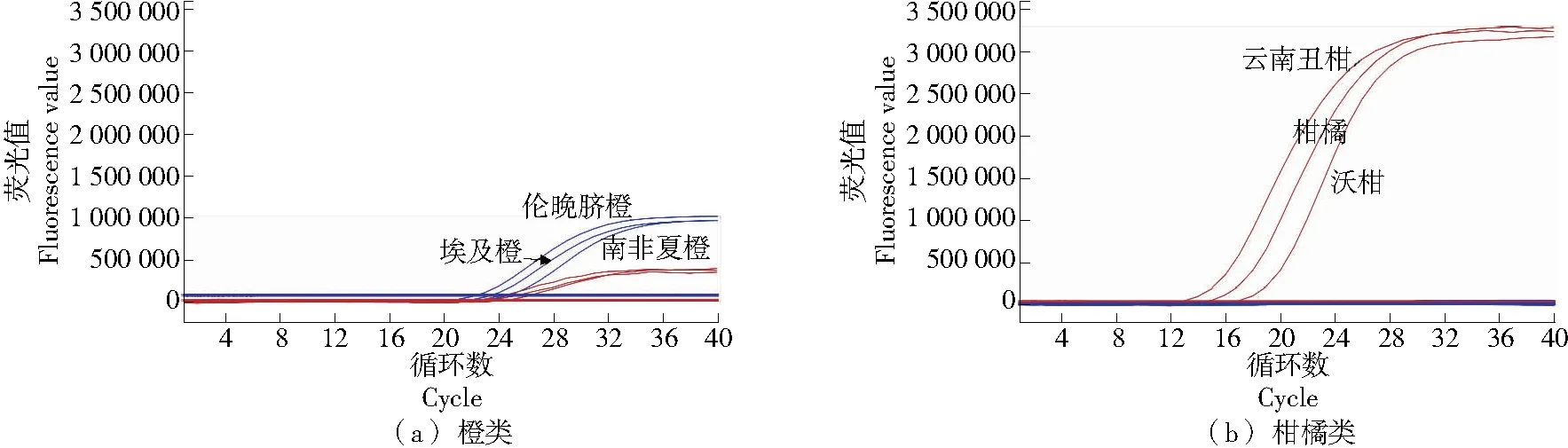
图3 橙类和柑橘类其他栽培品种的荧光扩增曲线结果
如图3(a)所示,橙类的其他栽培种样品的荧光扩增曲线和纯橙(美国新奇士)的荧光扩增曲线相似,VIC通道和FAM通道均有荧光扩增曲线,CT值和荧光值如表8 所示,两通道荧光比值(FAM/VIC)在0.5±0.2的范围内。
如图3(b)所示,橘类的其他栽培品种样品的荧光扩增曲线和纯橘(广西砂糖桔)的荧光扩增曲线相似,仅在FAM通道有扩增曲线,VIC通道无荧光扩增曲线,FAM通道的CT值和荧光值如表8所示。
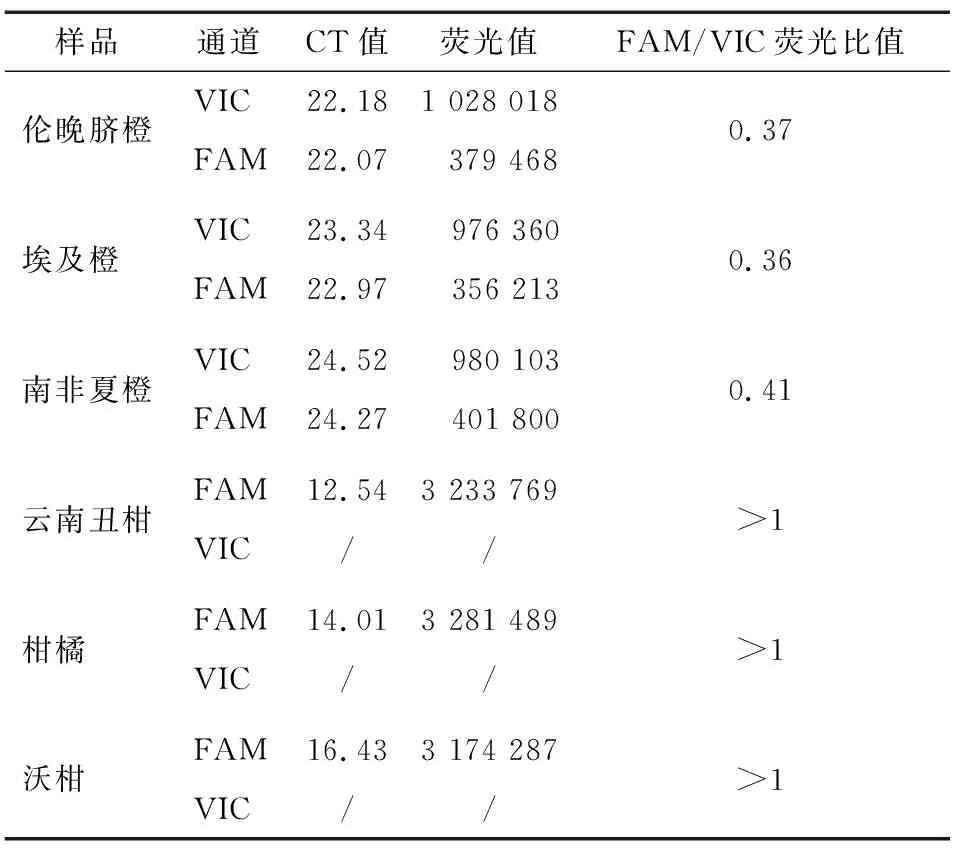
表8 橙类和柑橘类的其他栽培种荧光扩增CT值及荧光值
2.3 R22引物、探针的特异性
为确定所设计和筛选的R22引物和探针的特异性,使用R22引物和探针对黑加仑、红树莓、黄树莓、黄桃、蓝莓、葡萄6种非柑橘属水果进行实时荧光PCR扩增,用典型样品纯橙(新奇士)和纯橘(砂糖桔)做阳性对照,结果见图4。R22引物和探针对黑加仑、红树莓、黄树莓、黄桃、蓝莓、葡萄6种非柑橘属水果的实时荧光PCR扩增结果均为阴性,说明R22引物和探针对非柑橘属类水果无扩增性,具有较好的特异性。
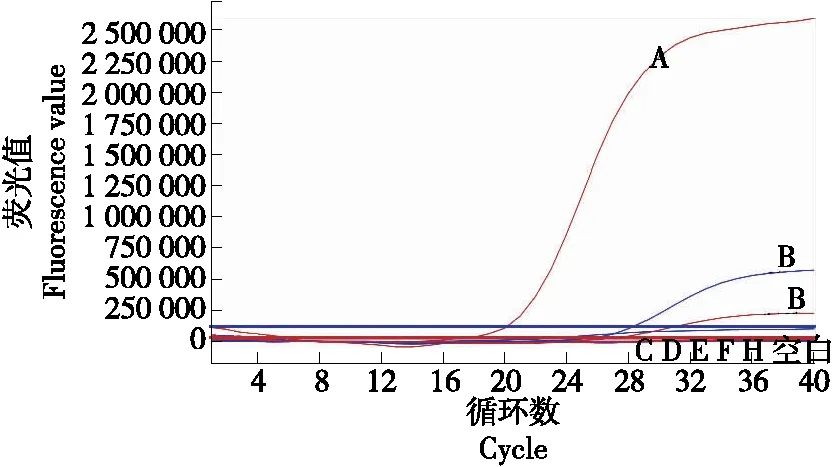
A. 砂糖橘 B. 新奇士 C. 黑加仑 D. 红树莓 E. 黄树莓F. 黄桃 G. 蓝莓 H. 葡萄 空白. 超纯水
2.4 橙汁掺杂橘汁的模拟试验
为确定R22引物和探针的检测灵敏度,按不同的比例模拟橙汁掺杂橘汁试验,混合样品进行DNA提取后使用R22引物和探针进行实时荧光PCR扩增,扩增曲线见图5,结果见表9。
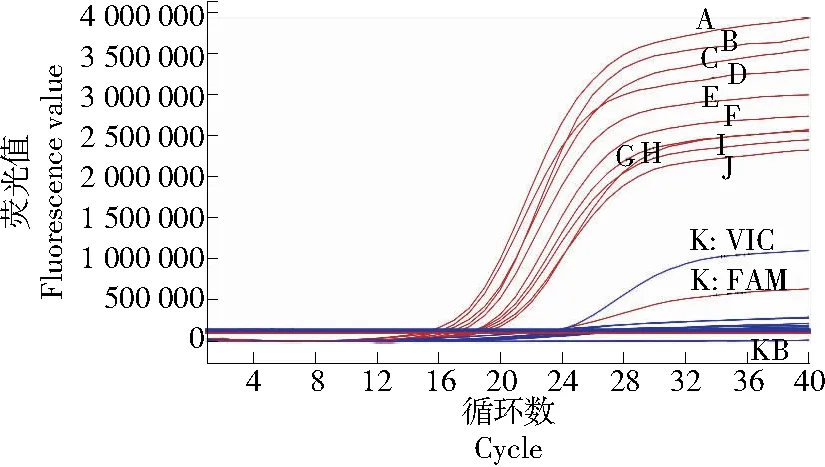
A、B、C、D、E、F、G、H、I、J、K依次对应V橙汁∶V柑橘汁为0∶10,1∶9,2∶8,3∶7,4∶6,5∶5,6∶4,7∶3,8∶2,9∶1,10∶0的样品 KB. 空白
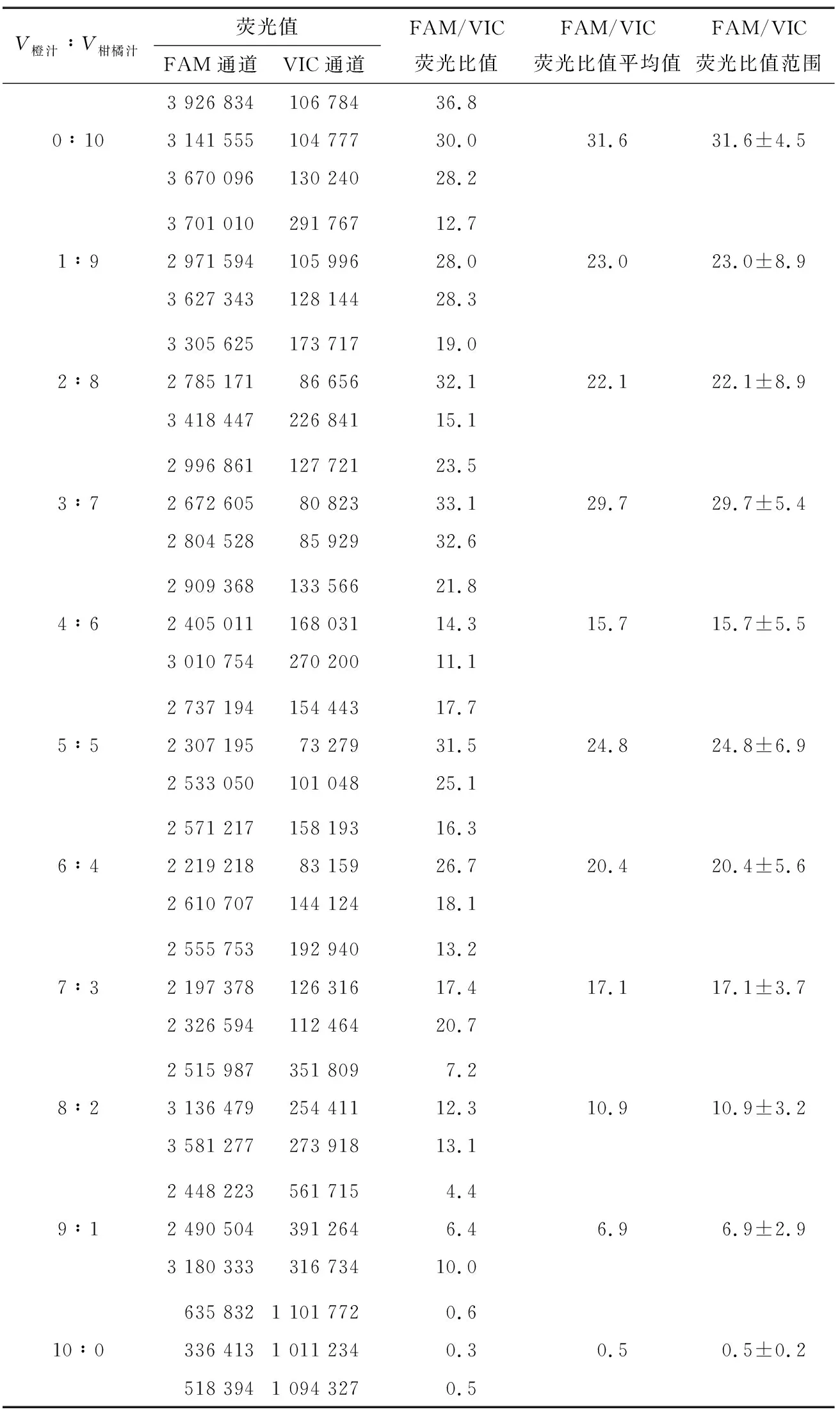
表9 不同比例橙汁柑橘汁掺杂试验结果
由图5及表9可知,橙汁中掺杂10%及以上比例的橘汁样品均有FAM通道荧光增强情况,且FAM/VIC通道荧光值比值>1,FAM通道荧光值并随着橘汁掺杂的比例增加而增大。说明R22引物和探针可以灵敏地检测到10%掺杂比例的橙橘样品。
2.5 市售饮料检测
对市售的13种橙汁饮料样品和其他非橙汁饮料进行DNA提取和荧光PCR扩增,结果见图6、图7和表10。

A. 砂糖橘 B. 新奇士 C. 橙汁饮料1 D. 橙汁饮料2 E. 橙汁饮料3 F. 橙汁饮料4 G. 都乐橙汁 H. 汇源橙汁 I. 良珍橙汁 J. dana橙子果汁饮料 K. 酷儿橙汁饮料 L. 美汁源果粒橙

A. 砂糖橘 B. 新奇士 C. 粒粒橙 D. 咸柑橘饮料1 E. 咸柑橘饮料2 F. 芒果混合汁饮料 G. 蓝莓汁饮料 H. 桑葚汁饮料
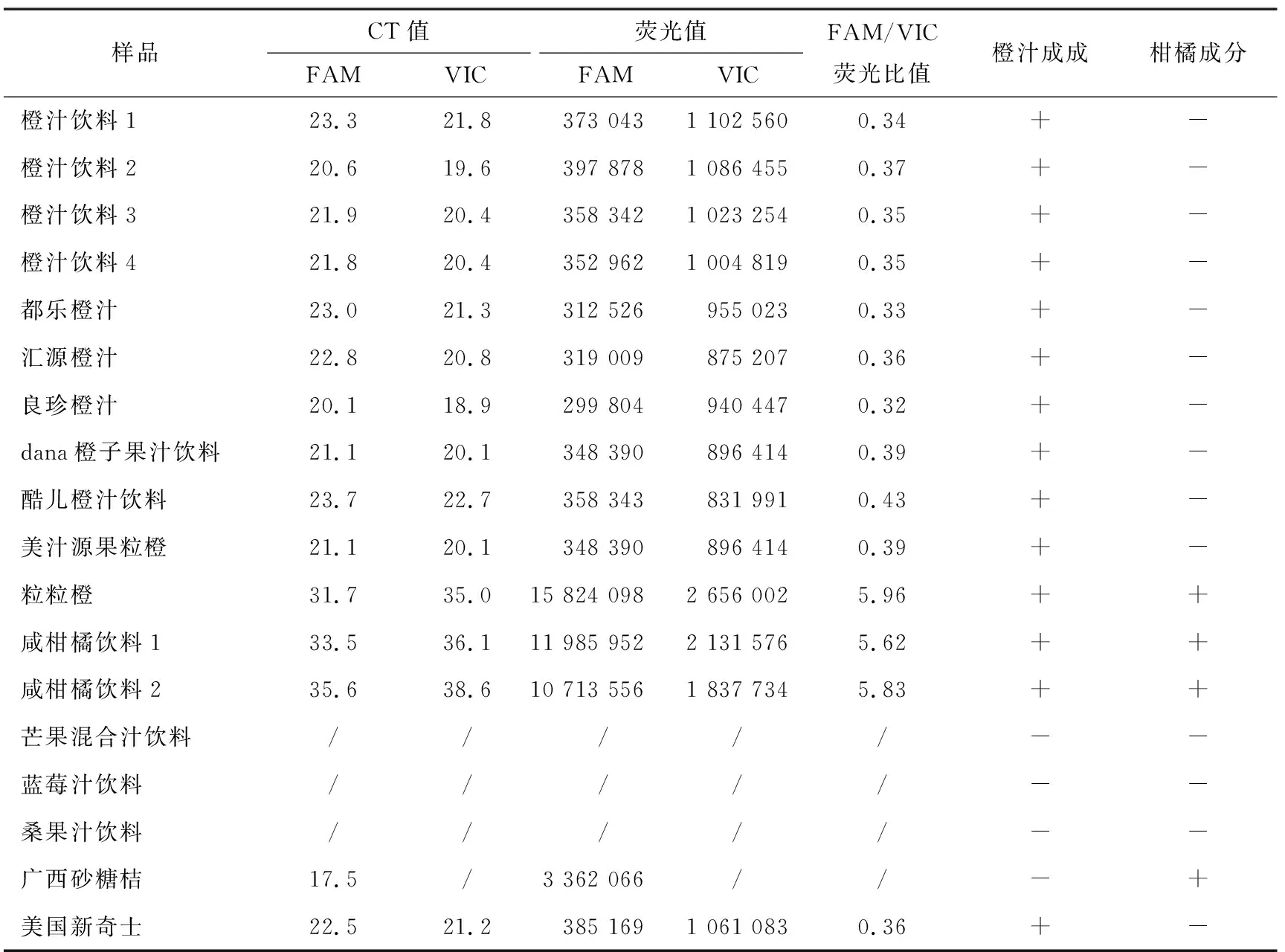
表10 橙汁饮料的荧光PCR扩增结果
由图6和表10可知,10种仅含有橙汁成分的饮料均产生与纯橙样品(新奇士)相同的荧光扩增曲线,FAM/VIC荧光比值在0.5±0.2的范围内,与纯橙样品的FAM/VIC荧光比值相符。由图7和表10可知,3种橙橘混合饮料均有FAM、VIC通道PCR荧光扩增曲线,FAM/VIC荧光比值>1,检测成分均与标签标明的成分信息一致;其他非橙汁饮料无荧光扩增现象。说明所建立的双重荧光定量PCR方法能够检测市售饮料中的橙和橘成分,适用于市售橙汁饮料的鉴伪。
3 结论
试验研究的双重实时荧光定量PCR法,在同一反应体系中,加入双引物和双探针,同时检测两个目的基因,实现一管多检,省时省力,大大提高了检验的时效性。该法使用通道荧光比值判断橙和橘成分,当FAM/VIC通道荧光比值在0.5±0.2的范围时,说明仅含有橙成分,FAM/VIC荧光比值>1,则含有橘成分。与其他检验方法或标准使用实时荧光定量PCR方法检验时利用CT值判断结果有所不同,打破了仅靠CT值判定结果的局限。
通过双重荧光定量PCR方法,在设定的R22引物和探针以及反应体系下,实现了柑橘属中橙和橘成分的区分。但试验对市售饮料的检验品种覆盖范围有限,仍需进一步筛选和优化引物、探针和反应体系,扩大饮料检验品种,进一步寻找特色的规律,建立果汁中单一植物源性成分的靶向精准鉴别技术,完善果蔬汁饮料鉴别的标准方法。
