外泌体微小RNA-23a对非小细胞肺癌血管生成的影响及机制研究
2021-09-22白峻峰支亚男王壮壮公孙鑫
崔 凯,白峻峰,支亚男,姜 琨,王壮壮,公孙鑫
(西安国际医学中心医院胸腔外科,陕西 西安 710100)
肺癌细胞的生长、浸润及转移受缺氧和肿瘤血管两个重要因素的调控[1-3]。血管内皮生长因子(VEGF)在肺癌等多种恶性肿瘤组织中异常表达[4-5],而miRNA参与了肿瘤血管生成的调节[6]。研究[7-9]表明,miR-23a通过外泌体的转移参与调控鼻咽癌相关的血管生成,进而促进转移;第10号染色体缺失性磷酸酶和张力蛋白同源物基因(PTEN)通过抑制下游磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)信号转导通路发挥抗肿瘤作用。目前肺癌组织中VEGF异常表达介导肿瘤血管生成的机制尚不明确。本研究拟探究外泌体miR-23a对NSCLC血管生成的影响,并分析其作用机制。
1 材料与方法
1.1 实验材料 H1299细胞购自中科院上海细胞库;酶联免疫吸附测定(ELISA)试剂盒购自英国Abcam公司;实时定量反转录PCR(qRT-PCR)试剂盒购自Takara公司;PTEN(No.9863464)、AKT(No.7645465)、磷酸化AKT(p-AKT,No.9863464)、VEGF(No.6754365)和甘油醛-3-磷酸脱氢酶(GAPDH)抗体(No.6545324)购自Abcam公司。
1.2 实验方法
1.2.1 免疫组化染色:对NSCLC患者癌组织及癌旁组织样本进行石蜡包埋、切片后脱蜡和水化。3% H2O2和0.01 mol/L枸橼酸钠盐溶液进行抗原修复。5% BSA封闭液室温封闭1 h,PTEN和VEGF一抗4 ℃孵育过夜。次日加二抗室温孵育,中性树胶封片[8]。
1.2.2 细胞培养及转染:完全培养液培养H1299细胞,6×105个细胞接种于6孔板。细胞转染阴性对照RNA(对照组)、miR-23a mimic(miR-23a mimic组)和miR-23a inhibitor(miR-23a inhibitor组) 8 h后换新鲜完全培养基于37 ℃、5% CO2条件下孵箱培养,分别于24、48 h后收集细胞及其上清。
1.2.3 ELISA实验:收集转染后细胞上清,采用ELISA试剂盒检测miR-23a过表达或抑制后H1299细胞中PTEN和VEGF的表达水平。
1.2.4 qRT-PCR检测RNA表达:TRIzol提取总RNA反转录获得总cDNA,反应严格按照Takara公司2×SYBR Premix Ex Taq II试剂盒进行操作。基因相对表达量根据2-ΔΔCT计算。qRT-PCR引物序列见表1。

表1 qRT-PCR引物序列
1.2.5 Western blot检测蛋白表达:在NSCLC患者癌组织及癌旁组织中加入RIPA裂解液提取总蛋白,随后加缓冲液,100 ℃煮5 min。紧接着进行SDS-PACE电泳分离蛋白,蛋白转膜至PVD膜,转膜条带脱脂牛奶封闭,清洗后孵育一抗(本研究所有抗体比例1∶1000),4 ℃冰箱过夜。次日孵育二抗,PBST缓冲液清洗,ECL化学发光检测蛋白表达。

2 结 果
2.1 癌组织与癌旁组织PTEN、VEGF表达比较 见图1。免疫组化结果显示,NSCLC患者癌组织中PTEN阳性表达明显低于癌旁组织,而VEGF的阳性表达明显高于癌旁组织(均P<0.05)。
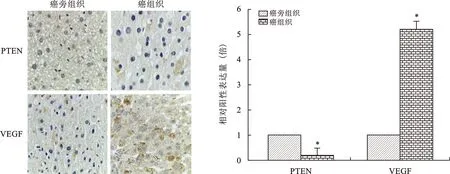
注:左图为癌组织与癌旁组织免疫组化染色结果(标尺=200 nm);右图中,与癌旁组织比较,*P<0.01
2.2 miR-23a过表达和敲减细胞系构建情况 见图2。与对照组相比,miR-23a mimic转染H1299细胞后miR-23a表达上调,转染miR-23a inhibitor以后miR-23a表达下降(均P<0.05),表明miR-23a过表达和敲减细胞系构建成功。
2.3 三组细胞PTEN和VEGF表达水平比较 见表2。ELISA结果显示,miR-23a过表达明显抑制H1299细胞PTEN表达,增强VEGF表达,而抑制miR-23a后结果相反(均P<0.05)。
表2 三组细胞PTEN和VEGF表达水平比较

注:与对照组比较,*P<0.01
2.4 miR-23a对PTEN、AKT和VEGF mRNA表达的影响 见图3。qRT-PCR结果显示,miR-23a过表达明显抑制H1299细胞PTEN mRNA表达,促进AKT和VEGF mRNA表达;抑制miR-23a可上调PTEN mRNA表达,抑制AKT和VEGF mRNA表达(均P<0.05)。
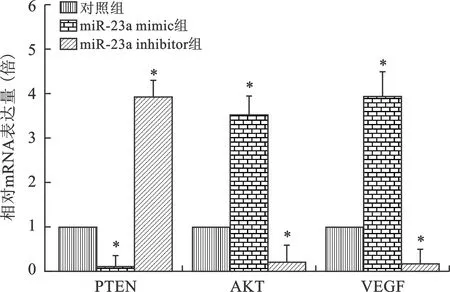
注:与对照组比较,*P<0.01
2.5 miR-23a对PTEN、AKT、p-AKT和VEGF蛋白表达的影响 见图4。Western blot结果显示,miR-23a过表达明显抑制H1299细胞PTEN蛋白表达,促进p-AKT和VEGF蛋白表达;抑制miR-23a可上调PTEN蛋白表达,抑制p-AKT和VEGF蛋白表达(均P<0.05)。

注:左图为各蛋白电泳图;右图中,与对照组比较,*P<0.05,#P<0.01
3 讨 论
2018年全球癌症统计数据显示肺癌位居癌症发病率和病死率首位[10]。目前,手术治疗仍然是NSCLC的唯一治疗方法,但患者术后生存率仍未明显改善。近年来,外泌体已经成为治疗多种疾病的有效药物和基因治疗转运体。外泌体是一类直径20~100 nm的细胞来源囊泡,能够影响血管生成、转移和其他生物细胞与肿瘤发生相关的属性表皮生长因子受体[11-12]。研究[13]发现,癌症细胞衍生的微环境能够通过外泌体miRNA促进NSCLC发生与发展,为揭示肿瘤发生机制和潜在新治疗靶点提供了理论依据。此外,遗传和表观遗传异常如miRNA和基因谱变化,已涉及多种恶性肿瘤发生。miRNAs是一类长度约19~25个核苷酸的非编码RNA小分子,在NSCLC中表达异常,其中部分与NSCLC的进展和预后有关[14]。
miRNA是基因表达的重要介质,通过与蛋白编码基因mRNA配对来引导其抑制。此外,miRNA参与调控炎症、细胞周期进展、应激反应、细胞分化和凋亡等细胞过程[15]。有研究[16-17]报道,miRNA通过调节胃癌细胞中癌基因或抑癌基因表达而影响胃癌的发生;miRNA在介导乳腺癌干细胞和膀胱癌上皮细胞-间充质细胞转换中发挥了关键作用。研究[18]发现,miR-23a/b可通过靶向PDCD4抑制前列腺癌细胞凋亡,进而促进肿瘤发生与发展,提示miR-23a/b具有致瘤作用。另外,miR-23a下调已被证明能够负调控肿瘤抑制因子和PTEN,而PTEN缺失又促进了肝癌细胞增殖及转移[19]。因此,我们推测外泌体miR-23a可能通过靶向PTEN参与NSCLC的发生。
NSCLC细胞来源的miRNA在肿瘤发生和转移过程中具有重要意义[20]。miRNAs在恶性肿瘤发生与发展过程中起重要的促进或抑制作用[21]。本研究中,PTEN在NSCLC患者癌组织中表达较癌旁组织明显降低,证实PTEN是miR-23a的靶点。PTEN被报道在多种恶性肿瘤中发挥重要的抑癌作用,其高表达能够显著抑制结直肠癌细胞增殖,降低细胞存活率[22]。PTEN缺失能够诱导宫颈癌的发生和发展[23]。此外,PTEN可被miR-718和miR-382协同靶向,进而抑制乳腺癌的血管生成和进展。因此,miR-23a可能通过负调控PTEN促进NSCLC血管生成和进展。
本研究发现,肺癌组织PTEN表达低于癌旁组织,而VEGF表达高于癌旁组织;miR-23a过表达明显抑制H1299细胞PTEN mRNA和蛋白表达,促进AKT、VEGF mRNA以及p-AKT和VEGF蛋白表达,而抑制miR-23a后结果相反。上述研究结果提示外泌体miR-23a可能通过靶向抑制PTEN促进VEGF表达,诱导NSCLC肿瘤血管生成,激活肺癌细胞的异常增殖和远端侵袭转移能力。
综上所述,NSCLC细胞来源的外泌体miR-23a能够诱导肿瘤血管生成,促进NSCLC的发展,其机制可能与靶向抑制PTEN有关。因此,靶向miR-23a有望为临床抗NSCLC治疗提供新思路和靶点。
