叉头框转录因子O亚族3a对结肠癌SW620细胞的影响及机制研究
2021-09-22高立勇
冯 婷,刘 霞,高立勇
(1.郑州大学护理学院病理教研室,河南 郑州 450052;2.徐州市第一人民医院病理科,江苏 徐州 221200)
最新发布的中国恶性肿瘤流行病学数据显示,大肠癌发病率位居第四,病死率排名第五。随着外科手术和化学疗法的不断改进,大肠癌的治疗也不断改善,但仍有大部分患者出现复发和转移。究其原因,外科手术及术后化疗主要针对大肠癌肿瘤病灶,而没有针对分裂、增殖能力和异质性分化更强的大肠癌干细胞。已有很多证据表明大肠癌是一种干细胞疾病,由正常大肠隐窝干细胞基因突变所致。近年来,肿瘤干细胞成为肿瘤治疗的研究热点。肿瘤干细胞是具有干细胞和肿瘤细胞双重特征,能够自我复制、多向分化的一种胞细,具有抵抗凋亡、致瘤及转移潜能[1-2]。研究证明叉头框转录因子O亚族(Forkhead box transcription factor O,FOXO)在造血干细胞长期维持中起着关键作用。因此,本研究探讨FOXO3a对人结肠癌SW620细胞的影响并分析其机制。
1 材料与方法
1.1 实验材料 人结肠癌SW620细胞由徐州医科大学病理实验室馈赠;RPMI-1640培养基、胰蛋白酶消化液、二甲基亚砜(DMSO)、Lipofecte脂质体转染试剂、TRIzol试剂、cDNA第一链合成试剂盒、兔抗人FOXO3a单克隆抗体(批号:19121094)、兔抗人OCT4抗体(批号:19101875)和兔抗人CD133抗体(批号:19023654)均购自北京中杉公司;OPTI-MEN转染液购自罗氏公司;引物、FOXO3a过表达载体(P-EGFP-FOXO3a)及对照载体(P-EGFP)由上海生工构建。
1.2 实验方法
1.2.1 人结肠癌SW620细胞培养及转染:人结肠癌SW620细胞放置于37 ℃、5% CO2孵育箱中培养。培养条件:细胞置于富含10%胎牛血清、青霉素100 U/ml、链霉素100 U/ml 的RPMI-1640培养液中。实验分成对照组、空白载体组、载体组三组。各组细胞按照每孔6×105/ml接种于六孔板,使每孔细胞饱和度在转染前达到60%~70%,依照转染试剂说明书分别转染P-EGFP和P-EGFP-FOXO3a。
1.2.2 细胞生长抑制率测定(MTT法):先用0.05%胰蛋白酶处理结肠癌SW620细胞,制成5×104/ml的细胞悬液后接种在24孔板中,每组设6个复孔。先在恒温培养箱中培养48 h,再在各组细胞中加入20 μl MTT(5 mg/ ml)继续孵育4 h后取出,在室温下静置5 min,吸去上清后每孔再加入150 μl DMSO,轻微摇床振荡10 min使之充分溶解。在酶标仪波长570 nm 下比色测定OD值并计算抑制率。生长抑制率(%)=(1-实验孔平均OD值/对照孔平均OD值)×100%。
1.2.3 转染后FOXO3a、CD133、八聚体结合转录因子4(OCT4)蛋白阳性表达检测:将预处理好的盖玻片置入24孔板,接种SW620细胞(6×104/孔),培养细胞密度约30%~50%时转染P-EGFP-FOXO3a,孵育48 h后弃液,细胞玻片用PBS 洗涤3 min×3次,4%多聚甲醛固定30 min后用中性树胶将其封于载玻片上。按照免疫组化试剂盒说明书严格质控操作,设置对照组(以PBS代替一抗)。FOXO3a蛋白阳性表达定位在胞核/质上,显示为棕褐色或棕黄色颗粒。随机选取高倍镜下5~10个视野观察(每个视野细胞数>100个),按阳性细胞所占百分比进行评价。
1.2.4 反转录-聚合酶链反应(RT-PCR)检测FOXO3a、CD133、OCT4 mRNA表达:TRIzol法提取各组细胞转染总的RNA。紫外分光光度计下计算RNA纯度及含量,以Oligo(dT)为引物,以1.5 μg总RNA 为模板合成cDNA。再以cDNA为模板,以β-actin为内参照进行PCR扩增反应。FOXO3a正向引物序列为5’-AGGGAAGTTTGGTCAATCAGAA-3’,反向引物序列为5’-TGGAGATGAGGGAATCAAA-GTT-3’,产物大小369 bp;CD133正向引物序列为5’- CGGGATCCGAAAAACTGATCTGT-3’,反向引物序列为5’-GAACC CCGCTCGAGTTACCTAGT-TACTCTCTCC-3’,产物大小615 bp;OCT4正向引物序列为5’-TCTCCAATTACATTCCCACCA-3’, 反向引物序列为5’-CAGGGACTCAGAACACAGGAG-3’,产物大小381 bp;β-actin正向引物序列为5’-AAATCTGGCACCACACCTT-3’, 反向引物序列为5’-TAGCACAGCCTGGATAGCAA-3’,产物大小189 bp。PCR扩增条件:95 ℃预变性30 s;65 ℃ 30 s,退火FOXO3a 65 ℃ 35 s,CD133 60 ℃ 40s,OCT4 60 ℃ 45 s,72 ℃延伸3 min,共30个循环。取10 μl PCR产物在1%琼脂糖凝胶电泳跑胶后拍照记录结果,分析靶基因与相应β-actin mRNA条带灰度值,实验重复3次后取平均值。
1.2.5 Western blot检测FOXO3a、CD133、OCT4蛋白表达:分别转染P-EGFP和P-EGFP-FOXO3a 48 h后提取各组总蛋白,“三明治法”将其转移至PVDF膜上,加入稀释好的一抗4 ℃孵育过夜(稀释比例:FOXO3a 1∶500,CD133 1∶200,OCT4 1∶200)。次日TBS缓冲液洗膜10 min×3次,加入辣根过氧化物酶标记的二抗(1∶500稀释)后曝光显影。采用Gel-Doc图像分析软件测定条带灰度值,分析FOXO3a、CD133、OCT4蛋白与内参蛋白光密度值,比较各蛋白表达变化。
1.2.6 细胞迁移侵袭实验(Transwell法):将三组细胞经胰酶消化后,以每组约105个细胞种在Transwell小室上层,48 h后PBS淋洗,再用棉签轻拭去表层未迁移的细胞,收集迁移至滤膜下层的细胞,经甲醇固定、HE染色后,于倒置显微镜下(10个视野,×200)计数滤膜下层细胞数来评估穿膜细胞。
1.3 统计学方法 采用SPSS 19.0统计学软件进行分析。计量资料以均数±标准差表示,组间比较采用单因素方差分析。对方差分析有统计学差异的资料,进一步采用REGWQ法进行多组均数间两两比较。以α=0.05为检验水准。
2 结 果
2.1 三组细胞生长抑制率比较 载体组细胞生长抑制率为(26.79±0.64)%,对照组和空白载体组细胞生长抑制率分别为(7.11±3.04)%和(8.10±0.26)%,载体组SW620细胞生长抑制率明显高于对照组和空白载体组(t=2.891、2.990,均P<0.05)。
2.2 三组细胞转染后FOXO3a、CD133、OCT4蛋白表达阳性率比较 见表1(图1)。与对照组和空白载体组相比,载体组FOXO3a蛋白表达阳性率增加,CD133和OCT4蛋白表达阳性率下降(均P<0.05)。
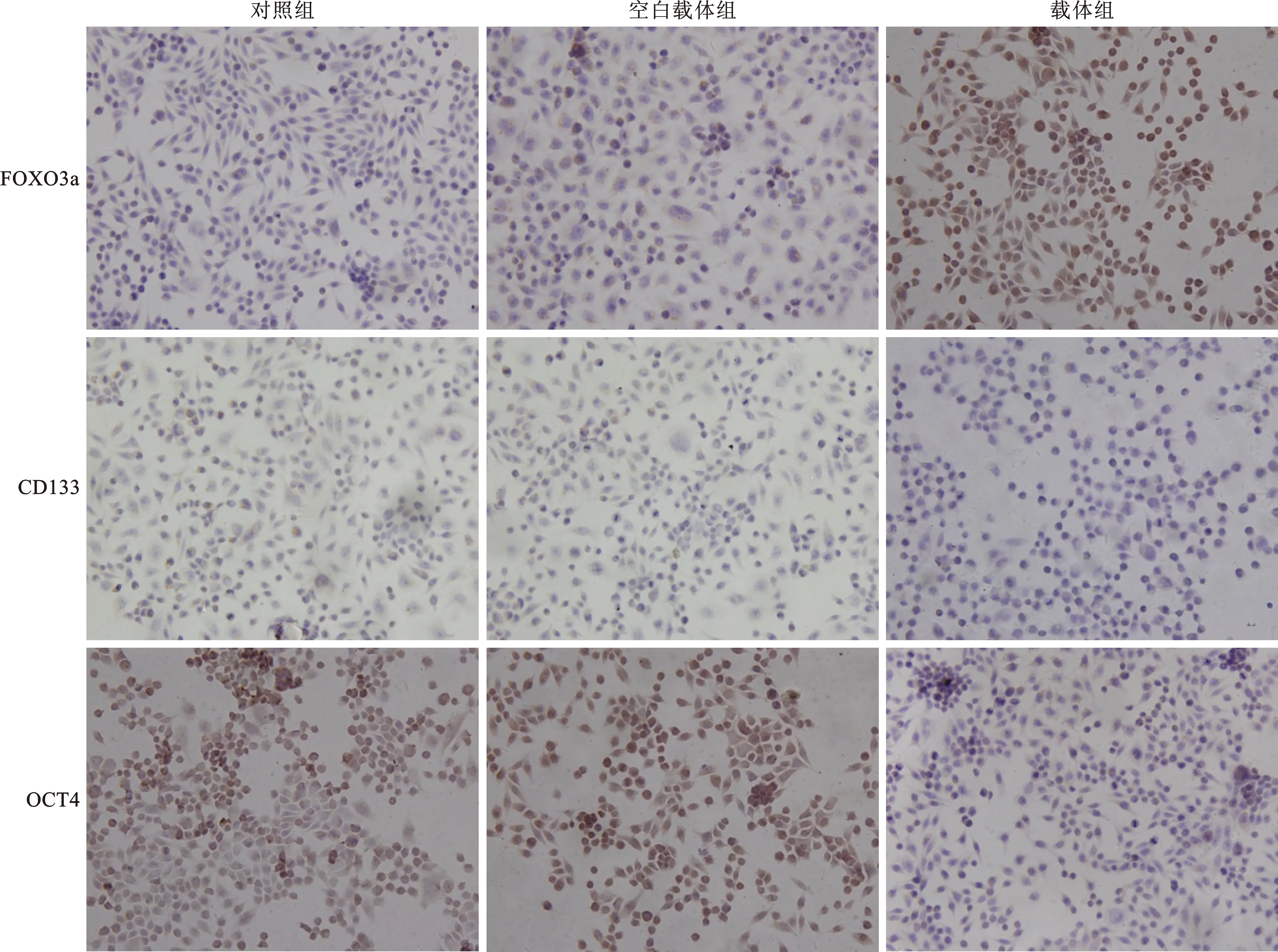
图1 SW620细胞转染后FOXO3a、CD133、OCT4蛋白表达情况(免疫组化染色,×200)
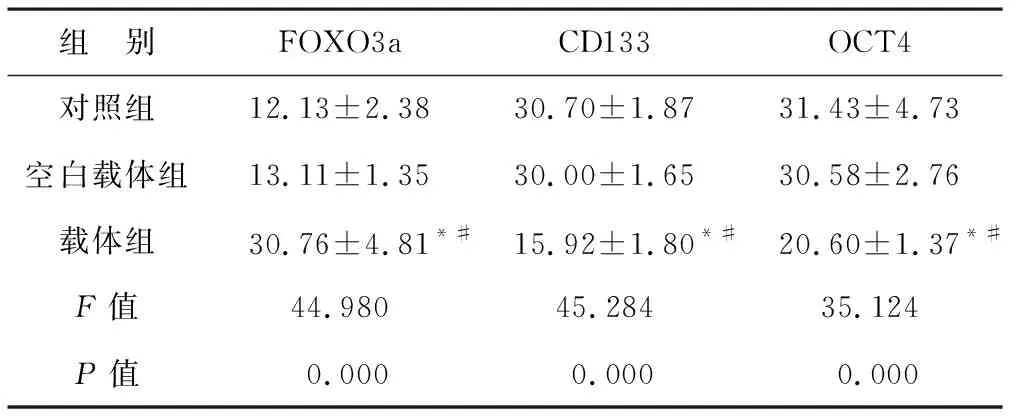
表1 三组细胞转染后FOXO3a、CD133、OCT4蛋白表达阳性率比较(%)
2.3 三组细胞FOXO3a、CD133、OCT4 mRNA相对表达水平比较 见表2。FOXO3a(369 bp)、β-actin(189 bp)、CD133(615 bp)、β-actin(189 bp)和OCT4(381 bp)、β-actin(189 bp)扩增产物在电泳后扩增片段大小与设计大小均显示一致。与对照组与空白载体组比较,载体组FOXO3a mRNA相对表达水平明显提高,CD133、OCT4 mRNA相对表达水平下降明显(均P<0.05)。对照组与空白载体组FOXO3a、CD133、OCT4 mRNA相对表达水平比较差异无统计学意义(均P>0.05)。
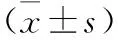
表2 三组细胞FOXO3a、CD133、OCT4 mRNA相对表达水平比较
2.4 三组细胞FOXO3a、CD133、OCT4蛋白相对表达水平比较 见表3。与对照组和空白载体组相比,载体组FOXO3a蛋白相对表达水平明显提高(P<0.05),CD133、OCT4 蛋白相对表达水平则显著降低(均P<0.05)。对照组和空白载体组FOXO3a、CD133、OCT4蛋白相对表达水平比较差异无统计学意义(均P>0.05)。
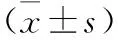
表3 三组细胞FOXO3a、CD133、OCT4蛋白相对表达水平比较
2.5 三组细胞迁移侵袭能力比较 载体组细胞穿膜数为(7.270±0.650)个,对照组与空白载体组细胞穿膜数分别为(12.810±1.646)个和(12.001±1.775)个。与对照组和空白载体组相比,载体组细胞穿膜数显著降低(均P<0.05)。对照组与空白载体组细胞穿膜数比较差异无统计学意义(P>0.05)。
3 讨 论
大肠癌在全球范围内均是消化道常见恶性肿瘤之一[3-4]。近年来,国内外对大肠癌的发病机制及治疗做了很多研究,认为肿瘤干细胞与正常干细胞相似,并且是肿瘤发生、增殖、转移和复发的根源。大肠癌肿瘤细胞起源于大肠隐窝干细胞,也是一种干细胞启动的疾病,基因突变和异常增殖是其发生的原始因素。相继报道的肿瘤干细胞标记物为重新认识肿瘤起源、性质以及为肿瘤干细胞鉴别和癌症靶向治疗等提供了一个新的方向和视角。
CD133是一种五次跨膜糖蛋白,在正常组织中和肿瘤中均有表达,被公认为结直肠癌中常见的肿瘤干细胞标记物,表达水平高低影响肿瘤预后,已在结肠、脑、前列腺等肿瘤被鉴别出来[5-7]。研究表明大肠癌细胞只存在于CD133+癌细胞中,且每262个CD133+癌细胞中就有1个大肠癌干细胞存在,能在NOD/SCID小鼠模型上种植并长出肿瘤,且具有转移能力[8-12]。
OCT4也被证明是胚胎干细胞、生殖细胞的标记物,已在成体组织中发现OCT4 表达阳性的细胞。它也是第一个被发现只在全能和多能细胞中表达的转录因子,不但参与胚胎干细胞和原始生殖细胞的自我更新,维持细胞全能性,还能直接控制胚胎干细胞分化方向[13-14]。成体组织中表达OCT4的细胞主要局限在具有干细胞特性的细胞中,如皮肤基底细胞层中的细胞以及胃、肝、乳腺干细胞等。OCT4是癌症干细胞样细胞亚群,能够导致肿瘤耐药和复发,是潜在的癌症治疗靶点[15]。研究发现将OCT4基因导入大肠癌细胞后,可使肿瘤细胞恶性转化加速,其表达水平高低与肿瘤细胞恶性程度有关,高表达能提高肿瘤恶性程度,而失活或低表达能使肿瘤恶性程度得到遏制。可见OCT4能够调控肿瘤的进展、侵袭行为和转移能力。FOX基因编码产物称为FOX蛋白家族,FOXO3a是FOX家族O亚族的核心,参与调节其他成员的基因表达,该家族成员都有一长约110个氨基酸的高度保守的DNA结合域(即FOX结构域),在细胞增殖、凋亡、分化、应激及内环境稳态等细胞生命过程中发挥重要作用[16-20]。已有研究证实,FOXO3a在多种肿瘤中呈低表达,但在调控肿瘤发生、增殖、迁移、侵袭等方面扮演重要角色,且影响着肿瘤的预后。
本研究前期实验发现大肠癌中FOXO3a也呈低表达。我们通过转染FOXO3a过表达载体作用于大肠癌SW620细胞观察FOXO3a、CD133、OCT4 mRNA和蛋白相对表达水平的变化。本实验结果表明,转染FOXO3a过表达载体可有效提高FOXO3a基因的表达,能够抑制大肠癌SW620细胞增殖,RT-PCR、Western blot检测结果提示载体组干细胞因子CD133和OCT4 mRNA和蛋白相对表达水平均显著降低,证实FOXO3a表达变化会引起干细胞因子的变化。迁移侵袭实验结果显示,与对照组和空白载体组相比,载体组细胞穿膜数明显降低,表明大肠癌SW620细胞迁移侵袭能力明显减弱,进而验证了FOXO3a能对大肠癌干细胞产生杀伤作用。
综上所述,FOXO3a可抑制SW620细胞增殖,减弱其迁移侵袭能力,其机制可能与降低CD133、OCT4表达有关。目前临床应用的抗肿瘤药物比较丰富,如果将P-EGFP-FOXO3a联合其他抗肿瘤药协同治疗大肠癌,可能会有更好的疗效。
