HIF-1α/EphrinA1信号通路在糖尿病因素削弱七氟醚心肌保护中的作用机制
2021-09-22贺建东韩冲芳杨文曲
张 佩,贺建东,韩冲芳,杨文曲,邓 捷
(1山西医科大学麻醉学院麻醉教研室,太原 030001;2山西医学科学院,山西白求恩医院麻醉科;*通讯作者,E-mail:597787162@qq.com)
心血管疾病是严重危害人类健康的疾病之一,而糖尿病是其独立危险因素[1]。七氟醚后处理已被证明能在急性心肌缺血再灌注损伤(myocardial ischemia/reperfusion injury,MI/RI)中起到心肌保护作用,然而这种保护作用在糖尿病合并MIRI时被削弱甚至消失。Xie等[2]研究发现:七氟醚后处理对糖尿病大鼠心肌保护作用消失可能与低氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)的信号传导通路受损有关,具体机制有待进一步研究。HIF-1α是心肌细胞监测和适应缺氧环境的关键调节因子。而保持心肌细胞超微结构和线粒体的网状结构被认为是心肌细胞耐受缺氧的主要原因[3]。EphrinA1是HIF-1α下游的调节因子之一。Torres等[4]的研究发现:心内注射EphrinA1可以通过稳定心肌细胞线粒体时空组织来减少心梗面积和心肌细胞的损伤。先前的研究报道了HIF-1α/EphrinA1信号传导通路在肺缺血再灌注损伤中的保护作用[5],在心肌缺血再灌注损伤中该信号通路研究较少。本文拟探讨七氟醚的心肌保护作用在糖尿病合并心肌缺血再灌注损伤大鼠模型中消失是否与糖尿病因素抑制HIF-1α/EphrinA1信号传导通路有关。
1 材料与方法
1.1 实验动物选择
健康成年雄性SD大鼠,体质量210-260 g,由山西医科大学实验动物中心提供,适应性喂养1周。
1.2 糖尿病模型和心肌缺血再灌注模型的制备
依据参考文献[6]制备2型糖尿病大鼠模型:在做实验前禁食12 h,在空腹状态下腹腔注射链脲佐菌素50 mg/kg。于72 h后取大鼠尾静脉血样测定血糖浓度≥16.7 mmol/L,然后持续高脂高糖喂养8周。血糖水平持续升高8周,且出现多饮多食多尿、体质量减轻为2型糖尿病模型制备成功。
取糖尿病模型制备成功的60只大鼠,采用随机数字表法,将其分为5组(n=12):假手术组(sham组)、心肌缺血再灌注(myocardial ischemia/reperfusion injury,I/R)组、七氟烷后处理组(SP组)、HIF-1α激活剂DMOG组(DMOG组)、HIF-1α激活剂DMOG加七氟醚后处理组(DMOG+SP组),随后进行心肌缺血再灌注损伤模型的建立。
依据参考文献[7]制备心肌缺血再灌注损伤模型:腹腔注射25%乌拉坦0.4 ml/100 g进行麻醉,待翻正反射消失后,将大鼠四肢固定于手术台,连接生物机能实验系统,监测大鼠的Ⅱ导联心电图,颈部前正中切口暴露气管进行插管,连接小动物呼吸机进行机械通气。呼吸参数:潮气量6-8 ml/kg,通气频率60次/min,呼吸比1 ∶1,呼吸机进气口连接氧气和七氟醚挥发罐。于胸骨左侧四五肋间(心尖搏动最强处)开胸,暴露心脏,剪开心包膜,于左心耳下3 mm的地方用6-0丝线穿过左冠脉前降支,将自制小管穿过丝线,用止血钳推压小管阻塞冠脉造成缺血。造模成功标志:结扎线以下区域发白,室壁运动减弱。心电图示:ST段抬高,T波高耸。缺血30 min后,松开结扎线缺血区变得红润,室壁运动逐渐加强,ST段下降明显,为再灌注成功。sham组只穿线不结扎,SP组和DMOG+SP组参考文献[2]在再灌注的前5 min吸入2.5%的七氟醚持续15 min,DMOG组和DMOG+SP组参考文献[8]在手术前24 h腹腔注射DMOG 40 mg/kg。
1.3 实验方法
于再灌注120 min时,取下心肌组织,采取抽签法每组抽取4只大鼠心肌标本,采用TTC染色法测定心肌梗死面积;剩余8只大鼠取结扎线以下的心肌组织分为两部分:一部分制成石蜡切片用于HE染色观察心肌病理学损伤和免疫荧光共定位观察HIF-1α和EphrinA1的位置关系,一部分采用Western blot法测量心肌组织中HIF-1α和EphrinA1的蛋白含量。
1.3.1 TTC染色测量心肌梗死面积 于再灌注120 min时,取下心肌组织,用冷PBS缓冲液漂洗干净血渍,置于-20 ℃冰箱中冰冻30 min。在结扎线以下到心尖部的位置将心脏水平切成5-6片,放入六孔板中。注入1%TTC染液,37 ℃避光孵育30 min,然后将标本浸泡于4%多聚甲醛中固定72 h,拍照并用Image-pro plus计算各部分的面积,梗死范围以梗死面积占左心室面积的百分比表示。
1.3.2 HE染色观察心肌病理学损伤 于再灌注120 min时,取下心肌组织于4%多聚甲醛中固定24 h,经过酒精脱水,二甲苯透化,石蜡浸蜡包埋,制成石蜡切片。切片机连续切片,用二甲苯和无水乙醇依次脱蜡水化,苏木精和伊红染色,中性树脂封片。在光学显微镜下,观察心肌细胞病理学结果并拍照。
1.3.3 免疫荧光共定位观察HIF-1α和EphrinA1的位置关系 另取部分石蜡切片,常规脱蜡水化,将切片置于EDTA抗原修复液中,在微波炉上进行抗原修复。然后用山羊血清封闭液进行封闭。滴加HIF-1α和EphrinA1两个特异性一抗,4 ℃孵育过夜。冲洗再滴加DyLight 594荧光素标记羊抗小鼠和DyLight 488荧光素标记羊抗兔IgG混合二抗,37 ℃孵育45 min。滴加DAPI染色液,室温孵育3 min。封片。荧光显微镜观察结果及拍照。
1.3.4 Western blot法测量HIF-1α和EphrinA1的蛋白含量 取左心室前壁缺血区组织,常规提取心肌组织蛋白,BCA法测量蛋白浓度。加入5×SDS上样缓冲液煮沸10 min。以10%分离胶和5%浓缩胶电泳分离蛋白,转移到PVDF膜,5%脱脂奶粉室温封闭2 h,加入一抗,4 ℃过夜后将膜取出,用TBST洗3遍,每次10 min。加入二抗,室温下孵育2 h,然后用TBST洗3遍,每次10 min。用化学发光检测试剂盒孵育,曝光,显影,定影。扫描测定条灰度值,以目的蛋白条带灰度值与GAPDH条带灰度值的比值反映其表达水平。
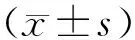
2 结果
2.1 大鼠心肌梗死面积比较
与sham组相比,其他组大鼠心肌梗死面积均有不同程度的扩大(P<0.05);与I/R组相比,DMOG组和DMOG+SP组心肌梗死面积缩小(P<0.05),SP组无明显差异(P>0.05);与DMOG组相比,DMOG+SP组心肌梗死面积进一步缩小(P<0.05,见图1)。

与sham组比,*P<0.05;与I/R组相比,#P<0.05;与DMOG组相比,△P<0.05图1 各组心肌梗死面积百分比Figure 1 Percentage of myocardial infarction area in each group
2.2 心肌HE染色结果
sham组心肌组织结构完整,肌节排列整齐,细胞质染色均匀,细胞核完整(见图2)。其余四组均有不同程度的损伤:I/R组和SP组损伤较为严重,心肌纤维结构疏松紊乱,细胞质颜色变浅,心肌细胞水肿;DMOG组和DMOG+SP组损伤较I/R组和SP组轻,其中DMOG+SP组损伤最小(见图2)。

图2 各组心肌组织病理学染色 (HE,×400)Figure 2 Histopathological staining of myocardium in each group (HE,×400)
2.3 HIF-1α和EphrinA1的免疫荧光共定位结果
HIF-1α和EphrinA1均定位于细胞质上(见图3)。HIF-1α被染成绿色,EphrinA1被染成红色,细胞核被染成蓝色。HIF-1α和EphrinA1重叠的区域被染成橘红色,根据橘红色荧光可认为HIF-1α和EphrinA1在细胞质中存在共定位,二者之间可能发生相互作用(见图3)。
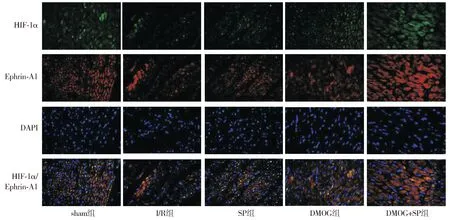
图3 HIF-1α和EphrinA1的免疫荧光共定位结果Figure 3 Immunofluorescence co-localization of HIF-1α and EphrinA1
2.4 心肌细胞HIF-1α,EphrinA1表达量的结果
与sham组相比,I/R组、SP组和DMOG组HIF-1α,EphrinA1表达量减少(P<0.05);DMOG+SP组EphrinA1表达量减少(P<0.05),HIF-1α表达量接近sham组(见图4)。与I/R组相比,DMOG组和DMOG+SP组HIF-1α和EphrinA1表达量增多(P<0.05,见图4)。与DMOG组相比,DMOG+SP组HIF-1α,EphrinA1表达量进一步增加(P<0.05,见图4)。与I/R组相比,SP组上述指标没有显著差异(P>0.05,见图4)。
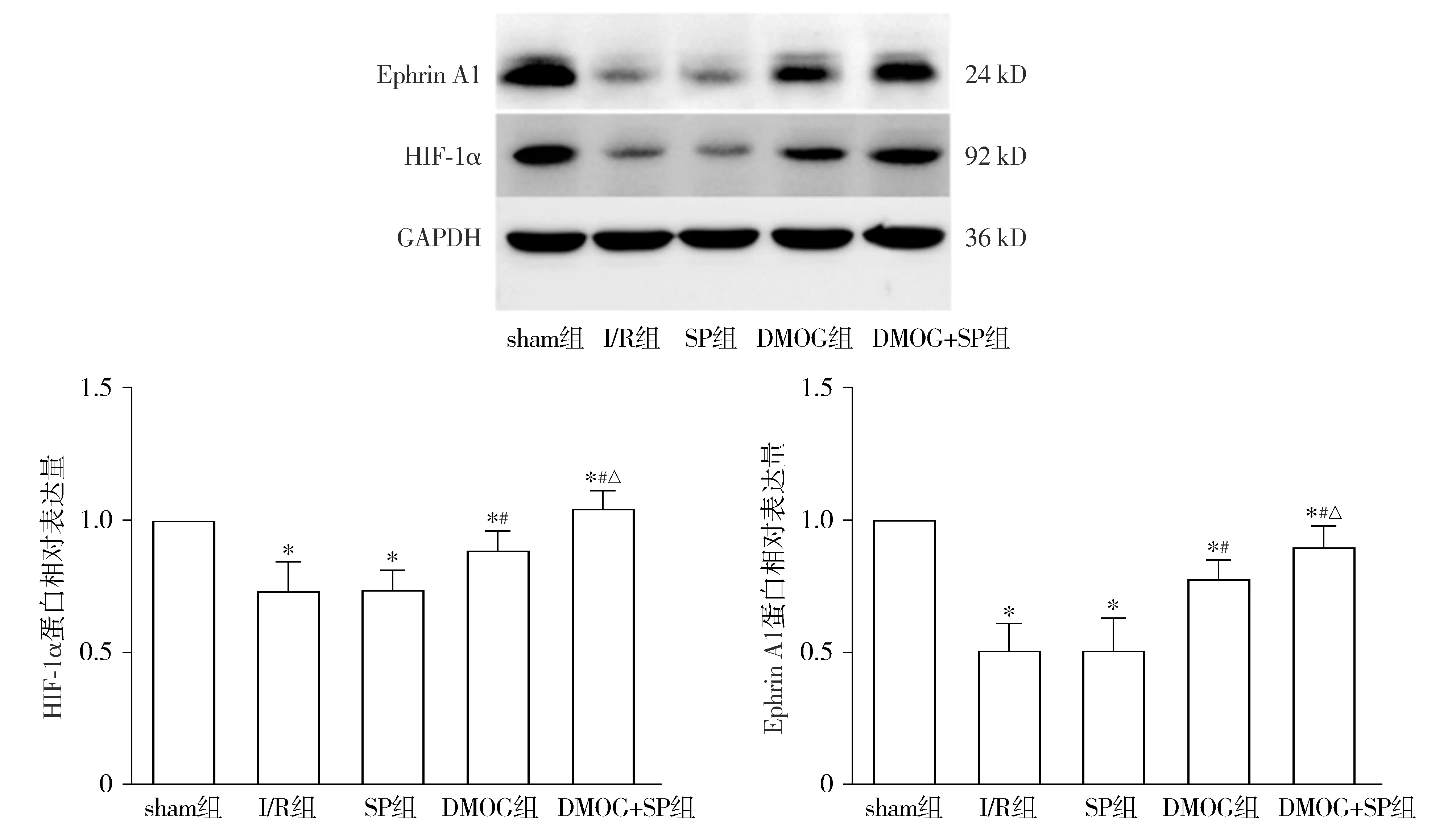
与sham组比,*P<0.05;与I/R组相比,#P<0.05;与DMOG组相比,△P<0.05图4 Western blot法检测HIF-1α和EphrinA1在心肌组织中的表达Figure 4 Expression of HIF-1α and EphrinA1 in myocardial tissue by Western blot
3 讨论
腹腔注射链脲佐菌素可以破坏部分胰岛β细胞,造成胰岛素来源减少;高能量物质喂养可造成胰岛素利用率下降。以上两种措施联合可有效模拟2型糖尿病模型的病理生理过程,是经典的制备2型糖尿病模型的方法[6]。大鼠出现随机血糖水平≥16.7 mmol/L,饮食、饮水、尿量增多,毛发干枯发黄,消瘦状态,提示造模制备成功。结扎心脏左冠脉前降支30 min,再灌注120 min是实验中广泛应用的制备急性MI/RI模型的方法[7]。本研究结果显示:与sham组相比,I/R组心肌结构紊乱,病理学损伤加重,心肌梗死面积增大,提示MI/RI模型制备成功。
HIF-1α是缺血缺氧环境中重要的信号传递分子[9],其通过调控下游的1 000多种调节因子的表达,来维持细胞内氧的供需平衡和葡萄糖代谢的正常运转,尤其是可以调控心肌细胞、心肌纤维细胞、血管内皮细胞、血管平滑肌细胞中相关因子的表达[10]。Yang等[11]的研究发现:在健康大鼠MI/RI时,HIF-1α可以减少线粒体自由基的产生,保持线粒体酶的活性,维持线粒体结构和功能的完整性来减少心肌损伤,七氟醚通过上调HIF-1α的表达发挥心脏保护作用,然而这一现象在合并糖尿病时消失。本实验结果显示:与I/R组比较,SP组HIF-1α、心肌梗死面积、心肌病理损伤无显著差异(P<0.05),提示糖尿病因素使七氟醚上调HIF-1α表达的能力消失,同时七氟醚的心肌保护作用消失,与其结果一致。
EphrinA1是HIF-1α下游的调节因子之一。当心肌细胞缺氧时会激活HIF-1α,其通过嵌合到缺氧反应原件(hypoxia response elements,HRE)的核心DNA序列上就会激活下游的EphrinA1基因的转录,从而使EphrinA1蛋白表达增加。EphrinA1是一种心肌细胞中表达的膜结合受体络氨酸激酶配体[6],其可通过控制α-微管蛋白的磷酸化来保护心肌细胞的骨架结构和线粒体的网状结构,从而减少了心肌梗死面积,炎症反应和细胞凋亡指数[12]。DuSablon等[13]的研究发现:HIF1α/EphrinA1信号通路在MI/RI中通过减少各种有毒物质的产生,增加糖酵解维持能量供应,保持组织结构的完整性,促进胞浆内各种物质转运分子的转运,稳定线粒体功能,改善缺血期心肌细胞的生存和代谢效率,从而减少心脏的损伤[6]。
本实验结果显示:在免疫荧光共定位中,HIF-1α与EphrinA1主要分布于细胞质中且两者存在重叠部分;在Western blot中,与I/R组相比,DMOG组HIF-1α蛋白表达量增加(P<0.05),EphrinA1蛋白表达量也出现了相应的增加(P<0.05)。说明HIF-1α与EphrinA1可能存在相互作用,且HIF-1α可能对EphrinA1蛋白起正向调控作用。在糖尿病合并MI/RI时,HIF-1α和EphrinA1蛋白含量在不同组间差异表达(P<0.05);I/R组与SP组比较,HIF-1α和EphrinA1蛋白含量差异无统计学意义(P>0.05);提示HIF-1α/EphrinA1信号传导通路可能参与糖尿病大鼠MI/RI的过程,但是糖尿病因素使七氟醚未能激活该保护通路,不能发挥心脏保护作用。
DMOG是特异性HIF-1α激活剂。在氧气正常情况下,脯氨酸羟化酶会使HIF-1α蛋白上的脯氨酸残基羟基化,同时HIF-1α的N端的氧依赖降解结构域与pVHL蛋白结合,招募多种泛素蛋白,共同组成泛素连接蛋白酶复合体,作用于HIF-1α使其降解。而DMOG是一种脯氨酸羟化酶抑制剂,通过抑制HIF-1α的降解来增强HIF-1α的含量和活性。本研究中DMOG的给药方法参照Warbrick等[8]的实验给药剂量和给药时间点。Zhang等[14]的研究发现:糖尿病因素使七氟醚上调HIF-1α表达的作用减弱,通过增强HIF-1α的表达,可恢复七氟醚的心肌保护作用,具体机制尚不清楚。本实验结果显示:与I/R组比较,SP组HIF-1α、EphrinA1、心肌梗死面积、心肌病理损伤无显著差异(P<0.05),提示糖尿病因素使七氟醚的心肌保护作用消失,与其结果一致。在加入DMOG后,与I/R组和SP组相比,DMOG组和DMOG+SP组HIF-1α、EphrinA1表达量均升高,心肌梗死面积减少,心肌病理损伤程度减轻。且DMOG+SP组受损程度小于DMOG组(P<0.05),说明七氟醚的保护作用有所恢复。提示:在糖尿病合并MI/RI中,七氟醚的心肌保护作用消失可能与糖尿病因素抑制HIF-1α/EphrinA1信号传导通路有关。
本实验不足之处:本实验未设置抑制剂组或基因敲除作对照,后期实验应进一步研究,以更好的验证本实验结果。
综上所述,七氟醚的心脏保护作用消失可能与糖尿病因素抑制HIF-1α/EphrinA1信号保护通路有关。
