miR-4778-3p在胃癌组织中的表达及对胃癌MGC803细胞增殖的影响
2021-09-22蒋志勇李奎生吕志武黄明沂
吴 菁,蒋志勇,李奎生,刘 芳,吕志武,黄明沂,肖 瑶
(1深圳市宝安区福永人民医院消化内科,深圳 518103;2武汉大学中南医院影像科;3南方医科大学附属深圳宝安医院消化内科;*通讯作者,E-mail:drjinjie@126.com)
胃癌是人类消化系统最常见的恶性肿瘤,发病率不断上升[1]。很多胃癌患者在首次确诊时已位于晚期,失去手术治疗机会,5年生存率很低[2]。探求胃癌的发病机制及新的治疗策略是目前胃癌研究领域的热点。微小RNA(microRNA,miRNA)是一类内源性非编码RNA,在真核细胞中高度保守[3]。miRNA可通过调节关键基因表达,影响细胞的分化、增殖和发育[4]。据报道,胃癌组织中存在多个miRNA异常表达,其在胃癌的发生和发展过程发挥重要作用[5,6]。Zhang等[7]研究发现,miR-4778-3p在复发或转移的宫颈癌患者组织中呈低表达,抑制宫颈癌细胞的恶性生物学行为。miR-4778-3p在胃癌组织中的表达及对胃癌细胞增殖的影响尚不清楚。本研究旨在检测miR-4778-3p在胃癌组织中的表达,通过体外实验探讨miR-4778-3p对胃癌细胞增殖和细胞周期的影响及作用机制。
1 材料与方法
1.1 组织标本
选取2018年7月至2020年12月间本院胃肠外科行手术切除的38例胃癌组织及癌旁组织(距肿瘤边缘>5 cm)。男性25例,女性13例,年龄51.76±8.96岁。病灶直径<5 cm 12例,病灶直径≥5 cm 26例。Ⅰ期4例,Ⅱ期6例,Ⅲ期28例。淋巴结转移21例,无淋巴结转移17例。所有患者术前均未接受放疗或化疗。本研究经本院伦理委员会批准,所有患者均签署知情同意书。
1.2 细胞株与主要试剂
胃癌MGC803细胞购于中国科学院上海生科院细胞资源中心,收集对数生长期细胞用于实验;miR-4778-3p mimic、miR-NC、SMC4-Wt野生型质粒、SMC4-Mut突变型质粒均购于广州锐博生物科技有限公司;Lipofectamine 3000转染试剂购于美国Invitrogen公司;胎牛血清、RPMI-1640培养基购于美国Gibco公司;双荧光素酶报告基因检测试剂盒购于美国Promega公司;qRT-PCR试剂盒购于日本TaKaRa公司;引物购自武汉擎科生物技术公司;BCA蛋白浓度检测试剂盒和细胞周期检测试剂盒购于南京凯基生物科技有限公司;CCK-8试剂盒购于武汉碧云天生物科技有限公司;一抗GAPDH、SMC4、TGFBR3和p-Smad3购于美国Affinity公司;辣根过氧化物酶标记的二抗购于武汉博士德生物科技公司。
1.3 细胞培养和转染
MGC803细胞复苏后在含10%胎牛血清的RPMI-1640培养基中培养,培养条件为37 ℃、5%CO2、饱和湿度。将对数生长期的MGC803细胞接种至24孔板,分别转染miR-NC(control组)和miR-4778-3p mimic(miR-4778-3p组),根据Lipofectamine 3000转染试剂说明书进行操作。
1.4 qRT-PCR检测miR-4778-3p和染色体结构维持蛋白4(chromosome structure maintenance protein 4,SMC4)mRNA相对表达量
利用TRIzol提取样本总RNA,通过逆转录制备cDNA,根据qRT-PCR试剂盒说明书扩增检测。以U6为内参计算miR-4778-3p的相对表达,以GAPDH作为内参计算SMC4 mRNA的相对表达。miR-4778-3p上游引物:5′-ACTCTGCAAAGGAAGAAGA-3′,下游引物:5′-CAGTGCGTGTCGTGGAGT-3′;U6上游引物:5′-GCGCGTCGTGAAGCGTTC-3′,下游引物:5′-GTGCAGGGTCCGAGGT-3′;GAPDH上游引物:5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物:5′-GGCTGTTGTCATACTTCTCATGG-3′;SMC4上游引物:5′-CGCCTCCAGCAATGACCAAT-3′,下游引物:5′-CCCCAGCATAGGATTTGAAGTT-3′。根据2-ΔΔCt方法计算miR-4778-3p和SMC4 mRNA相对表达量。
1.5 CCK-8法检测MGC803细胞增殖能力
将“1.3”分control组和miR-4778-3p组MGC803细胞按照每孔1 000个细胞接种于96孔板,培养1,2,3,4,5 d后,根据CCK-8试剂盒说明书进行操作,使用酶标仪读取每孔在波长490 nm处吸光度(A)值,绘制MGC803细胞生长曲线。
1.6 流式细胞术检测MGC803细胞周期变化
收集“1.3”分control组和miR-4778-3p组MGC803细胞,离心后采用预冷的PBS溶液洗3次细胞,加入预冷的乙醇溶液(体积分数70%),在4 ℃下固定过夜。加入溴化乙锭(PI)和RNA酶(RNase A),在4 ℃下避光孵育20 min,使用流式细胞仪检测、分析各组细胞周期变化。
1.7 双荧光素酶报告基因检测
运用miRecords和miRGator数据库预测miR-4778-3p的靶基因可能是SMC4。运用GEPIA数据库分析SMC4基因在胃癌组织和正常胃组织中的表达差异。分别将所构建的SMC4-Wt野生型质粒、SMC4-Mut突变型质粒以及miR-4778-3p mimic或miR-NC共转染MGC803细胞。转染48 h后分别测定萤火虫荧光素酶值(F值)和海肾荧光素酶值(R值),R/F比值代表相对荧光素酶活性。
1.8 Western blot检测SMC4蛋白和TGF-β/Smad信号通路表达
收集control组和miR-4778-3p组MGC803细胞,加入RIPA裂解液在冰上充分裂解。BCA蛋白测定试剂盒检测各组蛋白浓度后,加入蛋白缓冲液制备蛋白样本,经十二烷基硫酸钠-聚丙烯酰胺凝胶凝胶电泳、PVDF膜转膜后,在脱脂牛奶封闭2 h,在一抗SMC4(浓度1 ∶2 000)、TGFBR3(浓度1 ∶2 000)、p-Smad3(浓度1 ∶2 000)、GAPDH(浓度1 ∶1 000)中孵育过夜。在辣根过氧化物酶标记的二抗(浓度1 ∶10 000)孵育1 h。使用ECL显影剂进行显影、拍照。
1.9 统计学处理

2 结果
2.1 胃癌组织中miR-4778-3p的表达水平
qRT-PCR检测结果显示,miR-4778-3p在38例胃癌组织和癌旁组织中的表达分别为2.03±0.65和6.85±0.62。与癌旁组织相比,miR-4778-3p在胃癌组织中的表达水平显著降低(t=34.51,P<0.01)。
2.2 miR-4778-3p瞬时转染效率
qRT-PCR检测结果显示,control组和miR-4778-3p组MGC803细胞中miR-4778-3p表达分别为0.99±0.07和14.26±0.56,miR-4778-3p组miR-4778-3p表达量是control组的14.40倍,差异有统计学意义(t=23.67,P<0.01),提示miR-4778-3p序列转染成功。
2.3 miR-4778-3p对MGC803细胞增殖能力的影响
CCK-8法结果显示,miR-4778-3p组MGC803细胞在第2,3,4,5天的吸光度A值明显低于control组(均P<0.05,见图1),表明上调miR-4778-3p能够显著抑制胃癌MGC803细胞的增殖能力。

与control组相比,*P<0.05,**P<0.01图1 miR-4778-3p对MGC803细胞增殖能力的影响Figure 1 Effect of miR-4778-3p on the proliferation of MGC803 cells
2.4 miR-4778-3p对MGC803细胞周期的影响
流式细胞术结果显示,与control组相比,miR-4778-3p组G0-G1期细胞增多(P<0.01),S期细胞降低(P<0.01,见图2)。miR-4778-3p能够阻遏MGC803细胞在G0-G1期。

图2 流式细胞术检测miR-4778-3p对MGC803细胞周期的影响Figure 2 The effect of miR-4778-3p on the cell cycle of MGC803
2.5 miR-4778-3p靶向结合SMC4的靶向关系
miRecords和miRGator数据库预测miR-4778-3p可能的靶基因是SMC4(见图3)。GEPIA数据库分析显示,SMC4基因在胃癌组织中的表达明显高于正常胃组织(P<0.01,见图4)。双荧光素酶活性实验结果显示,与miR-NC组相比,miR-4778-3p组荧光素酶活性降低,差异有统计学意义(t=7.93,P<0.01,见图5),表明SMC4-3′-UTR存在miR-4778-3p结合位点。

图3 SMC4-3′-UTR与miR-4778-3p的结合位点Figure 3 The binding site of SMC4-3′-UTR and miR-4778-3p
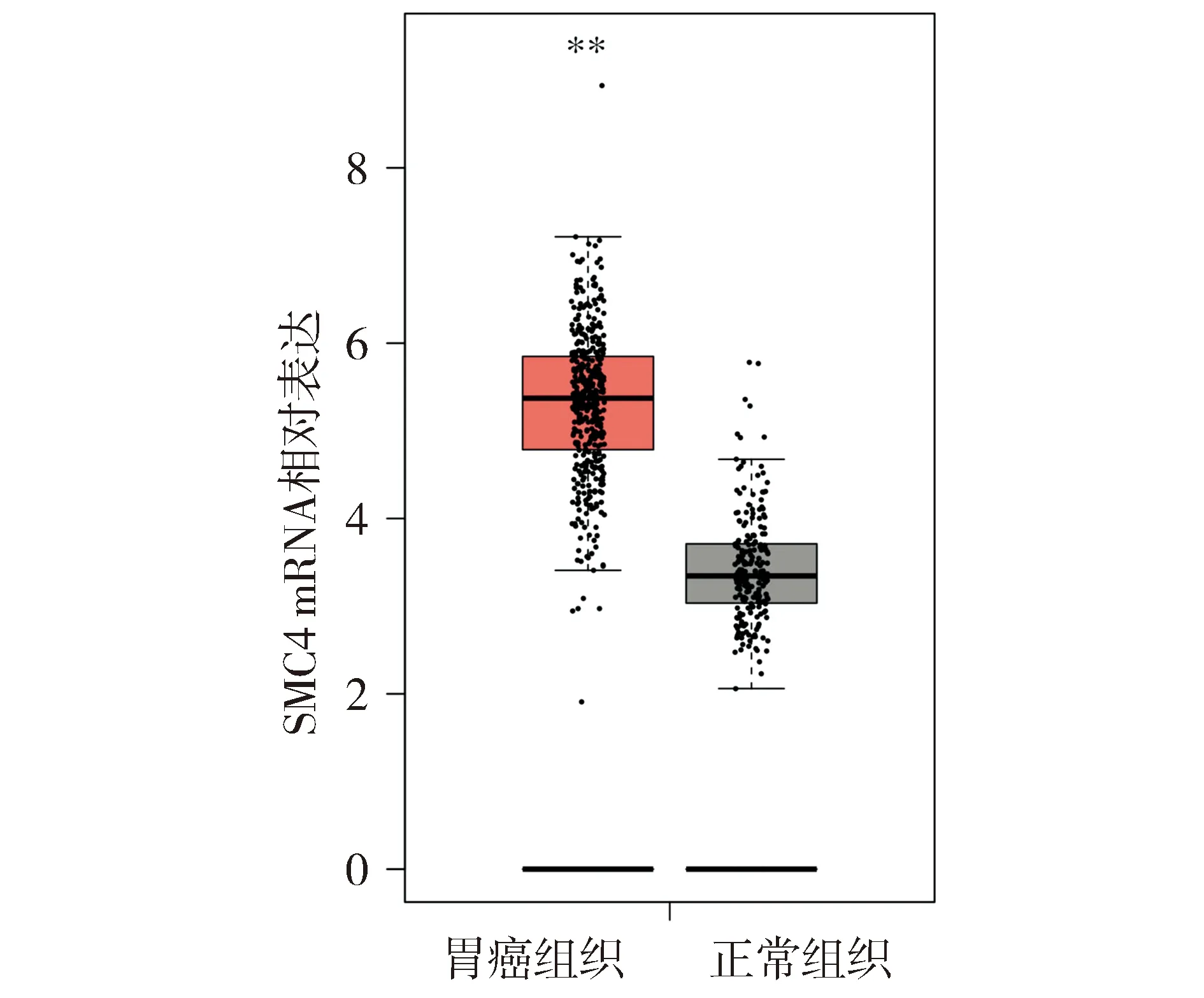
与正常组织相比,**P<0.01图4 GEPIA数据库分析SMC4在胃癌组织和正常组织中的表达Figure 4 The expression of SMC4 in gastric cancer tissues and normal tissues based on GEPIA database
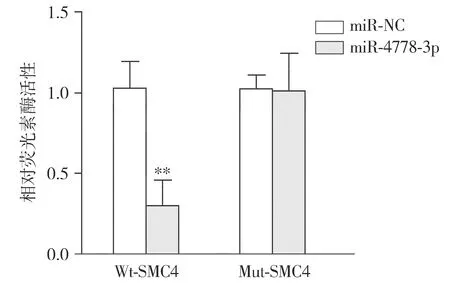
与miR-NC组相比,**P<0.01图5 双荧光素酶活性实验验证SMC4-3′-UTR与miR-4778-3p的结合Figure 5 Dual luciferase activity experiment verified the binding of SMC4-3′-UTR and miR-4778-3p
2.6 上调miR-4778-3p对MGC803细胞SMC4 mRNA表达的影响
qRT-PCR检测显示,control组和miR-4778-3p组MGC803细胞中SMC4 mRNA表达量分别为1.00±0.14和0.22±0.06,差异有统计学意义(t=5.03,P<0.01),提示上调miR-4778-3p显著促进SMC4 mRNA表达。
2.7 上调miR-4778-3p对MGC803细胞SMC4蛋白和TGF-β/Smad信号通路表达的影响
Western blot检测显示,与control组相比,miR-4778-3p组MGC803细胞中SMC4蛋白表达明显降低(P<0.01),TGF-β/Smad信号通路蛋白如TGFBR3和p-Smad3表达明显降低(P<0.01,见图6)。

与control组相比,**P<0.01图6 上调miR-4778-3p对SMC4蛋白和TGF-β/Smad信号通路表达的影响Figure 6 The effect of up-regulation of miR-4778-3p on the expression of SMC4 protein and TGF-β/Smad signaling pathway proteins
3 讨论
越来越多的miRNA被证实在肿瘤组织和癌旁组织中存在表达差异,表现为类似癌基因或抑癌基因的作用[8,9]。研究显示,miR-146b-5p[10]、miR-877-5p[11]、miR-96-5p[12]、miR-760[13]等miRNA在胃癌组织中呈高表达或低表达,参与调控胃癌细胞的增殖、凋亡、转移、分化等过程,与胃癌患者的临床分期、病理分级、生存率密切相关。miR-4778-3p是一个新发现的抑癌性miRNA,其可增强宫颈癌细胞对放疗的敏感性,抑制细胞活力、细胞周期及细胞转移[7]。本研究通过检测miR-4778-3p在胃癌组织和癌旁组织中的表达差异,结果显示miR-4778-3p在胃癌组织中呈低表达。本研究通过转染miR-4778-3p mimic至胃癌MGC803细胞,上调miR-4778-3p表达能显著抑制MGC803细胞的增殖和细胞周期,miR-4778-3p在胃癌细胞中表现为抑癌基因作用。
miRNA发挥作用的主要机制是通过在转录后水平特异性结合靶基因mRNA 3′-UTR,降低靶基因mRNA的稳定性,抑制靶基因蛋白的表达[14]。miRecords和miRGator数据库预测miR-4778-3p可能的靶基因是染色体结构维持蛋白4(structural maintenance of chromosome protein,4,SMC4)。SMC4蛋白属于染色体结构维持蛋白(structural maintenance of chromosome protein,SMC)家族,其在细胞有丝分裂过程负责调控染色体的凝集和分离,影响细胞周期的进展[15]。近年来研究显示,SMC4蛋白在结直肠癌、胶质瘤、乳腺癌、肺癌等多种肿瘤组织高表达,其可通过激活TGF-β/Smad信号通路的转导,促进肿瘤细胞增殖和细胞周期进展,发挥显著的癌基因作用[16-18]。GEPIA数据库分析显示,SMC4基因在胃癌组织中的表达明显高于正常胃组织,可能表现为癌基因作用。双荧光素酶活性分析实验证实miR-4778-3p靶向作用SMC4 mRNA的3′-UTR碱基位点。本研究结果显示,上调miR-4778-3p表达可靶向抑制SMC4基因在mRNA和蛋白水平的表达,miR-4778-3p对胃癌细胞增殖和细胞周期的影响可能与下调SMC4基因表达有关。MGC803细胞中SMC4基因表达降低后,TGF-β/Smad信号通路蛋白表达明显降低。
综上所述,miR-4778-3p在胃癌组织中呈低表达,上调miR-4778-3p通过靶向调控SMC4基因表达,阻滞TGF-β/Smad信号通路转导,有效抑制胃癌MGC803细胞增殖和细胞周期。miR-4778-3p有望成为胃癌新的分子治疗靶点。
