HE切片经不同方法褪色后行EGFR基因突变检测的对比分析
2021-09-22李钦丽张继伟
李钦丽,张继伟
我国肺癌的发病率和病死率呈逐年增加趋势,已位居各类癌症的首位[1]。随着靶向治疗的发展,EGFR突变状态已成为指导晚期肺腺癌治疗的重要指标[2],其基因状态的检测对靶向药物的选择起到至关重要的作用。但肺癌晚期患者已失去手术机会,只能获取活检样本或胸腹水样本,经常规HE及免疫组化染色,剩余肿瘤组织不足以进行EGFR检测,直接影响患者的后续治疗。本实验通过对HE切片经高锰酸钾草酸和盐酸乙醇两种方法褪色后行EGFR基因突变的检测进行对比,探讨两种方法对HE切片褪色后行EGFR检测的影响,为肿瘤组织不足的肺癌患者后续治疗提供可靠依据。
1 材料与方法
1.1 材料选取EGFR 21号外显子L858R突变阳性的肺腺癌标本3例,每例标本各选取1个蜡块,4 μm厚连续切片6张,分为白片组、高锰酸钾草酸褪色组和盐酸乙醇褪色组,每组切片2张。
1.2 主要试剂及仪器核酸提取试剂盒(FFPE DNA)、人类EGFR基因突变检测试剂盒、SMA4000超微量紫外可见核酸蛋白分析仪,购自厦门艾德公司;Quant Studio 3D Digital PCR Master Mix v2、EGFR Custom TaqMan SNP Genotyping Assays、Quant Studio 3D Digital PCR System,购自赛默飞公司;Mx3000P型荧光定量PCR仪,购自安捷伦公司。
1.3 方法
1.3.1HE染色与褪色 经常规HE染色后,HE切片用烤片机加热,当盖玻片内的中性树胶产生气泡时,将切片置入康莱中浸泡至盖玻片自行脱落。将切片置于新鲜康莱2次,每次5 min,保证洗净中性树胶,梯度乙醇(100%、95%、85%、75%)脱去康莱,用蒸馏水冲洗。(1)将切片放入0.5%高锰酸钾氧化5 min,蒸馏水冲洗干净,2%草酸溶液漂白,待组织完全变白后用蒸馏水冲洗干净,显微镜下观察褪色效果;(2)将切片放入新鲜配置的1%盐酸乙醇15 min,待组织完全变白后用蒸馏水冲洗干净,显微镜下观察褪色效果。
1.3.2DNA提取和定量 按照核酸提取试剂盒的操作方法,提取上述3组样本DNA,并用SMA4000超微量紫外可见核酸蛋白分析仪测量DNA的浓度及纯度。
1.3.3ARMS-PCR扩增和结果判读 取出预分装的PCR反应试剂,按照EGFR检测试剂盒的要求分别加入阴性对照、样本和阳性对照,放入荧光定量PCR仪中进行扩增。扩增条件:95 ℃ 5 min,1个循环;95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,合计15个循环;93 ℃ 25 s,60 ℃ 35 s,72 ℃ 20 s,合计31个循环。60 ℃时收集FAM和HEX信号。PCR扩增结束后,严格按EGFR检测试剂盒的判读要求进行结果判读。
1.3.43D Digital PCR扩增和结果判读 将配制好的反应液装载到芯片上后,进行PCR扩增。3D Digital PCR扩增条件:96 ℃ 10 min,1个循环;60 ℃ 2 min,98 ℃ 30 s,合计39个循环;60 ℃ 2 min,10 ℃保存。PCR反应结束后,读取芯片分析结果,进行数据分析。

2 结果
2.1 DNA的浓度和纯度按核酸提取试剂盒的要求提取DNA,各组样本的DNA最后均用50 μL洗脱液进行洗脱。三组样本DNA的纯度均为1.8~2.0,差异无统计学意义;高锰酸钾草酸褪色组和盐酸乙醇褪色组的DNA浓度均高于白片组,差异有统计学意义(P<0.05,表1)。
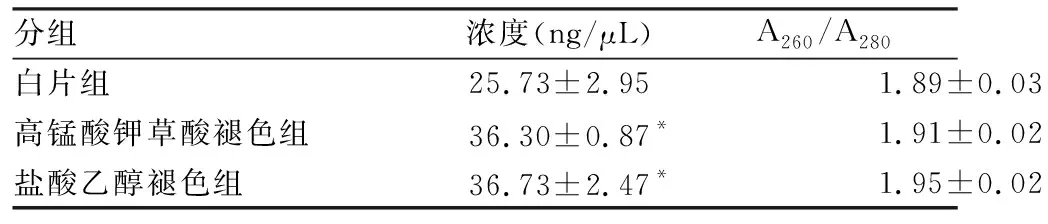
表1 DNA浓度和纯度比较
与白片组相比,*P<0.05
2.2 ARMS-PCR检测按照EGFR基因突变检测试剂盒的要求,各组样本DNA浓度均为1.5 ng/μL。白片组的外控和L858R的Ct值分别为18.77±0.14、22.83±0.05,盐酸乙醇褪色组的外控和L858R的Ct值分别为18.39±0.23、21.96±0.07,两者之间差异无统计学意义(图1),符合试剂盒的结果判读标准,L858R突变阳性。高锰酸钾草酸褪色组的外控和L858R的Ct值分别为23.94±0.38和27.25±0.64,均高于白片组和盐酸乙醇褪色组,差异有统计学意义(P<0.05,图1),不符合试剂盒的结果判读标准,无法进行结果判读。

图1 ARMS-PCR检测:A.外控扩增曲线;B. EGFR基因L858R突变扩增曲线;黄色.阳性对照;灰色.阴性对照;蓝色.白片组;绿色.盐酸乙醇褪色组;红色.高锰酸钾草酸褪色组
2.3 3D Digital PCR检测本实验用高灵敏度的3D Digital PCR技术进行EGFR基因突变检测,在样本DNA均为10 ng的条件下,高锰酸钾草酸褪色组L858R的突变丰度为(16.28±0.50)% 明显低于白片组(19.93±0.50)%和盐酸乙醇褪色组(19.41±0.36)%,差异有统计学意义(P<0.05,图2)。
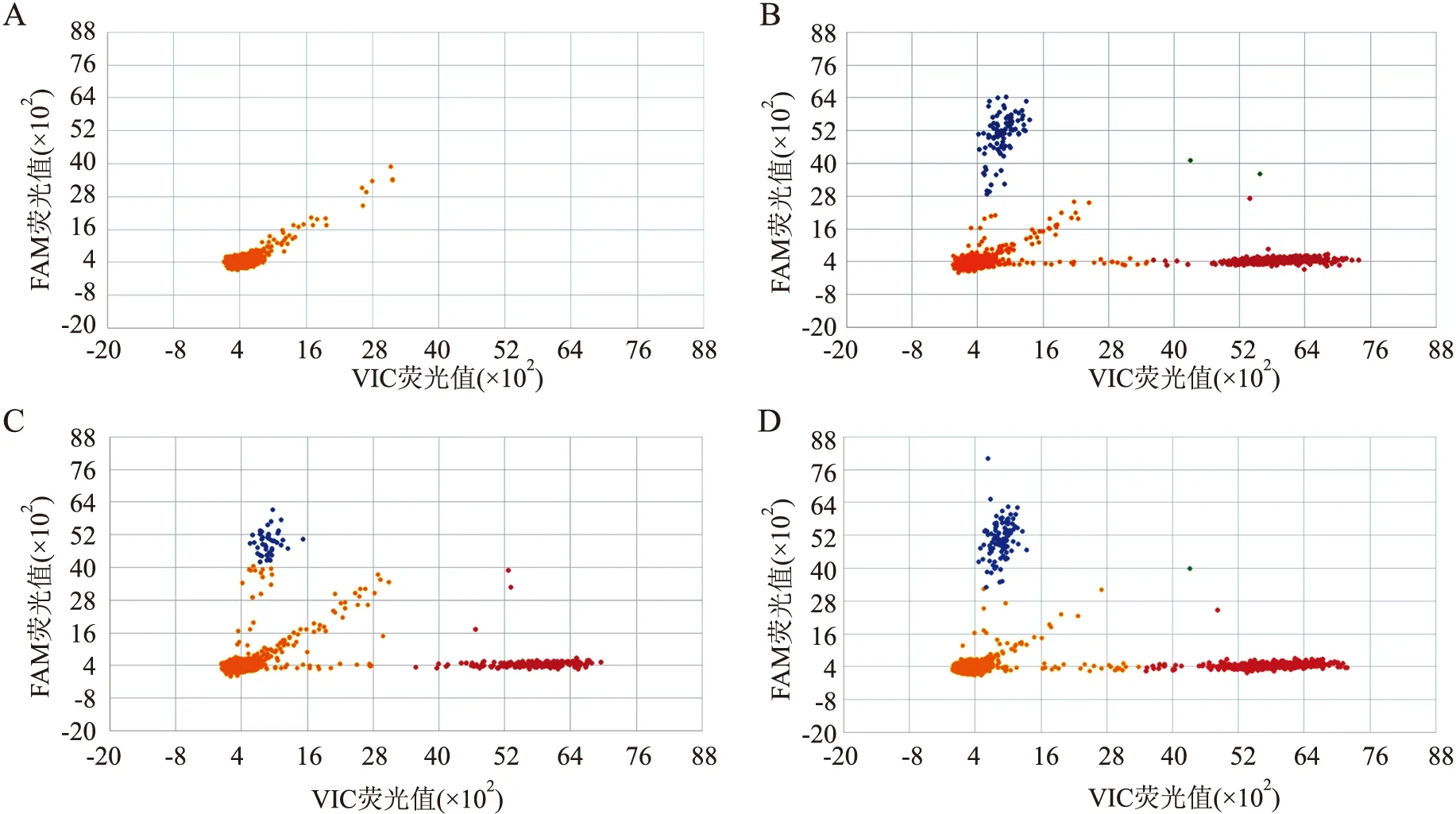
图2 3D Digital PCR检测:A.阴性对照组;B.白片组;C.高锰酸钾草酸褪色组;D.盐酸乙醇褪色组;黄色.空白;蓝色.EGFR基因L858R突变型;绿色.EGFR基因L858R突变型+EGFR基因野生型;红色.EGFR野生型
2.4 DNA片段化比较为明确HE切片经高锰酸钾草酸褪色组样本DNA不满足ARMS-PCR检测的需要,本实验利用美国Invivosribe淋巴瘤基因重排检测试剂盒中的size ladder检测各组样本DNA的片段长度,白片组和盐酸乙醇褪色组DNA片段长度主要为100、200、300 bp,而高锰酸钾草酸褪色组DNA片段长度则主要为100 bp(图3)。
图3 DNA片段化检测:M. Marker;S1.白片组;S2.高锰酸钾草酸褪色组;S3.盐酸乙醇褪色组
3 讨论
研究证实,HE切片褪色后除可重新进行HE染色外[3],还可进行免疫组化[4]、原位杂交[5]、免疫荧光[6]和特殊染色[7]检测。常用的HE切片褪色方法包括高锰酸钾草酸氧化漂白法和盐酸乙醇褪色法[3]。本实验通过对HE切片经上述两种方法褪色提取DNA的浓度和纯度进行比较,发现两组DNA的纯度与白片组相比差异无显著性,但浓度却显著增加,原因可能是两种方法行HE切片褪色时,在导致苏木精和伊红与细胞分离的同时,也改善DNA与蛋白的交联,促进DNA的暴露,进而引起DNA浓度的增加。
本实验对HE切片分别经高锰酸钾草酸和盐酸乙醇两种方法褪色后,通过ARMS-PCR和3D Digital PCR两个平台行EGFR检测。在模板量相同的情况下,与白片组相比高锰酸钾草酸褪色组外控Ct值和L858R突变的Ct值均显著增大,超出结果的判读标准;而盐酸乙醇褪色组外控Ct值和L858R突变的Ct值与白片组相比差异无统计学意义,明确EGFR基因L858R阳性突变。3D Digital PCR结果显示高锰酸钾草酸褪色组EGFR基因L858R突变丰度明显低于白片组和盐酸乙醇褪色组,差异有显著性,而后两组之间差异无显著性。以上结果表明,HE切片经高锰酸钾草酸褪色时,尽管获取的DNA浓度有所增加,但由于高锰酸钾为强氧化剂,在处理过程中可能导致有效DNA含量降低。本实验对三组样本DNA进行片段分析,在PCR扩增模板量均为50 ng的条件下,聚丙烯酰氨凝胶电泳结果显示,高锰酸钾草酸褪色组DNA片段化比较严重,最长片段主要为100 bp,而白片组和盐酸乙醇褪色组最长片段为300 bp以上。以上结果表明,HE切片经高锰酸钾草酸褪色时可加重DNA片段化,最终影响EGFR基因突变的检测,但盐酸乙醇褪色法却不会导致该结果的发生。
综上所述,在样本量不足或进一步获取组织样本受限时,可以用HE切片褪色后行EGFR突变检测,但褪色方法以1%盐酸乙醇褪色法最佳,其与高锰酸钾草酸氧化漂白法相比,在增加样本DNA质量的同时,仍可保持DNA片段的完整性,保证EGFR检测结果的可靠性,有利于非小细胞肺癌患者个体化治疗方案的实施。
