椰子油基胆盐脂质体的制备及工艺优化
2021-09-21时振振白新鹏岳宜静
时振振 白新鹏 岳宜静
(海南大学食品科学与工程学院,海南 海口 570000)
椰子油(Coconut Oil,CO)是源于椰子果肉经榨取和精炼得到的植物性油脂,富含中链脂肪酸(Medium Chain Fatty Acids,MCFAs)以及多种活性物质[1],MCFAs比例高达80%以上,主要为辛酸、癸酸以及月桂酸,月桂酸含量在原生态椰子油中高达50%~53%,故椰子油又被称为月桂酸油[2-4]。中链脂肪酸中的中链脂肪酸甘油三酯(Medium Chain Triglycerides,MCT)含量占60%,能被人体快速消化吸收,迅速提供能量,且不会在人体内转化或堆积成脂肪[5],具有促进新陈代谢、减少机体负荷、抗菌[6]、抗氧化、降血脂和胆固醇等多种生理功能[1,7],对人体的生理健康发展和维持具有积极效应[3]。椰子油的熔点约为24~26 ℃[8]。椰子油低熔点和不溶于水的性质限制了其在食品工业的应用范围。
脂质体(liposome,LPs)是1965年英国科学家Bangham在用电镜观察分散在水中的磷脂时发现的。其结构是由尾对尾的磷脂双分子层形成外围结构,内部为水相,磷脂分子层之间为油相[9],其理想化结构见图1。相较于纳米乳液和微胶囊而言,脂质体的优势是形成了一个同时运载着油和水的体系。将性质不稳定的物质包埋在脂质体中,可更长时间保持物质原有活性,并且由于脂质体颗粒大小属于纳米级别,因此被脂质体包埋的物质更容易被人体吸收利用[10-13]。胆盐脂质体是在脂质体膜中加入胆盐如胆酸钠或去氧胆酸盐而形成的,它不同于普通脂质体,由于胆盐的加入赋予了脂质体高度的变形性,可携带药物透过比自身尺寸小数十倍的孔隙,最初被应用于促进透皮给药[14-17]。
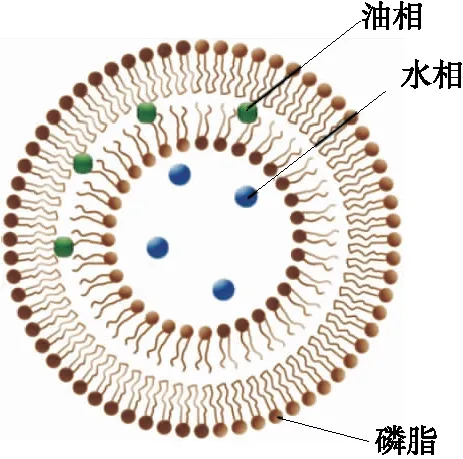
图1 脂质体理想化结构示意图
吕方方等[18]曾对羧甲基壳聚糖(CMCT)包裹椰子油脂质体的制备工艺进行了优化,但因素水平设计不够完善。研究拟利用脂质体结构特征,将椰子油包裹在中间的疏水尾部之间,其中也不乏由部分油脂被包埋进了内水相[12],以提高椰子油的水溶性及生物利用率。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
初榨椰子油:海南大白康健医药股份有限公司;
脱氧胆酸盐(猪):65%,上海源叶生物科技有限公司;
大豆卵磷脂:食品级,河南万邦实业有限公司;
无水乙醇:分析纯,西陇科学股份有限公司;
石油醚(Ⅱ):分析纯,广州化学试剂厂;
1×PBS缓冲液:pH 7.2~7.4,广州赛国生物科技有限公司。
1.1.2 主要仪器设备
电子天平:EL204型,梅特勒—托利多国际贸易(上海)有限公司;
循环水式真空泵:SHZ-D型,上海予华仪器设备有限公司;
高速冷冻离心机:GL-20G型,上海安亭科学仪器厂;
高功率超声波破碎仪:KQ-800KDE型,昆山市超声仪器有限公司;
旋转蒸发仪型:EV400型,北京莱伯泰科仪器股份有限公司。
1.2 方法
1.2.1 胆盐脂质体的制备 采用薄膜分散法制备椰子油胆盐脂质体。将磷脂与脱氧胆盐按一定比例(m大豆卵磷脂∶m脱氧胆酸盐分别为2∶1,3∶1,4∶1,5∶1,6∶1)加入茄形瓶中,再加入一定量无水乙醇和一定量的椰子油。将混合物超声分散一定时间后,于55 ℃下旋蒸30 min。再加入25 mL的磷酸缓冲盐溶液(PBS)后,在一定温度下水化一定时间后即得到椰子油脂质体。
1.2.2 包封率的测定
(1) 游离椰子油含量测定:采用萃取—离心法分离游离椰子油,分离后旋蒸除去有机溶液,再利用差量法得到游离油脂含量。具体操作:取3 mL椰子油脂质体于15 mL离心管中,再加入3 mL石油醚,摇晃离心管约15 s后进行离心(2 000 r/min、3 min),重复萃取3次。将茄形瓶称重得到空瓶重M1,称重后加入萃取液石油醚放入旋转蒸发仪旋转,蒸发除去萃取液石油醚后,待茄形瓶温度变为常温后再次称重得到瓶重M2。空白对照为按同样方法制备脂质体,但不加入椰子油,首先称重得到空瓶重M3,再按同样方法先萃取后蒸发除去石油醚,得到蒸发石油醚后的瓶子质量M4。按式(1)计算游离椰子油含量。
W游=(M2-M1)-(M4-M3),
(1)
式中:
W游——游离椰子油含量,g;
M1——空瓶质量,g;
M2——蒸发除去萃取液石油醚后瓶质量,g;
M3——对照组空瓶质量,g;
M4——对照组蒸发石油醚后的瓶子质量,g。
(2) 总椰子油含量测定:取3 mL椰子油脂质体于15 mL离心管中,加入3 mL破乳剂。混合均匀后放入超声清洗机中超声粉碎10 min进行破乳,破乳后加入3 mL石油醚,摇晃离心管约15 s后进行离心(8 000 r/min、3 min),共重复萃取3次。将茄形瓶称重得到空瓶重M5,称重后加入萃取液放入旋转蒸发仪旋转,蒸发除去石油醚后,待茄形瓶温度变为常温后再次称重得到瓶重M6。空白对照为按同样方法制备脂质体,但不加入椰子油,再按试验测定法测定。首先空白对照组含量得到空白对照组空瓶质量M7,再按同样方法先萃取后蒸发除去石油醚,得到蒸发石油醚后的瓶子质量M8。按式(2)计算总椰子油含量。
W总=(M6-M5)-(M7-M8),
(2)
式中:
W总——总椰子油含量,g;
M5——空瓶质量,g;
M6——蒸发除去萃取液石油醚后瓶质量,g;
M7——对照组空瓶质量,g;
M8——对照组蒸发石油醚后的瓶子质量,g。
(3) 椰子油包封率的计算:
E=[(W总-W游)/W总]×100%,
(3)
式中:
E——椰子油包封率,%;
W游——游离椰子油含量,g;
W总——总油量,g。
1.2.3 单因素试验设计
(1)m大豆卵磷脂∶m脱氧胆酸盐对包封率的影响:控制其他变量分别为磷酸缓冲盐溶液25 mL、无水乙醇5 mL、椰子油1 mL、超声分散时间10 min,水化温度55 ℃、水化时间30 min,考察m大豆卵磷脂∶m脱氧胆酸盐(2∶1,3∶1,4∶1,5∶1,6∶1)对包封率的影响。
(2)V磷酸缓冲盐溶液∶V无水乙醇对包封率的影响。控制其他变量分别为大豆卵磷脂与胆盐比列4∶1,椰子油1 mL、超声分散时间10 min、水化温度55 ℃、水化时间30 min,考察V磷酸缓冲盐溶液∶V无水乙醇(5∶5,5∶4,5∶3,5∶2,5∶1)对包封率的影响。
(3) 超声时间对包封率的影响:控制其他变量分别为磷酸缓冲盐溶液25 mL、大豆卵磷脂与胆盐比列4∶1、无水乙醇5 mL、椰子油1 mL、水化温度55 ℃、水化时间30 min,考察超声分散时间(10,15,20,25,30 min)对包封率的影响。
(4) 水化温度对包封率的影响:控制其他变量分别为磷酸缓冲盐溶液25 mL、大豆卵磷脂与胆盐比列4∶1、无水乙醇5 ml、超声分散时间15 min、椰子油1 mL、水化时间30 min,考察水化温度(45,50,55,60,65,70 ℃)对包封率的影响。
(5)m大豆卵磷脂∶m椰子油对包封率的影响:控制其他变量分别为磷酸缓冲盐溶液25 mL、大豆卵磷脂与椰子油比列4∶1、无水乙醇5 mL、超声分散时间15 min、水化时间30 min,考察m大豆卵磷脂∶m椰子油(0.50,0.75,1.00,1.25,1.50)对包封率的影响。
(6) 水化时间对包封率的影响:控制其他变量分别为磷酸缓冲盐溶液25 mL、大豆卵磷脂与胆盐比列1∶4、无水乙醇5 mL、椰子油1 mL、超声分散时间15 min,考察水化时间(10,20,30,40,50 min)对包封率的影响。
1.2.4 响应面试验设计 在单因素试验基础上,发现m大豆卵磷脂∶m脱氧胆酸盐、m大豆卵磷脂∶m椰子油和水化温度三因素对脂质体包封率影响较大,而V磷酸缓冲盐溶液∶V无水乙醇、超声时间和水化时间影响相对较小,因此选取影响较大的进行响应面试验。利用三因素三水平Box-Behnken设计,以椰子油胆盐脂质体包封率为响应值,优化椰子油胆盐脂质体的制备工艺条件[19]。
1.3 数据处理
试验数据均为3次平行试验,测试结果以均值±标准差表示,采用SPASS 17.0软件进行统计分析。
2 结果与分析
2.1 回归方程的建立及模型方差分析
响应面试验因素水平及编码如表1所示,试验方案及结果见表2。

表1 响应面面试验因素与水平设计
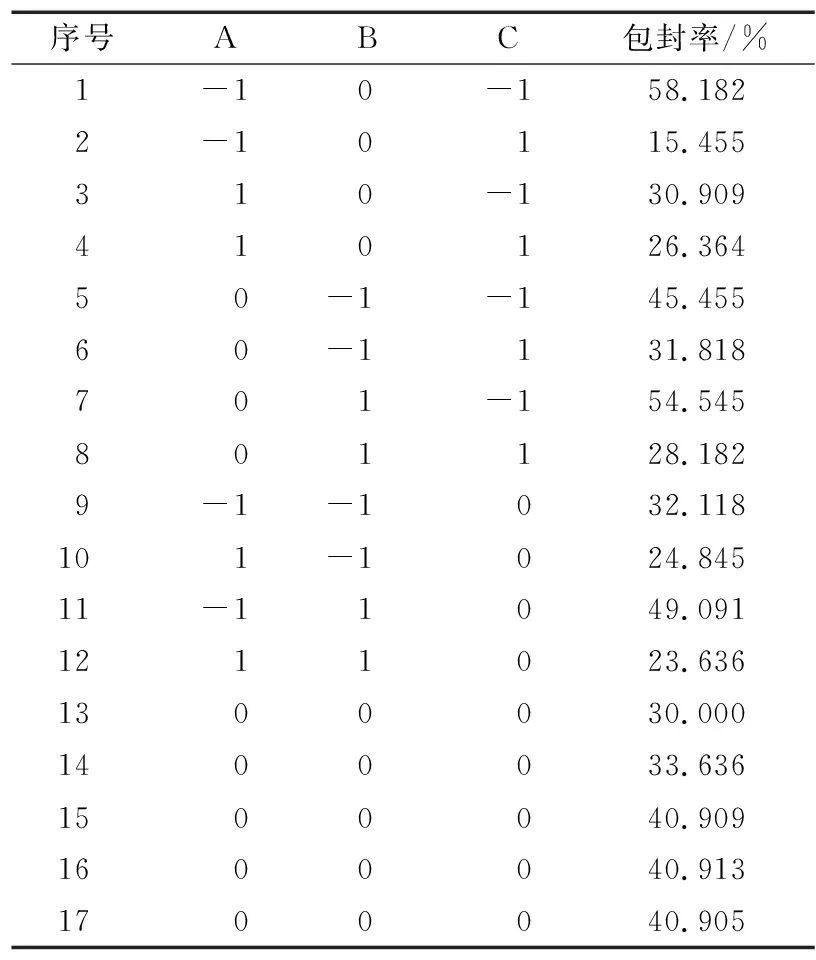
表2 响应面试验方案及结果
采用Design-Expert 8.0软件对表2数据进行拟合得出二次多项回归方程为:
Y=-0.021 735+0.561 41A-6.471 10×10-3B-0.418 59C-9.091 00×10-3AB+0.381 82AC-0.025 452BC-0.060 613A2+4.844 80×10-4B2+0.242 59C2。
(4)

表3 方差分析
一次项A、C的P值<0.01,说明因素A、C对包封率影响极显著。交互项AC的P值=0.005 2<0.01,说明因素AC对包封率影响极显著。二次项A2的P<0.05,表明其对脂质体包封率影响显著。根据F值可以看出影响脂质体包封率的主次因素为m大豆卵磷脂∶m椰子油(C)>m大豆卵磷脂∶m脱氧胆酸盐(A)>水化温度(B)。各个交互因子的响应曲面及其等高线见图2。
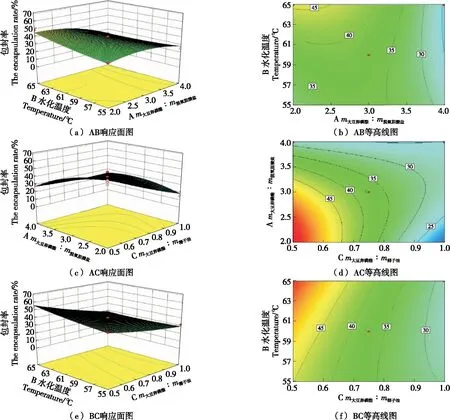
图2 两因素交互作用对椰子油胆盐脂质体包封率影响的响应面图及等高线图
2.2 响应面图分析
由图2可知,m大豆卵磷脂∶m脱氧胆酸盐和m大豆卵磷脂∶m椰子油交互作用的等高线呈椭圆形,分布密集,说明交互作用显著,响应曲面的走势相对其他交互作用更为陡峭,说明对响应值的影响更为显著。当m大豆卵磷脂∶m椰子油或m大豆卵磷脂∶m脱氧胆酸盐固定时,椰子油胆盐脂质体的包封率随着m大豆卵磷脂∶m椰子油的增加而明显降低,当m大豆卵磷脂∶m椰子油一定时,椰子油胆盐脂质体包封率随m大豆卵磷脂∶m脱氧胆酸盐与水化温度变化相对较小。水化温度固定时的曲面和超声时间固定时的相比更为陡峭,说明水化温度对椰子油胆盐脂质体包封率的影响更大。
2.3 回归模型优化及验证
通过Design-Expert 8.0软件优化得出的制备椰子油胆盐脂质体最佳工艺条件为:m大豆卵磷脂∶m脱氧胆酸盐=2.23、m大豆卵磷脂∶m椰子油=0.56、水化温度64.7 ℃,预测该模型下制备得到的椰子油胆盐脂质体的包封率为59.22%。为了验证该响应面模型优化得到的工艺条件的可靠性,在此工艺条件下进行3组平行验证实验,实际测得椰子油胆盐脂质体包封率58.09%,与模型预测值椰子油胆盐脂质体的包封率相对误差为1.91%,说明实际验证值与响应面模型的预测值吻合良好。
3 结论
试验以卵磷脂和胆盐为壁材,通过响应面法优化了椰子油胆盐脂质体的制备工艺,其最优制备工艺为大豆卵磷脂与脱氧胆酸盐比例2.53、样脂比0.56、水化温度64.70 ℃,椰子油胆盐脂质体的包封率为58.09%。试验中椰子油胆盐脂质体包封率的测定方法还有不足之处,后续应进一步优化椰子油胆盐脂质体的包封率测定方法。
