槟榔贮藏及加工过程中细菌群落结构变化
2021-09-21阮志强邓建阳蒋雪薇罗晓明卢克强
阮志强 邓建阳 蒋雪薇 姚 力 李 浩 罗晓明 卢克强
(1. 长沙理工大学化学与食品工程学院,湖南 长沙 410114;2. 湖南皇爷食品有限公司,湖南 湘潭 411207)
槟榔(ArecacatechuL.),是棕榈科槟榔属常绿乔木,主要分布在亚洲的热带地区[1]。目前中国槟榔生产主要集中在海南,深加工主要集中在湖南[2]。槟榔被称为四大南药(槟榔、砂仁、益智、巴戟天)之首[3],由于咀嚼后会产生欣快感和轻微兴奋性,颇受特定人群喜爱,已逐渐成为第四大嗜好品。槟榔鲜果不耐贮藏[4],故需在产地经干制加工成槟榔原籽运至湖南进行贮藏或加工。不同槟榔厂家加工工艺略有不同[5-6],但主要工艺比较相似,一般为:槟榔原籽→煮籽→发制→烤籽→闷香→压籽→上胶→切籽(含去核、点卤)→晾籽→包装等多个工序[7]。根据这些工序的加工特点及细菌数量变化发现,原籽的初始带菌对整个工艺过程细菌总数影响较大;煮籽是一个降细菌数量比较有效的工序;发制→烤籽→闷香是一个连续的过程,且对细菌数量提升有促进作用,是加工过程中的重要风险点;压籽→上胶→切籽中的压籽和上胶均为设备操作,而切籽(含去核、点卤)则大多为人工操作,成为闷香后的又一个风险点;晾籽是包装前进一步降低水含量的过程,且伴随着紫外杀菌等措施,被认为是槟榔包装前的减菌工序[6]。从上述工序分析可以发现,槟榔原籽(含新籽和老籽,新籽为当年采摘后干制而成的原籽,老籽为新籽贮藏1年及以上的原籽)、煮籽、闷香、切籽、晾籽以及成品为槟榔加工过程中控制的关键点。
槟榔污染菌分为细菌和霉菌两大类。霉菌主要生长在槟榔产品表面,污染后易长成肉眼可见的菌丝体,霉菌在槟榔加工中可以从环境管控及产品水分控制两个方面入手,目前课题组及其他研究团队针对霉菌群落结构及其控制已经开展了较多研究[8-9]。槟榔加工中的细菌相较霉菌来说,其生长周期更短,且不易发觉,更难防控。槟榔的污染细菌主要来源于成果时的内生菌[7]以及加工污染[10],是槟榔腐败的主要因素,能使成品槟榔表面发黏,严重的情况下还会引起腹泻等急性症状,而且耐热的细菌(芽胞杆菌属等)在槟榔加工中难以被杀灭,而目前对槟榔污染细菌及细菌在槟榔贮藏和加工过程中的变化尚未见报道。
高通量测序技术(HTS)因其效度快及通量高的优势[11-12],目前已被广泛应用于基因组学研究中,其在肠道[13-14]、土壤[15-16]和发酵食品[17-18]等样品的微生物多样性研究领域具有明显的先进性和优势。蒋雪薇等[8]通过高通量测序技术发现槟榔原籽贮藏前后优势真菌为散囊菌属(Eurotium)、曲霉属(Aspergillus);张祺玲等[9]通过高通量测序技术发现在食用槟榔整个加工过程中,槟榔内生菌Aspergillus均为绝对优势真菌,相对丰度达66.70%~97.67%。刘媛等[19]通过高通量测序技术发现在三药槟榔种子的内生细菌中,肠球菌属(Enterococcus)占比42.9%,为第一优势菌属。文章拟利用高通量测序技术对槟榔原籽贮藏前后及加工过程中的细菌群落结构进行研究,获得槟榔原籽贮藏前后及加工过程中的细菌群落结构及变化信息,为分析槟榔原籽贮藏及加工过程中细菌的污染源提供依据,在减少污染的同时为槟榔生产全线防控细菌污染提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
槟榔样品采自湖南某槟榔公司,包括当年产的槟榔原籽新籽(BL1)、BL1贮藏1年的原籽老籽(BL2,贮藏条件为室温避光通风干燥)、煮籽后样品(BL3,原料为槟榔原籽新籽BL1)、闷香后样品(BL4)、压籽后样品(BL5)、切籽样品(BL6)和成品(CP7),随机采集样品低温运回实验室,编号后于-80 ℃贮藏备用。
1.1.2 主要试剂
平板计数琼脂(PCA):杭州微生物世纪有限公司;
氯化钠:分析纯,国药集团化学试剂有限公司;
E.Z.N.A.Soil DNA Kit试剂盒:美国Omega生物试剂公司;
Taq DNA Polymerase及dNTP-mix:美国Thermo Fisher科技公司;
SanPrep柱式DNA胶回收试剂盒:上海生工生物工程有限公司;
琼脂糖:北京天根生化科技有限公司;
16S rDNA V3~V4区引物:上游引物为341F[20](5′-CCTACGGGAGGCAGCAG-3′),下游引物为805R[20](5′-GACTACCAGGGTATCTAATC-3′),上海生工生物工程有限公司。
1.2 仪器与设备
立式压力蒸汽灭菌锅:BXM-30R型,上海博讯实业有限公司医疗设备厂;
恒温培养箱:MJ-250 Ⅱ型,上海一恒科技有限公司;
台式离心机:Pico-21型,美国Thermo Fisher科技公司;
荧光定量仪:Qubit2.0型,美国Life科技公司;
漩涡混合器:GL-88B型,海门市其林贝尔仪器制造有限公司;
混匀型干式恒温器:TND03-H-H型,深圳拓能达科技;
电泳仪电源:DYYY-6C型,北京市六一仪器厂;
电泳槽:DYCZ-21型,北京市六一仪器厂;
凝胶成像系统:ChampGel5000型(增强型),北京赛智公司。
1.3 试验方法
1.3.1 细菌总数计数 参照GB 4789.2—2016。
1.3.2 含水量测定 选取同一工序样品6~8个,去核切碎后混匀,准确称取5.00 g于称量瓶中,105 ℃烘干至恒重后计算样品含水量。
1.3.3 总DNA提取及PCR扩增 采用E.Z.N.A.Soil DNA Kit试剂盒提取槟榔样品中细菌总DNA,用Qubit 2.0荧光定量仪检测DNA浓度,1%琼脂糖凝胶电泳检测DNA完整性,于-20 ℃贮藏备用。选用16S rDNA V3~V4区通用引物341F-805R进行扩增。
(1) 初次PCR扩增反应体系为50 μL:10×PCR Buffer 5 μL,dNTP(10 mmol/L each) 0.5 μL,Genomic DNA 10 ng,Bar-PCR primer F(50 μmol/L) 0.5 μL,Primer R(50 μmol/L) 0.5 μL,Plantium Taq(5 U/μL) 0.5 μL,ddH2O补齐至50 μL。PCR反应程序:95 ℃预变性30 s;95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸30 s;5个循环,最终72 ℃延伸5 min。
(2) 初次PCR结束后进行第二轮扩增,第二轮扩增体系为50 μL:10 × PCR Buffer 5 μL,dNTP(10mmol/L each) 0.5 μL,DNA 20 ng,Primer F(50 μmol/L) 0.5 μL,Primer R(50 μmol/L) 0.5 μL,Plantium Taq(5 U/μL) 0.5 μL,ddH2O补齐至50 μL。PCR反应程序与初次相同。PCR结束后,将产物于1%琼脂糖凝胶上电泳,EB染色,在凝胶成像系统下观察。
1.3.4 高通量测序 采用DNA回收试剂盒对PCR扩增产物进行切胶回收,利用Qubit2.0荧光定量仪对回收的DNA进行精确定量。根据获得的DNA浓度,将所有样品按质量比1∶1进行混合,混合后的样品寄往上海生工进行测序,测序平台为Illumina MiSeq平台。
1.3.5 测序结果预处理 通过Flash软件融合双末端序列,使其形成一条序列,根据各样品的barcode序列使数据回归样品。通过Prinseq软件对各样品序列进行质量控制(QC),去除引物序列、短片段、低复杂度序列和低质量序列[21]。利用Uchime和pre.cluster软件去除嵌合体及靶区域外序列以获得最终可用于分析的序列[22]。
1.3.6 生物信息分析 利用uclust软件(uclust v1.1.579)以97%的相似性为阈值对序列进行OTU聚类。根据样品的OTU及序列关系,采用mothur软件[23]对样品进行Alpha多样性分析,计算各物种多样性指数,衡量样本物种多样性。采用RDP classifier软件[24]将序列进行物种分类,RDP classifier参数:-f allrank -q input -g 16s -o rdp_out,分类阈值默认为0.8。
1.3.7 数据分析 采用Excel软件对数据进行处理,Origin 2021软件绘图;所有样品均采用3平行样分析,测序结果取均值用于后续绘图。
2 结果与讨论
2.1 槟榔加工过程中关键工序样品细菌总数及水分含量变化
由图1和图2可知,整个贮藏及加工过程中,槟榔样品的细菌总数在数量级上的差异较小。槟榔原籽贮藏1年后,细菌总数从1.5×104CFU/g降至7.1×103CFU/g,水分含量从18.32%降至10.50%。加工过程中,槟榔原籽经一系列工序加工后,成品样品中细菌总数为8.7×102CFU/g,达到产品出厂前的标准要求5.0×103CFU/g,水分含量为27.23%。加工过程中出现细菌总数升高的是煮籽到闷香的中间阶段,包括发制、烤籽和闷香等工序,这是由于发制与闷香是槟榔加工中入味及定香的工序,一般在密闭的罐内进行,此时样品的水分含量达到了最大值,为30.35%,较为适合微生物的生长。加工过程中多项工序的细菌总数与出厂标准相差不大,多依赖于晾籽工序中的食用酒精处理和紫外照射等消毒杀菌措施使成品达到产品的出厂标准,但这两种处理方式会出现不均匀的情况,影响成品的细菌总数稳定达标。

图1 槟榔加工过程中关键工序样品细菌总数变化

图2 槟榔加工过程中关键工序样品水分含量变化
2.2 测序数据处理与分析
将待测序样品添加barcode序列作为测序标签后进行样品建库与测序,测序结束后,根据barcode序列对获得的测序序列进行区分,其中质控后BL1样品获得序列数为62 470,BL2样品获得序列数为36 624,BL2、BL3和BL4样品获得的序列数较为接近,分别为18 980,15 940,19 511,BL6样品获得序列数为35 915,CP7样品获得序列数为10 465。完成质控处理后,通过Uchime和pre.cluster软件去除嵌合体及靶区域外序列,各样本处理后统计结果如表1所示。其中BL1~BL6样品最终获得可用于分析的序列数均在10 000以上,满足基本分析要求,CP7样品最终获得可用于分析的序列数为9 444,序列数较少,最终分析结果可能会有误差。经最后处理后样品的序列分布如图3所示。由图3可知,大部分序列长度分布在421~440 bp,符合16S rDNA高通量测序V3~V4区的要求和标准。

表1 各样本数据信息统计
图3 有效序列长度分布图
2.3 高通量测序数据统计分析
2.3.1 OTU统计分类 将多条序列按其序列间的距离进行聚类,根据序列之间的相似性作为阈值分为操作分类单元(OTU),阈值的序列相似性为97%。通过uclust软件对7个样品的序列进行聚类(见表2),共获得6 447个 OTU,其中获得OTU数量最多的是BL2样品,为3 028个,获得OTU数量最小的是CP7样品,为505个。
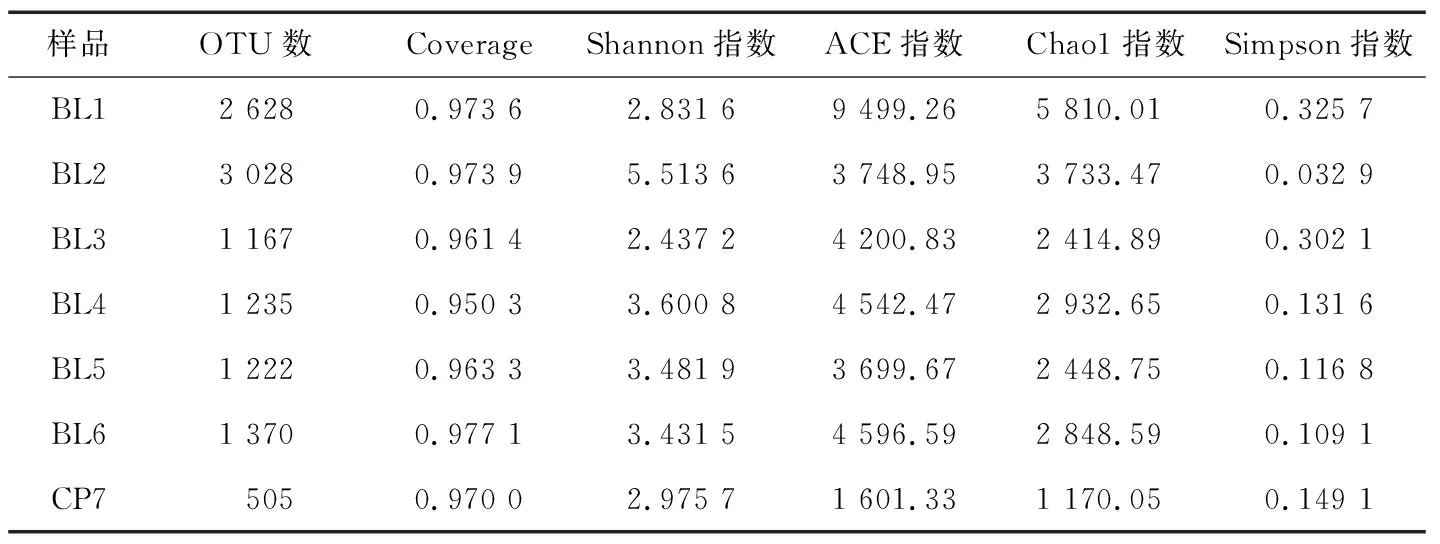
表2 样品的OTU数量及Alpha多样性
为验证OTU分类能否真实反映样品中微生物的群落多样性,对各样品采用Coverage及丰富度指数进行评估。由表2可知,Coverage值最大的是BL6样品,为0.977 1,Coverage值最小的是BL4样品,为0.950 3,7个样品的Coverage值均在0.95以上,表明此次测序结果基本可以代表样本中微生物的真实情况。
由图4可知,BL1、BL2和BL6样品的稀释性曲线均趋于相对平稳,而BL3、BL4、BL5和CP7样品的稀释性曲线还有较大增长的可能性,表示增大测序深度可以获得更多的OTU,但是结合样品的Coverage值来看,此次测序结果已覆盖到样本中绝大多数微生物,故7个样品的OTU分类基本能够真实反映样品中微生物的群落多样性。

图4 样品丰度稀释性曲线
2.3.2 细菌菌群Alpha多样性分析 由表2可知,BL1样品的香农指数为2.831 6、辛普森指数为0.325 7,BL2样品的香农指数为5.513 6、辛普森指数为0.032 9,说明BL1样品的细菌群落物种多样性低于BL2样品。BL1样品的Chao1指数为5 810.01、ACE指数为9 499.26,远高于BL2样品的Chao1指数(3 733.47)和ACE指数(3 748.95),说明BL1样品的细菌群落物种丰富度高于BL2样品。结合2个样品的物种多样性和丰富度来看,BL1样品具有更高的物种丰富度,但是物种多样性低于BL2样品,说明槟榔原籽在贮藏前后所含细菌的丰富度逐渐降低,但是物种多样性逐渐升高。在各生产工序样品中,BL3样品的物种多样性最低,物种丰富度也处于较低水平,说明煮籽工序具有较好的杀菌作用,能降低样品中细菌数量;BL4样品的物种多样性最高,物种丰富度也处于较高水平,结合细菌总数检测数据,说明在煮籽后至闷香结束的过程中温度、水分等环境条件适宜细菌的生长;BL5、BL6样品的物种多样性和物种丰富度较BL4样品均有所降低,这是由于压籽到切籽工序样品水分蒸发,含水量下降导致部分细菌死亡;CP7样品的物种丰富度降至最低,但其物种多样性仍维持在较高水平,是因为晾籽工序进一步降低了样品水分,加上晾籽过程中采用食用酒精消毒处理和紫外线照射,使细菌总数进一步降低,但由于槟榔加工为固体物料的半连续化加工,所有工序受到环境因素的影响较大,致使成品(CP7)的细菌多样性在7个样品中依然维持较高水平。
2.4 槟榔贮藏前后及加工过程中细菌群落结构变化
在“科”的分类水平上,7个样品共获得239个细菌科,单个样品获得的细菌科数量依次为165,207,146,153,137,140,75。7个样品的物种丰度图如图5所示,其中槟榔原籽新籽BL1样品的优势细菌为芽胞杆菌科(Bacillaceae1),占比72.91%,其次是假单胞菌科(Pseudomonadaceae)占比11.28%,丛毛单胞菌科(Comamonadaceae)占比9.43%,unclassified细菌占1.01%,其余占比均低于1%。而槟榔原籽老籽BL2样品的物种含量则更加均一,其中以Pseudomonadaceae占比最高,为27.7%,其次为Comamonadaceae占比17.76%,unclassified序列占比7%,其他细菌如疣微菌科(Verrucomicrobiaceae)、紫单胞菌科(Porphyromonadaceae)、黄单胞菌科(Xanthomonadaceae)等10个科占比>1%。通过对比可知,两种槟榔原籽在“科”的分类水平上存在较大差异,经贮藏后老籽细菌的相对丰度更为均衡,所以物种的多样性明显升高。而在各加工工序样中,BL3样品的明串珠菌科(Leuconostocaceae)和Bacillaceae1占主要地位,占比分别为47.01%,33.51%;BL4~CP7样品中优势菌群较为相似,均为Comamonadaceae和Pseudomonadaceae,综合占比均在70%以上。此外,黄杆菌科(Flavobacteriaceae)在加工过程中含量逐渐递增,在CP7样品中占比14.71%。

图5 槟榔加工过程中关键工序样品科水平物种丰度图
在“属”的分类水平上,7个样品共获得790个细菌属,单个样品获得的细菌属数量依次为458,579,343,353,353,340,133。7个样品的物种丰度图如图6所示,BL1样品中以芽胞杆菌属(Bacillus)、假单胞菌属(Pseudomonas)及氢噬胞菌属(Hydrogenophaga)为主要污染细菌,分别占比72.90%,11.21%,9.23%。其他细菌如嗜热厌氧杆菌属(Thermoanaerobacterium)、短波单胞菌属(Brevundimonas)与沙雷氏菌属(Serratia)等也有少量存在,占比均<1%。BL2样品中,Pseudomonas与Hydrogenophaga占比分别为27.40%,16.61%,在BL1样品中占比较高的Bacillus在老籽中仅占0.59%。此外,在BL1样品中含量较低的菌如艾克曼菌属(Akkermansia)、寡养单胞菌属(Stenotrophomonas)与Thermoanaerobacterium等,贮藏1年后在BL2样品中占比均有所提升,分别为6.24%,2.23%,2.12%。而在各加工工序样中,BL3样品的明串珠菌属(Leuconostoc)和Bacillus占主要地位,占比分别为47.01%,33.5%;BL4~CP7样品中均为Hydrogenophaga和Pseudomonas,综合占比均在70%以上。根据污染细菌群落结构及细菌的生活习性分析,Pseudomonas、Bacillus和Hydrogenophaga应属于槟榔内生菌[25],对于不耐热的革兰氏阴性菌,如Hydrogenophaga和Pseudomonas,煮籽工序可以将其有效杀死;而耐热的革兰氏阳性菌Bacillus则很难用单纯的煮籽工序将其杀死,需选择其他抑菌杀菌工艺。随着工序的进行,金黄杆菌属(Chryseobacterium)逐渐增加,在CP7样品中占比14.64%。Chryseobacterium为革兰氏阴性菌,广泛存在土壤、水、植物等自然环境及医院环境中,为条件致病菌,可能是在发制入味工序中由环境带入,此外发制及闷香工序的环境条件有利于此菌繁殖,从而导致其数量增殖[26]。
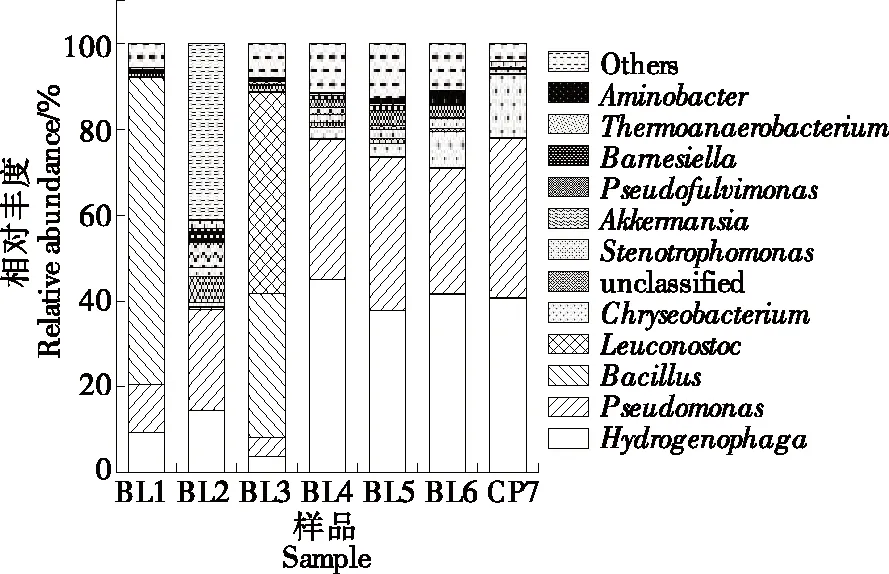
图6 槟榔加工过程中关键工序样品属水平物种丰度图
2.5 槟榔加工过程中各工序污染细菌属数量变化
槟榔加工过程中的污染细菌主要来源于两个方面,一方面为槟榔成果时的内生菌[27],另一方面为贮藏及加工各工序的污染菌。在属水平对相邻工序样品共有细菌属、消亡细菌属及新增细菌属进行分析,可以反映槟榔加工过程中两相邻工序间细菌菌属的消长。由图7可知,每两相邻工序均有新增细菌属,说明槟榔加工过程的每个工序样品都会受到来自环境的微生物污染;除BL6与CP7样品外,每相邻两工序中共有细菌属数量均比消亡细菌属及新增细菌属数量多,说明槟榔加工过程中,每个关键工序的污染细菌多数由上一工序传递而来;原籽新籽(BL1)贮藏1年后成为老籽(BL2)是新增细菌属最多的过程,达227个属,说明在原籽贮藏过程中受到环境污染较大,促进了新增细菌属的数量,需对贮藏环境进行消杀,减少贮藏过程中的细菌污染;煮籽(BL3)到闷香(BL4)中新增细菌属数量居次,为126个属,结合细菌总横坐标为贮藏前后或加工过程中的两相邻工序样品;消亡细菌属数为两相邻工序样品中下游工序样品相对上游工序样品消亡的细菌属数量;共有细菌属数为两相邻工序样品共有的细菌属数;新增细菌属数为两相邻工序样品中下游工序样品相对上游工序样品新增的细菌属数量数的变化(图1)及样品水分含量变化(图2),可以发现这一工序样品细菌总数及样品含水量均为加工过程中的最大,说明槟榔加工中的闷香(含前序的发制)由于温度及水分含量适宜,成为细菌从数量到种类上的增殖阶段,为后续工序减菌带来困难,需重点关注;切籽(BL6)到成品(CP7)中消亡细菌属数量最多,为227个属,切籽(含去核、点卤)后、成品包装前,槟榔企业一般会进行晾籽及一些表面杀菌处理,随着水分含量的下降及表面杀菌处理,成品中由上一工序带来的细菌出现较大幅度的消亡,也是槟榔加工工序中最后一道可以进行有效减菌的工序;新籽(BL1)到煮籽(BL3)工序细菌消亡属的数量位居其次,为216个属,煮籽工序是槟榔加工中唯一的一个热加工工序,后续工序处于对槟榔风味的保持,无法再采用热加工工序,因此,煮籽对于细菌的防控具有一定作用。综上,槟榔加工过程中细菌污染的防控重点应为控制好槟榔发制闷香中的细菌增殖、各工序中的环境污染、用好煮籽工序及成品前工序的减菌措施。
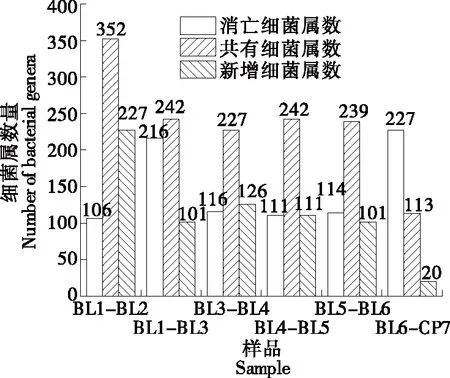
图7 槟榔测序样品相邻工序细菌属数量变化
3 结论
采用Illumina Miseq高通量测序技术对槟榔原籽贮藏和加工过程中细菌多样性和群落结构进行分析。结果表明,槟榔原籽在贮藏过程中,新籽的物种丰富度高于老籽,而老籽拥有更高的物种多样性。7个关键工序样品共检出239个科,790个属,其中Bacillus、Pseudomonas和Hydrogenophaga为优势菌属。通过对关键工序样品的细菌总数、水分含量及细菌属数量进行分析,发现槟榔成果时带来的内生菌属于槟榔比较主要的细菌来源;加工过程中每个工序样品都会受到环境中细菌的污染;新籽贮藏为老籽、煮籽到闷香的工序中新增细菌属数量较多,属于重点防控环节;切籽到成品、新籽到煮籽工序新增细菌属数量较少,属于合适的减菌环节。槟榔鲜果成果时的内生菌在槟榔加工过程中仍占据一定比例,这对槟榔产品的细菌指标有较大影响,如何降低槟榔鲜果的内生菌并保持生产环境的洁净将是今后槟榔加工细菌防控的重点。
