短枝木麻黄内生真菌Y6液体发酵培养基优化
2021-09-19姚成硕尚李华李冠军
姚成硕,尚李华,常 欢,李冠军,李 键
(1.福建农林大学林学院,福建 福州 350002;2.福建省高校森林生态系统过程与经营重点实验室,福建 福州 350002)
植物内生真菌(Endophyte)是指在健康植物组织中具有全部或部分生命周期,不会对宿主植物造成明显病症的微生物[1]。迄今为止,许多研究已经证实内生真菌广泛存在于植物体内[2]。由于内生真菌共生于植物体内,它们的次生代谢产物更容易影响宿主的生理活动,而且许多植物的活性与其内生真菌的次生代谢物活性有相似之处,因此受到了广泛的关注[3]。早期关于内生真菌的研究多集中在药用植物[4],而近年来在生物菌肥的开发利用方面开展了研究工作,取得了比较好的成果:对盐碱地[5]、干旱矿区[6]等不适宜种植作物的土壤进行改良、增加土壤微生物的数量从而提高土壤有机质含量进而提高作物的产量和品质[7]。现有研究表明,内生真菌可以通过提高植物养分利用效率、产生活性物质或产生对植物有益的信号转导、改善土壤质量或改变土壤微生物群落等来增强宿主植物抗逆性[8-10]。内生真菌与宿主植物之间的共生关系是长期共同发育形成的,这些内生真菌从宿主植物中吸取所需的营养物质以完成其生命周期,同时,内生真菌在某些植物的生长发育中起重要作用[11]。如甘蔗中分离得到的内生固氮醋杆菌(Acetobacter diazotrophicus)对其宿主植物具有显著的促生作用[12],其产生的诸如吲哚乙酸等对植物生长起调节作用的物质能够加快甘蔗的生长速度以及提高产量[13]。因此,通过植物自身与微生物互作来增强植物的营养生理和抗性机能在森林可持续经营中有广阔的应用前景。
短枝木麻黄(Casuarina equisetifolia Forst.)属木麻黄科(Casuarinaceae)木麻黄属常绿乔木[14],具有生长快、耐旱、耐盐碱、防风固沙等功能[15],是我国东南沿海地区防护林的主要树种[16],但长期以来,木麻黄人工林始终面临衰退现象和林分更新困难,这主要是由于其生环境恶劣有关[17]。现有研究发现,随着NaCl处理浓度的增加,木麻黄种子的萌发能力、萌发指数和活力指数都呈下降趋势,发芽幼苗的早期生长也受到抑制,且高盐浓度抑制作用更明显,表明高盐含量明显抑制木麻黄种子及幼苗的生长,影响了木麻黄的二次更新[18]。如何提高木麻黄幼苗的耐盐胁迫能力对东南沿海防护林的可持续经营具有重要的现实意义。木麻黄内生真菌具有数量多、多样性丰富、能够生产具有生物活性的代谢物质等优点[19]。
课题组前期研究中从短枝木麻黄的小枝分离得到一株耐盐促生内生真菌,其液体发酵液对寄主植物表现出良好的促生作用[20],内生真菌的液体培养具有生产周期短、产量高、质量控制容易等优点,有利于规模化生产[21-23],因此内生真菌菌液培养条件的优化是菌株开发应用的基础,本研究通过单因子实验和正交实验的方法,探究不同因素对其菌丝体液体发酵的影响,以确定最佳培养条件,研究结果可为木麻黄内生真菌液态菌剂的开发累积实验基础,也为缓解木麻黄在滨海高盐分地更新困难问题提供新思路。
1 材料与方法
1.1 菌种
短枝木麻黄内生真菌Y6(炭团菌属Hypoxylon sp.)是福建农林大学森林生态研究所从短枝木麻黄(15 a)小枝中分离得到,现保藏在中国普通微生物菌种保藏与管理中心,保藏号(CGMCC No.18814),前期实验表明其能提高木麻黄耐盐性[20]。
1.2 培养基
采用改良马丁培养基进行菌种活化和接种制备:蛋白胨2.5 g,酵母膏1.0 g,葡萄糖10.0 g,磷酸二氢钾0.5 g,硫酸镁0.25 g,蒸馏水500 mL,pH值6.2~6.6。将内生真菌在28℃培养7 d,获得平板菌落,用打孔机将菌落分成若干小部分,取出琼脂,接种于同体积的马铃薯葡萄糖液体培养基(PDB)50 mL中。将菌株的种子液放入恒温培养箱在28℃下培养48 h,转速160 r/min。
1.3 实验及分析方法
1.3.1 最佳碳源及其浓度筛选
分别将1%蔗糖、甘露醇、乳糖、麦芽糖、葡萄糖和可溶性淀粉作为培养基的唯一碳源,设3个平行实验[24],以发酵液的菌丝生物量(OD260)作为衡量指标[25],通过比较确定最佳碳源。
1.3.2 最佳氮源及其浓度筛选
分别将2%的尿素,NH4Cl,酵母粉,(NH4)2SO4,NH4NO3,蛋白胨作为培养基的唯一氮源,设3个平行实验[24],将发酵液菌丝生物量(OD260)作为衡量指标[25],通过多次比较确定最佳氮源。
1.3.3 最佳装液量、培养基pH值和接种量筛选
根据前面实验选择最佳碳源和氮源添加到培养基中,将装液量分别设置为20、25、30、35、40、45、50 mL;初始pH值分别调整为pH 5.0、6.0、6.5、7.0、7.5、8.0和8.5。接种量分别为1%,3%,5%,7%,10%。每个条件设3个平行[24],以发酵液菌丝生物量(OD260)为评价指标[25],确定最佳发酵条件。
1.3.4 最佳发酵条件的选择
在碳源和氮源的单因素实验基础上,进一步选择可溶性淀粉浓度、NH4Cl浓度、装液量、培养基pH、接种量作为测试因子,并从单因子实验结果中选择3个最佳数据进行正交实验[26],确定最佳发酵条件。因接种量为10%时的OD值要明显高于其他处理,只有1个最佳数据,故不再对接种量进行下一步的正交实验,最后选择可溶性淀粉浓度、NH4Cl浓度、装液量、培养基pH值进行4因素3水平正交实验(表1)。
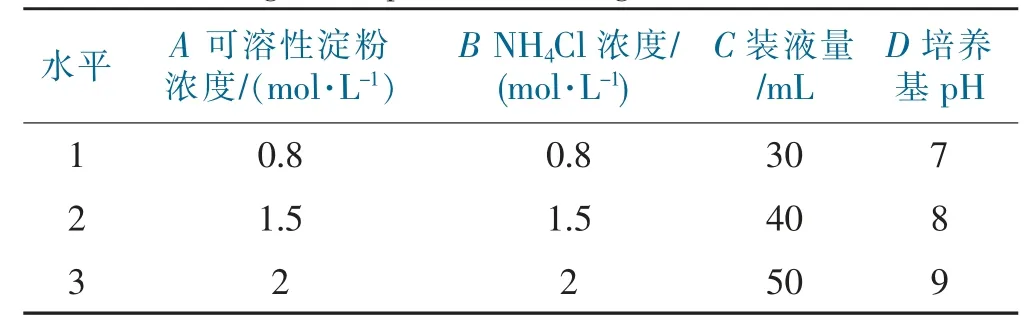
表1 培养条件正交实验设计Tab.1 Orthogonal experimental design of culture conditions
1.3.5 方差分析
通过SPSS 17.0进行单因素方差分析(One-way ANOVA)比较不同处理间的差异[20]。
2 结果与分析
2.1 发酵条件筛选结果
2.1.1 最佳碳源及其浓度筛选
通过单因子实验进行最适培养条件的筛选,菌株Y6最佳碳源是可溶性淀粉(图1 a),可溶性淀粉处理下要显著高于其他组,蔗糖、甘露醇、乳糖、麦芽糖四组处理没有显著差异,葡萄糖处理显著低于其他组(P<0.05),故可溶性淀粉最佳,蔗糖、甘露醇、乳糖、麦芽糖次之,葡萄糖最次;以可溶性淀粉作为唯一碳源,进一步改变其浓度为0.005、0.008、0.015、0.020、0.025 mol/L,不同碳源浓度之间在显著性水平为0.05或0.01的情况下都未表现出显著差异,而浓度为0.008、0.015、0.020 mol/L时菌丝生长量要高于其他两组,故选择这三组进行下一步的发酵条件优化(图1 b)。
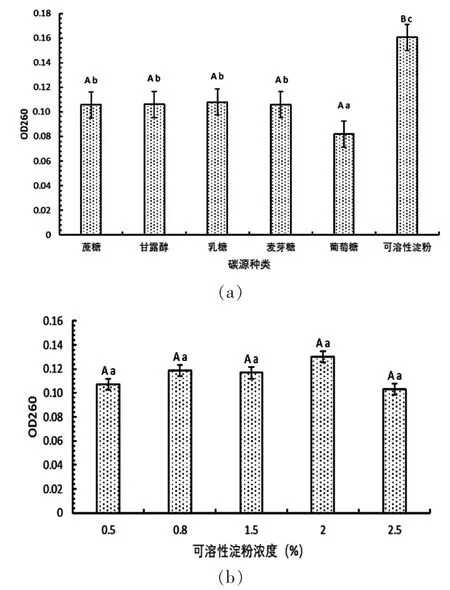
图1 碳源种类和碳源浓度对Y6菌菌丝生长量的影响Fig.1 Effects of carbon source type and carbon source concentration on mycelial growth of Y6
2.1.2 最佳氮源及其浓度筛选
最佳氮源是NH4Cl(图2 a),从图中可知在该条件下菌丝生长量要明显高于其他组(P<0.05)。NH4Cl浓度为0.025 mol/L时菌丝生长量与其他组有显著差异(P<0.01),且显著低于其他组,氮源浓度0.005 mol/L处理与0.008 mol/L处理对菌株生长产生的影响未达到显著差异(P>0.01),因碳氮源浓度过低时不能为菌株生长提供充足的营养物质,故选择氮源浓度(0.008、0.015、0.020 mol/L)3组进行接下来的正交实验(图2 b)。
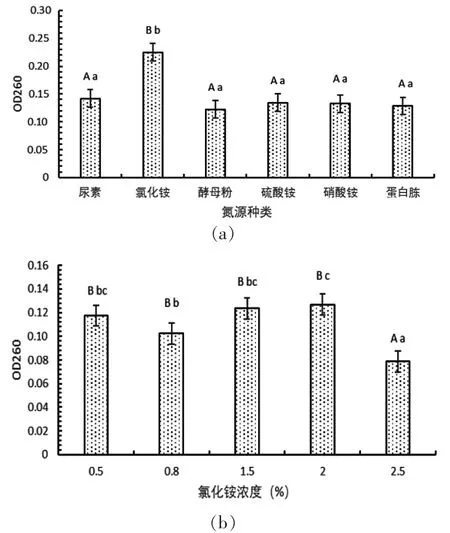
图2 氮源种类和氮源浓度对Y6菌菌丝生长量的影响Fig.2 Effects of nitrogen source type and nitrogen source concentration on mycelial growth of Y6
2.1.3 最佳装液量、培养基pH值和接种量筛选
装液量分别为20、25、30、35、40、45、50 mL进行试验,没有达到显著差异(P>0.05),通过前期单因素实验确定装液量的三水平选择为30、40、50 mL;初始pH值对菌株的生长有明显的影响,从pH值从5升到7的过程中,生长量增长缓慢,pH值从7到7.5的变化中生长量发生了骤增,当pH值为7.5时生长量达到最高,pH值在7.5~8.5范围内没有明显差异(P>0.05),可见Y6菌在偏碱性环境(pH值为7.5~8.5)下更适宜生长,中性环境(pH值为7)次之,酸性环境(pH值为5~6.5)生长更差;随着接种量的增加,生长量逐渐增加,到接种量为10%时达到最大,且显著高于其他四组处理(P<0.01),由此可确定其为最佳用量(图3 a、b、c)。基于前面单因素实验综合考虑,按10%接种量为确定值,以碳源浓度(0.008、0.015、0.020 mol/L)、氮源浓度(0.008、0.015、0.020 mol/L)、装液量(30、40、50 mL)和pH值7、8、9作4因素3水平正交实验。

图3 装液量、pH值和接种量对Y6菌菌丝生长量的影响Fig.3 Effects of liquid medium,pH value and inoculation amount on mycelial growth of Y6
2.2 发酵条件优化
由表2可知,不同营养因素对菌体OD值的影响程度由大到小的顺序为培养基pH值>氮源浓度>装液量>碳源浓度。正交分析得到的最佳水平组合为A2B3C1D2。在此条件下,发酵液D(260)值为0.310,菌丝生物量最高。对该实验进行方差分析(表3),可知pH值对菌体培养有极显著影响(P<0.01),而其他因素对菌体培养影响不显著(P>0.05)。

表2 液体培养条件的正交设计结果Tab.2 Orthogonal design results of liquid culture conditions
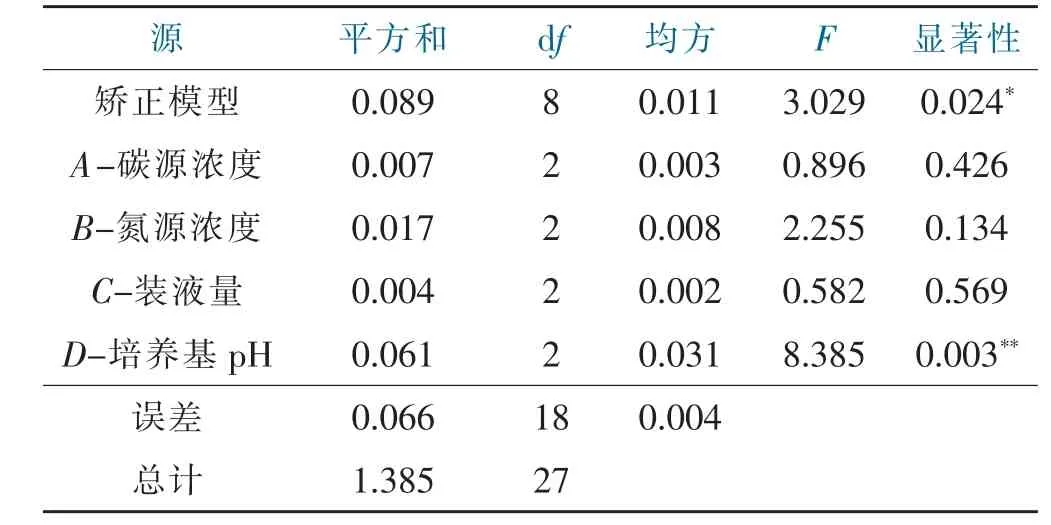
表3 变量A-D的方差分析结果Tab.3 ANOVA results of variables A-D
3 结论与讨论
通过单因子实验和正交实验对短枝木麻黄菌株Y6的液体培养基条件进行优化,首先采用了单因子实验来进行最佳碳源和最佳氮源的筛选,确定可溶性淀粉为最佳碳源,NH4Cl为最佳氮源,最后通过设计四因素三水平的正交实验来考察碳源浓度、氮源浓度、培养基pH、装液量对菌体生长的影响进而选择最佳液体培养条件进行培养基的优化,确定了菌株Y6在可溶性淀粉浓度1.5%,NH4Cl浓度2%,初始pH值8,30 mL装液量,10%接种量的培养条件下最适宜生长,此时的OD值为0.310。
可溶性淀粉作为碳源有利于菌株Y6的生长,且促进生长的效果比其他碳源更为明显。在筛选最佳氮源上,发现铵态氮源有利于菌株生长,尤其是NH4Cl,而有机氮源的效果并不好。在优化培养条件方面,发现相比于微酸环境菌株Y6更适合在pH值7.5~8.5的偏碱性环境下生长,说明相对于酸性胁迫而言其对碱性胁迫具有更强的耐受性,根据耐碱性的特点,可将其种植在大面积盐碱地从而达到改善生态、绿化环境的目的[27]。由于木麻黄长期生长在滨海盐碱地,为适应环境其结构特征发生了变化,叶片退化故只能通过小枝进行光合作用[28]。植物叶绿体基质的pH值在8.0左右,属于偏碱性的条件,其中的多种酶必须在适宜的pH环境下才具有最高的活性[29]。本次实验采用的菌株Y6是从短枝木麻黄小枝分离得到的,菌株Y6适宜在偏碱性环境中生存,以保证植物的生长发育。由于本次实验所设的pH值水平梯度有限,在强酸强碱环境中菌株的生长情况还有待进一步研究。
单因子实验和正交实验是大多数内生真菌液体培养基优化时用来确定最佳培养条件的方法,也有在单因素实验的基础上运用其他技术来进行优化的。液体发酵过程中影响因素十分复杂,不同影响因素之间存在着交互作用,仅仅通过单因子实验和正交实验往往无法获得很好的预期结果[30]。而采用响应曲面法就可以既优化影响液体发酵的因子的交互作用,又简化实验次数[31]。本实验欠缺一组未优化前的培养基进行对照,无法得知优化后生长量的提高率。本次研究通过探究菌株Y6最适宜的液体培养条件,为进一步的规模化生产奠定了基础,但存在着采用的方法较为简单、划分的浓度梯度较低等问题,因此如何改善优化方法,提高产量是下一步研究的重点。
