不同种类的脂肪酸对肝细胞脂质堆积的研究
2021-09-18尹震张晓琳田金英姜楠李雪晨叶菲
尹震 张晓琳 田金英 姜楠 李雪晨 叶菲
摘 要:目的:比较不同种类的脂肪酸对人肝癌细胞(HepG2)脂质堆积的影响。方法:HepG2细胞随机分为对照组(Con)、棕榈酸组(PA)、油酸组(OA)、亚油酸组(LA)和亚麻酸组(ALA)。培养24 h后,以MTT法比较不同种类脂肪酸对肝细胞存活率的影响;同一浓度下,以油红O染色法比较,各组细胞内脂滴生成情况拍照并测量吸光度;以酶学法检测各组细胞内甘油三酯含量比较不同种类脂肪酸对肝细胞脂质堆积的影响。结果:确定了每种脂肪酸诱导的浓度为50 μmol/L,同一浓度下,随着PA、OA、LA、ALA各组脂肪酸的不饱和度依次增加,PA、OA、LA、ALA各组细胞内脂滴依次增多,细胞内TG含量依次升高。与对照组相比,PA无统計学差异,OA存在显著性差异(P<0.05),而LA和ALA分别存在极显著性差异(P<0.001)。且对每种脂肪酸诱导的肝细胞脂质堆积程度进行统计学分析,均存在显著性差异(P<0.05)。结论:同一条件下,不同种类的脂肪酸对肝细胞活力和脂质堆积程度的影响不同,提示可能与脂肪酸的不饱和度有关,不饱和度越高的脂肪酸对细胞脂质堆积作用越明显。
关键词:脂肪酸;肝细胞;细胞活力;脂质堆积
非酒精性脂肪性肝病(NAFLD)是指无明确过量饮酒史和其他致病因素,以肝脏内脂肪过度堆积为主要特征的临床病理综合征,其疾病谱包括单纯性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)、纤维化、肝硬化和肝癌[1]。在发达国家,NAFLD 的发病率已达到 20%~30%,在发展中国家,NAFLD 的发病率也在逐渐上升[2]。随着人们生活方式、膳食结构的改变,NAFLD 已成为世界范围内常见的慢性疾病之一。目前,对NAFLD 的治疗尚无良好的药物,在其NAFL 阶段多采用控制饮食、增加运动的方法,发展到NASH 阶段多以保肝类药物和对症治疗为主,均不能满足广大患者的需求。NAFLD 的主要病因是胰岛素抵抗等因素引起肝脏脂代谢紊乱,脂类尤其是甘油三酯(TG)在肝脏的堆积。当肝脏 TG 的含量超过肝重的5%时,便认为NAFLD发生[3]。
膳食脂肪酸摄入过多是导致体内脂代谢失衡的首要原因[4]。脂肪酸,是指一端含有一个羧基的长的脂肪族碳氢链的有机物,根据碳链中碳原子间双键的数目可将脂肪酸分为饱和脂肪酸(SFA)(不含双键)、单不饱和脂肪酸(MUFA)(含1个双键)和多不饱和脂肪酸(PUFA)(含1个以上双键)三类[5]。当机体处于肥胖、2 型糖尿病等代谢异常状态下,肝脏的脂质输入和输出的平衡被打破,最终导致肝脏内脂质的堆积和脂肪肝的形成[6]。因此,NAFLD 的防治策略中,抑制脂肪在肝脏中的堆积显得尤为重要。
脂肪酸主要在肝脏内代谢,然而在生理条件下获得人肝脏细胞非常困难,且正常人肝脏细胞个体差异大,难于稳定地传代培养,因此不利于长期研究肝脏脂质代谢。人肝癌细胞株HepG2是目前常用的研究体外脂代谢细胞模型[7]。应用外源性脂肪酸诱导肝细胞形成脂质堆积模型,从而进行降脂药物的体外筛选及其作用机制的研究。
有软脂酸又称棕榈酸,是一种饱和高级脂肪酸,以甘油酯的形式广泛存在于各种油脂中,是细胞膜的重要组成成分,可诱导肝细胞形成胰岛素抵抗模型。油酸为MUFA中最为代表性的一种脂肪酸,广泛存在于动物脂肪和植物油中,在鱼油、棕榈油、橄榄油等中含量较高。PUFA中的亚油酸和α-亚麻酸在体内不能自身合成,需由食物提供,所以这些脂肪酸又称为必需脂肪酸[8]。研究表明,膳食脂肪摄入过多、膳食脂肪酸不平衡等是导致脂肪肝的主要危险因素[9-10]。众所周知,不同种类脂肪酸对肝细胞脂质堆积的影响不同[11],但目前为止,未有各种脂肪酸对肝细胞HepG2的作用进行系统的研究。尤其是针对不饱和程度不同的脂肪酸在肝细胞脂质堆积形成过程中的作用鲜见报道。不同种类的脂肪酸对肝细胞脂质堆积产生不同影响的原因是否和脂肪酸本身的不饱和程度有关,是一个值得研究的课题。故本研究采用具有代表性的棕榈酸(PA,饱和脂肪酸)、油酸(OA,单不饱和脂肪酸)、亚油酸(LA,多不饱和脂肪酸,含2个双键)、α-亚麻酸(ALA,多不饱和脂肪酸,含3个双键)分别刺激HepG2细胞,比较了不饱和度不同的脂肪酸对肝细胞脂质堆积的影响。
1 材料与方法
1.1 材料
HepG2细胞株,中国医学科学院基础医学研究所细胞资源中心;胎牛血清(FBS)、二甲基亚砜(DMSO)、MEM培养基,Gibco公司;PA、OA、LA、ALA、脱脂牛血清白蛋白(BSA)、油红O染液,美国Sigma公司;四甲基偶氮唑盐(MTT),Amresco公司;TG 测定试剂盒,北京普利莱基因生物技术公司。
酶标仪μ-Quant,美国BIO-TEK公司;磁力搅拌器,德国IKA公司;THZ-C型全温空气恒温振荡器,太仓科教仪器厂;高速低温离心机,德国Heraus公司;电子天平,德国赛多利斯公司;超低温冰箱,日本SANYO公司。
1.2 方法
1.2.1 细胞培养 人HepG2肝癌细胞株,接种于25 cm2培养瓶,用含10%胎牛血清的MEM高糖培养基,37℃(5%CO2)细胞培养箱内培养,待细胞生长至80%~90%密度时用胰蛋白酶消化,按1∶3比例传代。
1.2.2 脂肪酸储备液的配置(10 mmol/L) 准确称取4种脂肪酸,分别溶解到含5%BSA的PBS缓冲液中,使每种脂肪酸的终浓度为10 mmol/L,充分搅拌,在70℃的水浴锅中加热10 min,过滤除菌,4℃保存。
1.2.3 细胞存活率测定 实验分为5组,对照组(Con)添加与脂肪酸组终浓度相同的BSA作溶剂对照,PA、OA、LA和ALA。将对数期生长的细胞经胰酶消化成单个细胞,接种96孔板,每孔接种2×104个细胞。细胞正常培养24 h,弃上清,PBS润洗,每个浓度设置4个复孔,各组加入终浓度为1、10、50、100、150、200、250 μmol/L不同种类的脂肪酸分别处理HepG2细胞24 h。MTT法测定细胞存活率:
细胞存活率(%)=实验组OD值/空白组OD值×100%(1)
1.2.4 油红O染色 实验分为5组,Con添加与脂肪酸组终浓度相同的BSA作溶剂对照,PA、OA、LA和ALA。将对数期生长的细胞经胰酶消化成单个细胞,接种96孔板,每孔接种2×104个细胞。细胞正常培养24 h,弃上清,PBS润洗,每个浓度设置3个复孔,终浓度为50 μmol/L不同种类的脂肪酸处理细胞24 h之后,弃上清,PBS洗涤2遍,用4%多聚甲醛固定10 min,0.5%油红O染液室温染色15 min,60%异丙醇漂洗30 s,蒸馏水洗30 s至背景透明。于倒置显微镜下拍照观察细胞内脂滴形成情况后,用异丙醇提取,在510 nm处测定吸光度值,吸光度值直接反映细胞内红色脂滴的多少进一步评价脂质堆积程度[12]。
1.2.5 胞内甘油三酯(TG)含量的测定 将对数期生长的细胞经胰酶消化成单个细胞,接种6孔板,每孔接种2×105个细胞。细胞正常培养24 h,弃上清,PBS润洗,实验分为5组,Con、PA、OA、LA、ALA,每个浓度设置4个复孔,Con添加与脂肪酸组终浓度相同的BSA作溶剂对照,其余每组加入终浓度为50 μmol/L的脂肪酸分别处理HepG2细胞24 h,收取细胞后用试剂盒测定细胞内TG含量,结果用蛋白浓度校准。
1.2.6 统计学分析 各组数据以(±s)表示,采用Prism 5统计软件。所有数据通过t检验的方法进行统计学分析,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 不同种类脂肪酸对肝细胞存活率的影响
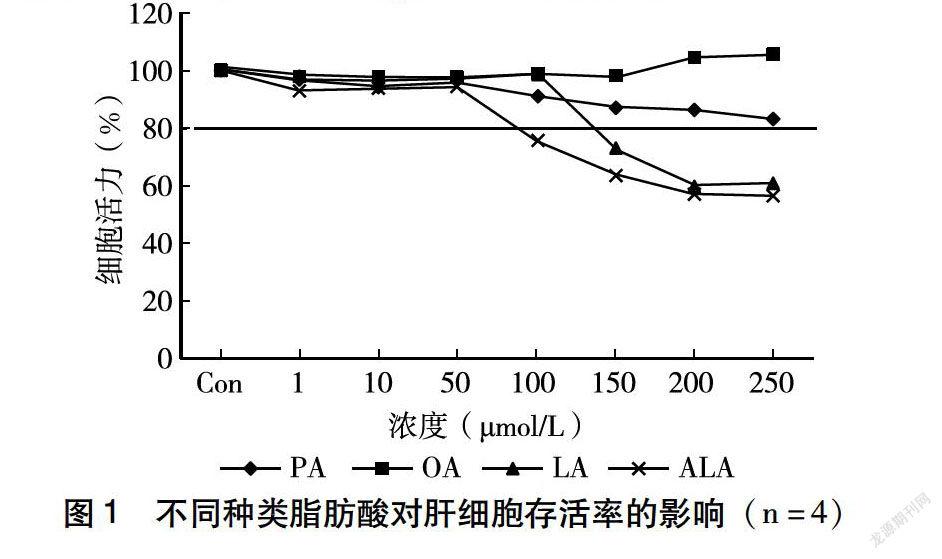
为了评估4种脂肪酸对HepG2的细胞毒作用,用MTT法测定了不同浓度的4种脂肪酸分别对肝细胞存活率的影响。如图1所示,终浓度为1~250 μmol/L不同种类的脂肪酸分别处理HepG2细胞,PA随着浓度的升高,细胞存活率降低,但均高于80%;OA随着浓度的升高,细胞存活率均高于80%;LA当浓度为150~250 μmol/L时,细胞存活率均低于80%;ALA浓度为100~250 μmol/L时,细胞存活率均低于80%。在一定剂量(0~50 μmol/L)范围内,4种脂肪酸对HepG2细胞活力影响不大(细胞存活率>80%),所以后续实验均采用浓度为50 μmol/L的脂肪酸诱导肝细胞。
2.2 不同种类脂肪酸对肝细胞脂质堆积的影响
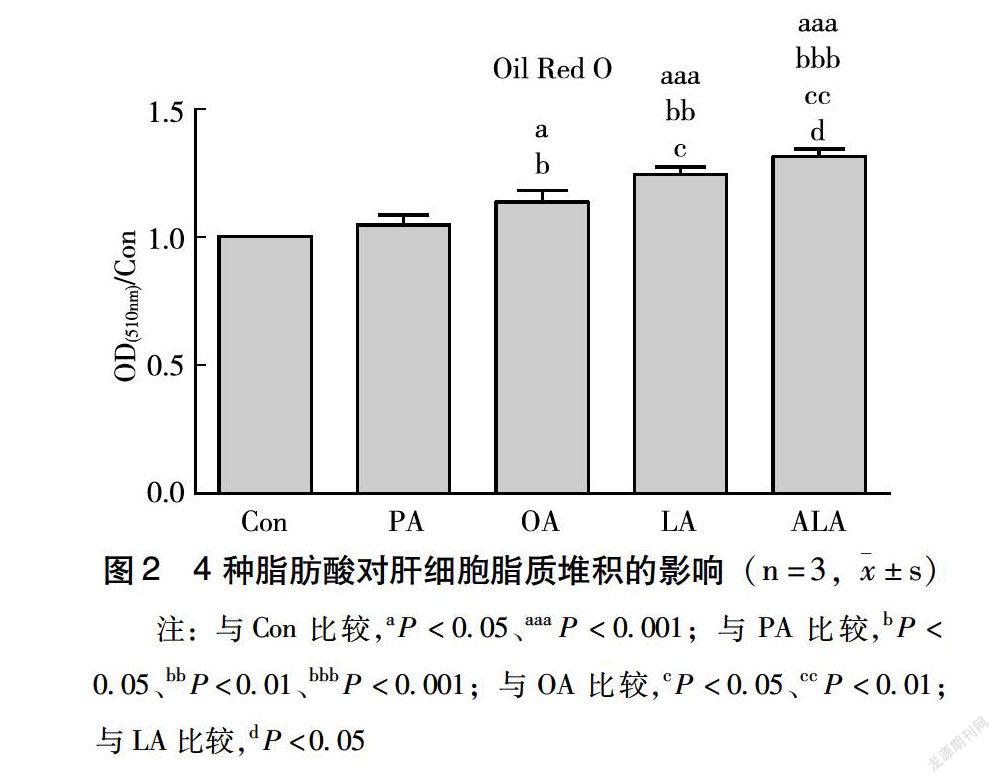
如图2所示,油红O半定量结果表明,与Con相比,PA诱导的肝细胞内脂质堆积程度无统计学意义。与Con相比,OA诱导的肝细胞内脂质堆积程度显著升高了0.14倍(P<0.05),LA、ALA诱导的肝细胞内脂质堆积程度分别显著升高了0.25、0.31倍(P<0.001)。与PA相比,OA诱导的肝细胞内脂质堆积程度显著升高了0.09倍(P<0.05),LA诱导的肝细胞内脂质堆积程度显著升高了0.19倍(P<0.01),ALA诱导的肝细胞内脂质堆积程度显著升高了0.25倍(P<0.001)。与OA相比,LA诱导的肝细胞内脂质堆积程度显著升高了0.09倍(P<0.05),ALA诱导的肝细胞内脂质堆积程度显著升高了0.15倍(P<0.01)。与LA相比,ALA诱导的肝细胞内脂质堆积程度显著升高了0.05倍(P<0.05)。根据油红O半定量结果可知,同一浓度下,不饱和度不同的脂肪酸对肝细胞脂质堆积程度影响不同。
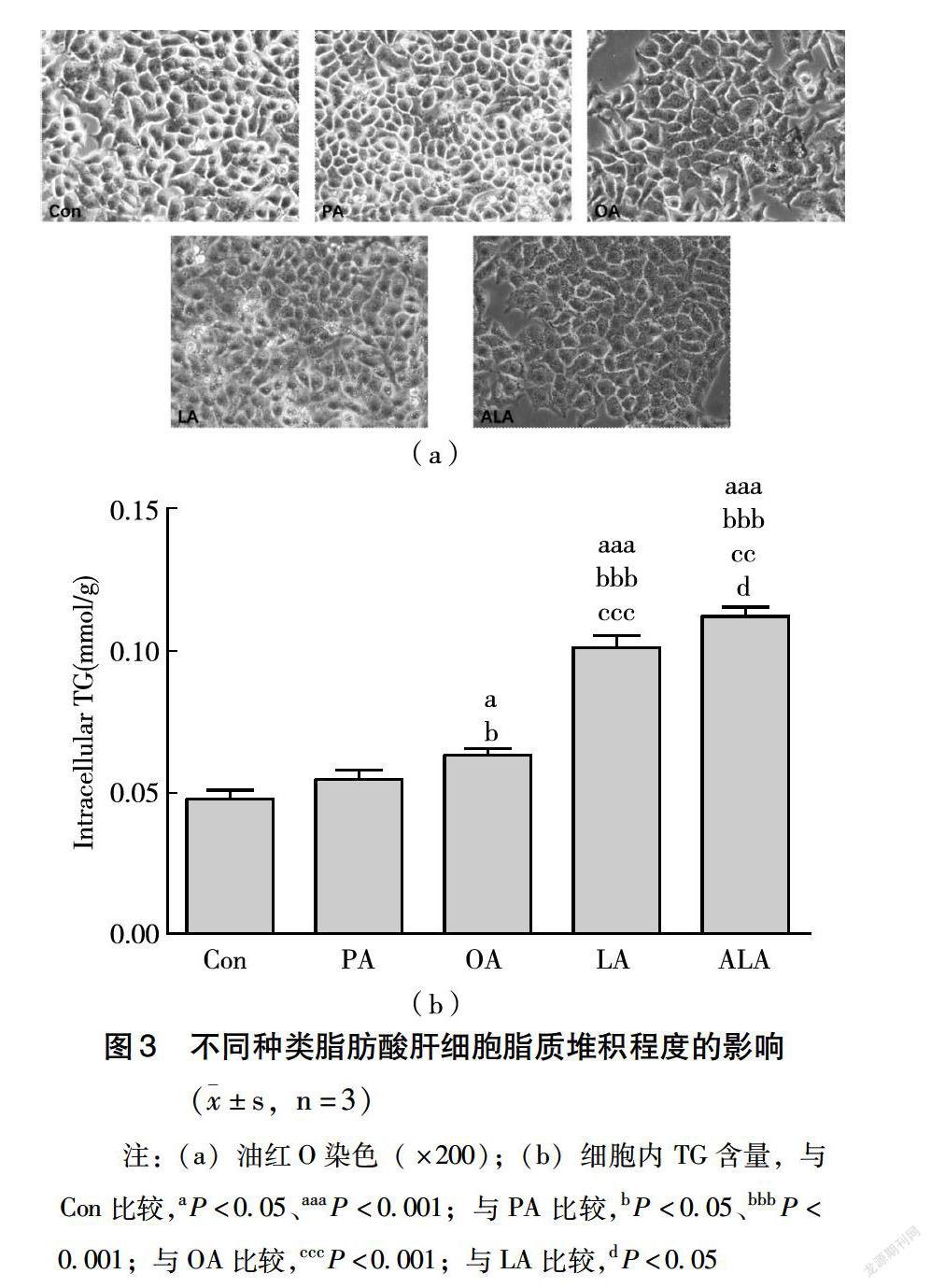
每组加入终浓度为50 μmol/L的脂肪酸分别处理HepG2细胞24 h,进行油红O染色和细胞内TG含量检测。如图3(a)所示,Con、PA、OA、LA、ALA各组细胞内脂滴依次增多。收集细胞,用试剂盒测定细胞内TG含量,实验结果与油红O染色结果一致。如图3(b)所示,与Con相比,PA诱导后细胞内TG含量无显著性差异,OA诱导后细胞内TG含量显著升高了0.33倍(P<0.05,LA和ALA诱导的细胞内TG含量分别显著升高了1.17、1.38倍(P<0.001);与PA相比,OA诱导后细胞内TG含量显著升高了0.16倍(P<0.05),LA诱导后细胞内TG含量显著升高了0.89倍(P<0.001),ALA诱导后细胞内TG含量显著升高了1.07倍(P<0.001);与OA相比,LA诱导后细胞内TG含量显著升高了0.63倍(P<0.001),ALA诱导后细胞内TG含量显著升高了0.79倍(P<0.001);与LA相比,ALA诱导后细胞内TG含量显著升高了0.1倍(P<0.05)。油红O染色和细胞内TG含量检测结果显示,同一浓度下,随着PA、OA、LA、ALA各组脂肪酸的不飽和度依次增加,PA、OA、LA、ALA各组细胞内脂滴依次增多,细胞内TG含量依次升高,且每种脂肪酸之间进行统计学分析,均存在显著性差异(P<0.05)。由此可以得出,同一浓度下,不饱和度不同的脂肪酸对肝细胞脂质堆积程度不同。由此推测不饱和度越高的脂肪酸对细胞脂质堆积作用越明显。
3 讨论
NAFLD是与胰岛素抵抗、肥胖和脂质代谢异常等密切相关的代谢性肝损伤疾病[13-15]。在NAFL及NASH阶段,其病程是可逆的,但当疾病进入肝纤维化以后,病程将很难逆转。NAFLD 已经成为全球的主要公共问题之一。15%~30%的成年人有NAFLD,而在肥胖和糖尿病群体中,70%以上有NAFLD,可见NAFLD对人类健康的威胁非常大。NAFLD的病因和发病机理一直存在争议,且迄今为止尚未发现治疗 NAFLD的特效药物[16]。尽管大多数单纯性脂肪肝患者短期内无明显肝功能损伤,但长期的脂肪肝有发展成NASH,肝硬化甚至肝癌的危险[17],可见NAFLD已严重威胁人类的身体健康,必须引起高度重视。膳食脂肪酸摄入过多或脂肪酸不平衡,可导致血浆中饱和脂肪酸升高,使肝脏脂肪蓄积增多。膳食脂肪酸包括SFA、MUFA和PUFA,它们是细胞膜的重要组成部分,在一定条件下维持机体血糖和血脂的相对稳定[18]。肝脏是调节糖脂代谢的重要场所[19],机体摄入脂肪酸的种类和数量能够影响肝脏在糖脂代谢中的调控作用。
探究不同种类的脂肪酸对肝细胞脂质堆积的作用十分重要,针对作用不同的脂肪酸我们可以靶向的进行降脂药物的体外筛选实验,同时明确不同种类的脂肪酸对肝细胞的作用机制可以指导人们合理搭配膳食脂肪酸的种类以预防和缓解疾病的发生。基于以上分析,本研究选用PA(饱和脂肪酸)、OA(单不饱和脂肪酸)、LA(多不饱和脂肪酸,含2个双键)、ALA(多不饱和脂肪酸,含3个双键)分别刺激HepG2细胞,通过MTT、油红O染色、细胞内TG测定等实验,观察不同不饱和度、同一剂量下的外源性脂肪酸对HepG2细胞脂质堆积的影响。
MTT实验反映细胞的活性强度[20],根据MTT结果确定了每种脂肪酸诱导的浓度为50 μmol/L,以比较不同种类脂肪酸对肝细胞脂质堆积的影响。油红O是脂肪染色的最敏感染料[21],可将细胞内中性脂质染成红色,细胞内红色脂滴的多少可反映细胞脂质堆积的程度。根据油红O染色结果发现,通过半定量检测和镜下观察细胞内脂质堆积情况,可以直观地看出每种脂肪酸诱导的肝细胞内脂滴的数量存在明显的差异。
在不同种类脂肪酸对肝细胞内TG含量影响的实验中,实验结果与油红O染色结果一致,而利用试剂盒测定的细胞内TG含量更为精确。不同种类脂肪酸诱导的肝细胞内TG含量随着4种脂肪酸不饱和度的升高而升高,与对照组相比,饱和脂肪酸PA的肝细胞脂质堆积程度无统计学差异,单不饱和脂肪酸OA的肝细胞脂质堆积程度存在显著性差异(P<0.05),而多不饱和脂肪酸LA和ALA的肝细胞脂质堆积程度分别存在极显著性差异(P<0.001),且对每种脂肪酸诱导的肝细胞脂质堆积程度进行统计学分析,均存在显著性差异(P<0.05)。
综上所述,不同种类的脂肪酸对肝细胞活力和脂质堆积程度的影响不同,提示可能与脂肪酸的不饱和程度有关,不饱和度越高的脂肪酸对细胞脂质堆积作用越明显,这一结论为今后建立不同种类脂肪酸诱导肝细胞脂质堆积药物筛选模型提供了方向,但本实验针对每种脂肪酸仅选取了其中具有代表性的一种进行研究,今后还应增加研究深度并进一步探讨脂肪酸影响肝细胞脂质堆积的作用机制。◇
参考文献
[1]王瑶芬.非酒精性脂肪性肝病的研究综述[J].临床荟萃,2014,29(4):474-477.
[2]Giorgio B,Valerio N,Claudio T.Epidemiology of fatty liver:an update[J].World Journal of Gastroenterology,2014,20(27):9050-9054.
[3]Rahimi R S,Landaverde C.Nonalcoholic fatty liver disease and the metabolic syndrome:clinical implications and treatment[J].Nutr Clin Pract,2013,28(1):40-51.
[4]Zelber-Sagi S,Nitzan-Kaluski D,Goldsmith R,et al.Long term nutritional intake and the risk for non-alcoholic fatty liver disease (NAFLD):a population based study[J].J Hepatol,2007,47(5):711-717.
[5]陳银基,鞠兴荣,周光宏.饱和脂肪酸分类与生理功能[J].中国油脂,2008(3):35-39.
[6]Brumbaugh D E,Friedman J E.Developmental origins of nonalcoholic fatty liver disease[J].Pediatr Res,2014,75(1-2):140-147.
[7]宋旭霞,闫志勇,王斌,等.体外培养的肝癌细胞株与正常肝细胞株蛋白质的差异表达[J].世界华人消化杂志,2005(22):2689-2692.
[8]杨立杰,杨在宾,姜淑贞.必需脂肪酸对动物的功能及其需要量再认识[J].饲料工业,2016,37(12):31-33.
[9]Morisco F,Vitaglione P,Amoruso D,et al.Foods and liver health[J].Mol Aspects Med,2008,29(1-2):144-150.
[10]Gentile C L,Pagliassotti M J.The role of fatty acids in the development and progression of nonalcoholic fatty liver disease[J].J Nutr Biochem,2008,19(9):567-576.
[11]崔秋英,霍丽静,贾敏,等.高脂饮食中不同脂肪酸类型与胰岛素敏感性的相关性研究[J].现代预防医学,2013,40(9):1630-1633.
[12]Alkhatatbeh M J,Lincz L F,Thorne R F.Low simvastatin concentrations reduce oleic acid-induced steatosis in HepG2 cells:An in vitro model of non-alcoholic fatty liver disease[J].Exp Ther Med,2016,11(4):1487-1492.
[13]Dietrich P,Hellerbrand C.Non-alcoholic fatty liver disease,obesity and the metabolic syndrome[J].Best Pract Res Clin Gastroenterol,2014,28(4):637-653.
[14]Metin B,Serra K,Nevin Y,et al.Understanding mechanisms of the pathogenesis of nonalcoholic fatty liver disease[J].World Journal of Gastroenterology,2010,16(18):2223-2226.
[15]L S,Lm A,R Q,et al.Hepatic expression of adiponectin receptors increases with non-alcoholic fatty liver disease progression in morbid obesity in correlation with glutathione peroxidase 1[J].Obesity surgery,2011,21(4):492-500.
[16]Sanal M G.The blind men ‘see’ the elephant-the many faces of fatty liver disease[J].世界胃腸病学杂志,2008,14(6):831-844.
[17]Friedman S L,Neuschwander-Tetri B A,Rinella M,et al. Mechanisms of NAFLD development and therapeutic strategies[J].Nat Med,2018,24(7):908-922.
[18]Calder P C.Functional roles of fatty acids and their effects on human health[J].JPEN J Parenter Enteral Nutr,2015,39(1 Suppl):18S-32S.
[19]Koo S H.Nonalcoholic fatty liver disease:molecular mechanisms for the hepatic steatosis[J].Clin Mol Hepatol,2013,19(3):210-215.
[20]白生宾,陈红香,钟近洁,等.MTT法检测RAW264.7细胞活力及可能因素分析[J].中国现代医学杂志,2011,21(23):2831-2833.
[21]Mehlem A,Hagberg C E,Muhl L,et al.Imaging of neutral lipids by oil red O for analyzing the metabolic status in health and disease[J].Nat Protoc,2013,8(6):1149-1154.
Effects of Different Types of Fatty Acids on Lipid Accumulation in Hepatocytes
YIN Zhen,ZHANG Xiao-lin,TIAN Jin-ying,JIANG Nan,LI Xue-chen,YE Fei
(Institute of Materia Medica,Chinese Academy of Medical Sciences/Peking Union Medical College Center for Drug Evaluation/Beijing Key Laboratory of New Drug Action Mechanism and Evaluation,Beijing 100050,China)
Abstract:ObjectiveTo compare the effects of different types of fatty acids on lipid accumulation in human liver cancer cells (HepG2).MethodHepG2 cells were randomly divided into control group (Con),palmitic acid group (PA),oleic acid group (OA),linoleic acid group (LA)and linolenic acid group (ALA).After 24 h culture,the effects of different fatty acids on the survival rate of hepatocytes were compared by MTT method.At the same concentration,the formation of lipid droplets in each group was photographed and the absorbance was measured by oil red O staining.The effects of different fatty acids on lipid accumulation in hepatocytes were compared by enzymatic method.ResultThe concentration induced by each fatty acid was determined to be 50 μmol/L.At the same concentration,as the fatty acid unsaturation of PA,OA,LA and ALA increased successively,the intracellular lipid droplets of PA,OA,LA and ALA increased successively,and the intracellular TG content increased successively.Compared with the control group,there was no statistical difference in PA,a significant difference in OA (P<0.05),and a very significant difference in LA and ALA (P<0.001).Moreover,statistical analysis of the lipid accumulation degree of each fatty acid induced hepatocytes showed significant differences (P<0.05).ConclusionUnder the same condition,different types of fatty acids have different effects on liver cell viability and lipid accumulation degree,suggesting that fatty acid unsaturation may be related to the degree of unsaturation of fatty acid.The higher the degree of unsaturation,the more obvious the effect of fatty acids on lipid accumulation.
Keywords:fatty acid;liver cell;cellular viability;lipid accumulation