三阴方治疗三阴性乳腺癌的临床疗效与药理学研究
2021-09-18郝志晔卢雯平钱伟崔莎莎
郝志晔 卢雯平 钱伟 崔莎莎

摘要 目的:探討三阴方治疗晚期三阴性乳腺癌(TNBC)的临床疗效、活性成分及作用机制。方法:选取2018年3月至2019年10月中国中医科学院广安门医院收治的Ⅳ期TNBC患者52例作为研究对象,均给予三阴方,每日1剂,观察患者的无进展生存期(PFS)和临床疗效。依托中药系统药理学数据库与分析平台(TCMSP)检索并筛选三阴方的有效成分和作用靶标,应用GeneGards数据库对三阴性乳腺癌靶标进行检索进而构建成分靶点网络、构建蛋白质-蛋白质相互作用(PPI)网络,并对靶标进行基因本体(GO)功能富集分析、京都基因与基因组百科全书(KEGG)通路富集分析,构建靶点-通路网络图。结果:经三阴方治疗后,患者的中位PFS为(8.64±1.87)个月,客观缓解率为34.6%,疾病控制率为82.7%,卡氏评分和FACT-B评分均有改善,疗效显著。网络药理学研究共筛选出三阴方与三阴性乳腺癌重合靶标110个,GO及KEGG富集分析预测出与疾病相关的多条作用通路。结论:三阴方是治疗晚期三阴性乳腺癌的有效方剂,可延长患者的PFS,提高临床疗效及生命质量。本研究预测三阴方治疗晚期三阴性乳腺癌的主要活性成分为黄酮类及甾醇类化合物,主要调节靶标是AKT1、MAPK1、RELA,可能通过作用于PI3K-AKT、TNF、p53等信号通路对晚期三阴性乳腺癌起到治疗作用。
关键词 三阴方;治疗;晚期;三阴性乳腺癌;临床疗效;药理学研究;活性;作用机制
Clinical Research and Pharmacology Study on Sanyin Decoction in the Treatment of Triple-Negative Breast Cancer
HAO Zhiye,LU Wenping,QIAN Wei,CUI Shasha
(Guanganmen Hospital,China Academy of Chinese Medical Sciences,Beijing 100053,China)
Abstract Objective:To explore the clinical effect,active ingredients and action mechanism of Sanyin Decoction in the treatment of advanced triple-negative breast cancer.Methods:A total of 52 cases of stage IV triple-negative breast cancer patients were selected as the research objects and were given Sanyin Decoction,one dose a day.The progress-free survival(PFS) and clinical effect of the patients were observed.Based on TCMSP,we searched and screened the effective components and targets of Sanyin Decoction.The triple-negative breast cancer targets were searched in the GeneGards database and then the component target network and protein interaction(PPI) network were constructed.The target was analyzed by go function enrichment,KEGG pathway enrichment and the target pathway network map was constructed.Results:The median PFS were 8.64±1.87 months,the objective remission rate and the disease control rate were 34.6% and 82.7%,respectively after the treatment with Sanyin Decoction.Both the casabella score and the FACT-B score were improved significantly,showing significant curative effect.A total of 110 overlapping targets of Sanyin Decoction and triple-negative breast cancer were selected by network pharmacology research.Go and KEGG enrichment analysis predicted multiple disease-related pathways.Conclusion:Sanyin Decoction is an effective prescription for the treatment of advanced triple negative breast cancer,which can improve prolong PFS,the clinical efficacy,and improve quality of life in advanced triple-negative breast cancer patients.This study predicts that the main active components of Sanyin Decoction in the treatment of advanced triple-negative breast cancer are mainly flavonoids and sterols,the main regulatory targets are AKT1,MAPK1,RELA,which might be related to PI3K-AKT,TNF,p53 and so on signal pathway and plays a therapeutic role in advanced triple-negative breast cancer.
Keywords Sanyin Decoction; Treatment; Advanced; Triple-negative breast cancer; Clinical efficacy; Pharmacology research; Active ingredients; Action mechanism
中图分类号:R289.5;R966文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.16.023
乳腺癌是世界上女性最多发的恶性肿瘤,在全球女性恶性肿瘤中居首位,严重危害女性健康[1]。三阴性乳腺癌(Triple-negative Breast Cancer,TNBC)是乳腺癌分子分型中的一种特殊类型,约占所有乳腺癌的15%,确诊后5年生存率明显低于其他类型乳腺癌患者[2-3]。因其雌激素受体(Estrogen Receptor,ER),孕激素受体(Progesterone Receptor,PR),人表皮生长因子受体(Human Epidermal Growth Factor Receptor 2,HER-2)均不表达,使此类患者不能从靶向治疗及内分泌治疗中获益,因此,治疗仍以化疗为主要手段,且通常复发转移发生较早,TNBC一旦发生转移,对化疗的敏感度显著降低,中位生存时间缩短至6个月以下[4],对其他类型乳腺癌治疗有效的药物通常对TNBC无效[5],尤其是对于晚期患者,临床上仍需寻找新的治疗方法。
中医学在治疗乳腺癌方面有一定疗效。为进一步寻找有效的治疗方剂,总结研究卢雯平教授应用三阴方(即逍遥散合理冲汤化裁方)治疗晚期TNBC的临床经验。采用临床疗效观察和网络药理学方法,验证该方在临床上的疗效,同时构建药物与TNBC共有的靶点,探讨该汤剂治疗晚期TNBC的有效成分及分子作用机制,旨在为中医药治疗晚期TNBC的研究提供进一步科学依据。
1 资料与方法
1.1 一般资料 选取2018年3月至2019年10月中国中医科学院广安门医院收治的Ⅳ期TNBC患者52例作为研究对象,年龄36~75岁,平均年龄(55±12)岁。
1.2 诊断标准 西医诊断标准参照《NCCN乳腺癌筛查和诊断临床实践指南》[6];中医辨证标准参照国家中医药管理局《中医病证诊断疗效标准》[7],分为肝郁痰凝、冲任失调、正虚毒炽三型。
1.3 納入标准 1)确诊为Ⅳ期乳腺癌的成年女性,有证据显示存在不可切除或不能行根治放疗的局灶复发性病灶或转移病灶,不伴内脏危象和其他快速进展性疾病。2)组织学或细胞学免疫组织化学结果ER(-),PR(-),HER-2(-);3)所有患者依据美国国家癌症综合网(National Comprehensive Cancer Network,NCCN)乳腺癌治疗指南,接受规范治疗,不伴内脏危象和其他快速进展性疾病;4)可测量病灶满足以下条件或仅单纯的骨转移病灶:a.对于非淋巴结,至少一处病灶的最长直径≥1.0 cm,或者对于淋巴结,至少一处病灶的短轴直径≥1.5 cm;如果只有一处靶病灶且为非淋巴结,则其最长直径应≥1.5 cm;b.接受过外照射放疗或局部区域治疗(如射频消蚀)的病灶,必须显示出疾病进展证据(根据实体瘤疗效评价标准1.1),以作为靶病灶使用;5)ECOG评分0~2分。
1.4 排除标准 1)疾病晚期、出现症状、内脏扩散、在短期内有发生危及生命的并发症者;2)妊娠、哺乳及拒绝采取避孕措施的女性患者;3)预期寿命小于3个月者。
1.5 脱落与剔除标准 已入组病例但符合以下之一者,应剔除:1)误诊;2)符合排除标准者;3)未曾用药者;4)无任何检测记录者;5)由于使用某种禁用的药物,以致无法评价药效者。
1.6 治疗方法 所有患者依据美国国家癌症综合网乳腺癌治疗指南接受规范治疗。在此基础上患者均给予三阴方(即逍遥散合理冲汤化裁方),基础方:黄芪30 g、白术15 g、三棱6 g、莪术9 g、柴胡12 g、白芍20 g、枸杞子15 g、青蒿15 g、党参10 g、天花粉10 g、白花蛇舌草15 g。临床可随证加减,肝郁痰凝证加薄荷6 g、瓜蒌15 g;冲任失调证加淫羊藿15 g、巴戟天15 g;正虚毒炽证加蒲公英15 g。根据转移部位不同加减,骨转移者加威灵仙10 g、杜仲10 g;肝转移者加茵陈6 g、八月札20 g、鳖甲6 g;肺转移者加桔梗9 g、麦冬20 g;脑转移者加菖蒲15 g、全蝎5 g。水煎服,每日1剂,分2次早晚服药,治疗8周。
1.7 观察指标 1)主要观察指标:无进展生存期(PFS)和临床疗效。无进展生存期(PFS)为从研究药物的首次给药时间开始至疾病进展时间。2)次要观察指标:卡氏评分、生命质量等。对患者基线和治疗4、8周后的卡氏评分、乳腺癌生命质量测定表(FACT-B)评分进行比较。FACT-B评分包括生理、情感、功能状况、社会/家庭情况和其他问题等5个维度,评分越高说明生命质量越好。
1.8 疗效判定标准 治疗8周后根据实体瘤疗效评价标准1.1进行疗效评估,完全缓解(CR)为病变部位病灶全部消失,且肿瘤标志物为正常范围,至少持续4周;部分缓解(PR)为病灶最大直径与垂直横径面积缩小50%以上并至少维持4周,其他病灶无增大并无新病灶发生;疾病稳定(SD)为病灶的两径乘积缩小50%或者增大程度没有超过25%,且周围无新病灶出现;疾病进展(PD)为病灶直接乘积增大程度>25%,有新病灶的出现。客观缓解率(ORR)(%)=(CR+PR)例数/总例数×100%。疾病控制率(DCR)(%)=(CR+PR+SD)例数/总例数×100%。
1.9 统计学方法 采用SPSS 23.0统计软件对研究数据进行分析。计量资料用均数±标准差(±s)表示,多个时点间比较采用单因素方差分析,两两比较采用LSD检验。以P<0.05为差异有统计学意义。
1.10 网络药理学研究方法
1.10.1 方药成分收集与筛选 三阴方中共含11味中药材,分别以中药名为关键词在TCMSP(http://tcmspw.com/tcmspsearch.php)中通过口服生物利用度(OB)≥30%和类药性(DL)≥0.18篩选药物活性成分,建立药物靶标数据库。通过GeneCards数据库(http://www.genecards.org/)筛选TNBC相关基因和蛋白靶标,建立数据集。再通过UniProt数据库将所有靶标转化为识别码格式,并对药物有效成分靶标与TNBC疾病靶标取交集,寻找共有靶标。
1.10.2 “成分-靶标”交互网络与PPI网络的构建与分析 为进一步研究三阴方中所含活性成分与TNBC靶标之间的相互关系,将搜集到的药物有效化合物成分、作用靶标与TNBC相关靶标信息导入Cytoscape3.7.2软件进行可视化分析,并通过蛋白质-蛋白质相互作用(PPI)网络数据库进行分析。
1.10.3 GO富集分析 通过R语言Clusterprofiler包对PPI网络中的蛋白进行基因本体(GO)富集分析,分别进行生物过程(Biological Process,BP)、细胞成分(CC)及分子功能(MF)分析,对基因集合或基因簇进行功能聚类的统计分析,根据富集的相关靶标数目及统计学差异绘制GO富集分析气泡图。
1.10.4 KEGG通路富集分析 通过R语言Clusterprofiler包对PPI网络中的蛋白进行京都基因与基因组百科全书(KEGG)富集分析,得出交互网络中的直接作用靶标相关通路,对结果进行功能聚类的统计分析,绘制KEGG富集分析气泡图。将得到的通路条目、靶点信息导入Cytoscape 3.7.2软件,绘制得到靶点-通路图。
2 结果
2.1 临床观察结果
2.1.1 平均PFS 三阴方治疗后患者总体的平均PFS为(8.64±1.87)个月。
2.1.2 临床疗效 观察服药8周后患者临床疗效。完全缓解2例,部分缓解16例,疾病稳定25例,客观缓解率34.6%,疾病控制率82.7%。
2.1.3 卡氏评分 治疗前及治疗4周、8周后患者的卡氏评分分别为(88.6±3.1)分、(91.9±2.8)分、(93.6±2.7)分,差异有统计学意义(P<0.05)。
2.1.4 FACT-B评分 治疗前及治疗4周、8周后患者的FACT-B评分比较,差异均有统计学意义(均P<0.05)。见表1。
2.2 网络药理学研究结果
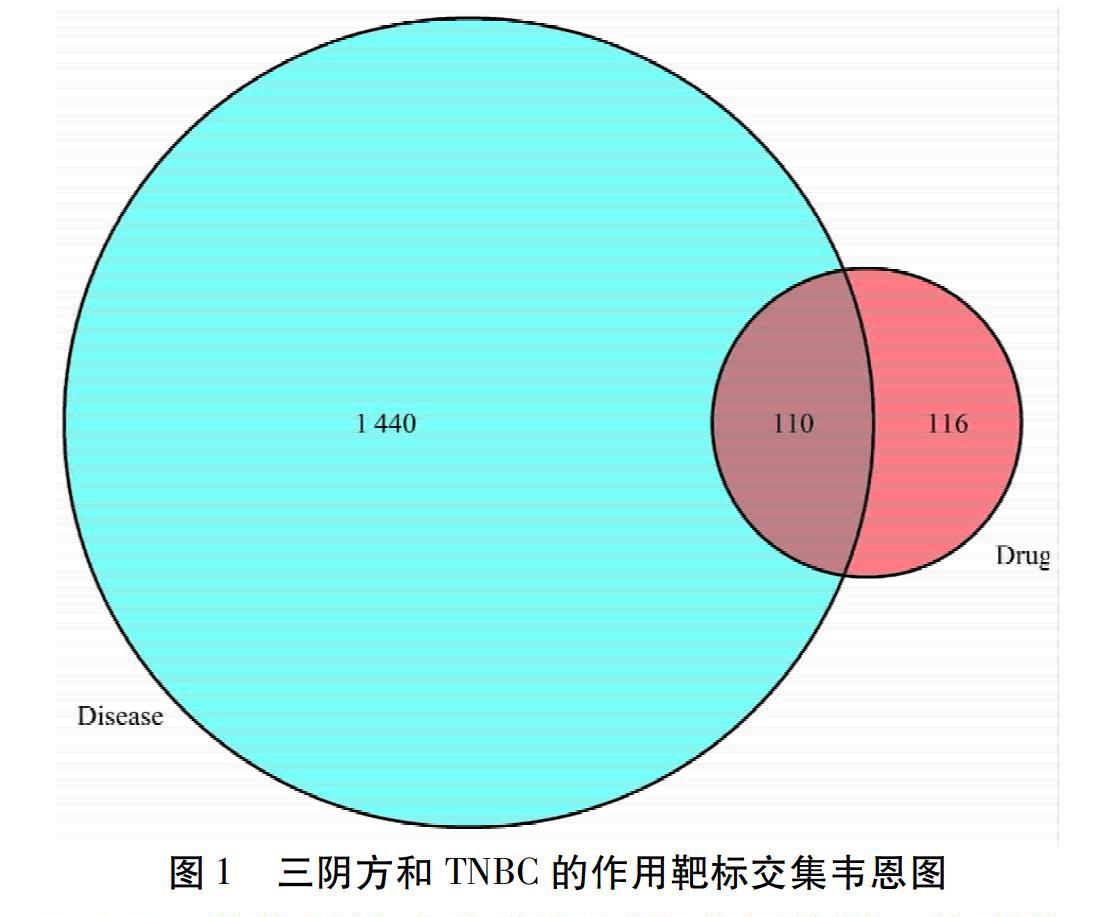
2.2.1 药物与疾病的靶标筛选 基于数据库构建方法,本研究利用TCMSP数据库共筛选得到三阴方11味中药的136个活性成分及226个不同作用靶标。见表2。通过GeneCards数据库共筛选得到TNBC作用靶标1 550个。将226个药物有效成分靶标与1 550个TNBC疾病作用靶标绘制韦恩图,得到共110个重合靶标。浅蓝色代表TNBC相关靶标,红色代表三阴方作用靶标,重叠部分代表三阴方化学成分与TNBC交集作用靶标。见图1。
2.2.2 药物活性成分-靶标网络分析结果 将所筛选出的有效药物成分与靶标信息构建“成分-靶标”网络。见图2。蓝色长方形为药物作用靶标,橙色三角形代表白花蛇舌草成分,绿色三角形代表白芍成分,紫色三角形代表白术成分,蓝色三角形代表柴胡成分,黄色三角形代表党参成分,红色菱形代表枸杞子成分,绿色菱形代表黄芪成分,蓝色菱形代表青蒿成分,黄色菱形代表三棱成分,红色三角形代表天花粉成分,紫色菱形为多药共有成分。药物活性成分中Degree≥10的分别是:槲皮素(Quercetin,MOL000098,值为78)、木犀草素(Luteolin,MOL000006,值为37)、山柰酚(Kaempferol,MOL000422,值为26)、甘氨酸(Glycitein,MOL008400,值为17)、7-甲氧基-2-甲基异黄酮(7-Methoxy-2-methyl isoflavone,MOL003896,值为15)、芒柄花黄素(Formononetin,MOL000392,值为15)、异鼠李素(Isorhamnetin,MOL000354,值为15)、7-O-甲基异戊烯醇(7-O-methylisomucronulatol,MOL000378,值为14)、卡氏菌素(Calycosin,MOL000417,值为14)、蒿黄素(Artemetin,MOL005229,值为12)、芹菜素-6,8-二-C-葡萄糖苷(6,8-di-c-glucosylapigenin_qt,MOL007423,值为11)、β-谷甾醇(Beta-sitosterol,MOL000358,值为10)、牡荆素(Vitexin_qt,MOL007404,值为10)。
2.2.3 PPI网络的构建 利用String在线数据库对靶标蛋白进行PPI分析,构建了三阴方和TNBC潜在靶标的PPI网络(图3,互作分数≥0.4),图中含有107个靶蛋白和2 108条相互作用边。
2.2.4 GO分析 分别对靶标蛋白进行BP、CC、MF富集分析,保留P≤0.01的结果,并分别对前20个条目进行可视化分析,得到柱状图。见图4~6。纵坐标表示富集条目,横坐标表示基因所占比例,图中圆形面积越大代表富集基因数目越多,颜色越红代表富集程度越显著。图4所示,主要BP富集条目如:氧化应激反应(Response to Oxidative Stress)、对金属离子的反应(Response to Metal Ion)、对类固醇激素的反应(Response to Steroid Hormone)等;图5所示,主要CC富集条目如:染色质(Chromatin)、转录因子复合物(Transcription Factor Complex)、膜筏(Membrane Raft)等;图6所示,主要MF富集条目如:核受体活性(Nuclear Receptor Activity)、为近端启动子序列特异性DNA结合(Proximal Promoter Sequence-specific DNA Binding)、蛋白质异二聚活性(Protein Heterodimerization Activity)等。
2.2.5 KEGG通路富集分析 通过网络药理学的KEGG_PATHWAY通路注释分析,获取了三阴方的主要药理学作用通路166条(Count≥2,P-Value≤0.05)。主要涉及PI3K-AKT信号通路(PI3K-AKT Signaling Pathway)、腫瘤坏死因子信号通路(TNF Signaling Pathway)、p53信号通路(p53 Signaling Pathway)等。见图7。纵坐标表示富集条目,横坐标表示基因所占比例,图中圆形面积越大代表富集基因数目越多,颜色越红代表富集程度越显著。
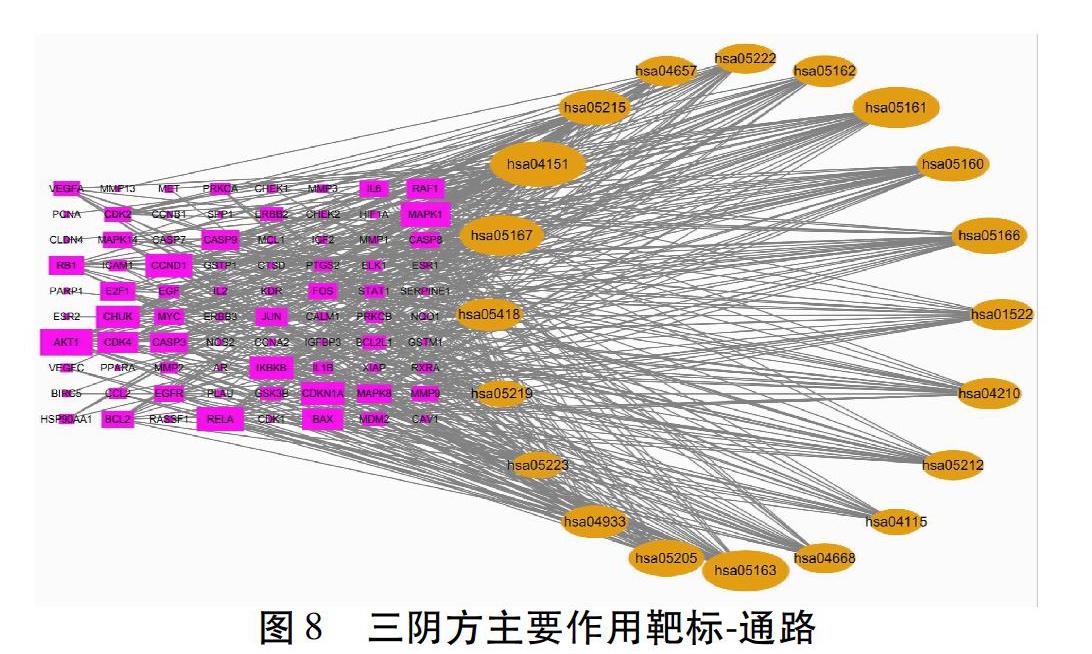
2.2.6 构建靶标-通路图 将得到的通路条目、靶标信息导入Cytoscape3.7.2软件,绘制得到靶标-通路图。见图8。紫色长方形代表靶标,橙色椭圆形代表通路,面积越大富集越显著。其中Degree≥10的靶有AKT1、MAPK1、RELA、CCND1、CDKN1A、CHUK、IKBKB、BAX、CDK4、CASP9、CASP3、RAF1、RB1、E2F1、MAPK8、BCL2、JUN。
3 讨论
中医学关于乳腺癌的记载最早见于葛洪的《肘后备急方》:“若发肿至坚而有根者,名曰石痈。”后巢元方在《诸病源候论》中称之为“乳石痈”,窦汉卿在《疮疡经验全书》中称之为“乳岩”,TNBC在中医学也属于“乳岩”范畴[8]。在病机方面,历代医家均强调与七情内伤密切相关,情志异常是导致乳腺癌发生发展的重要因素。情志异常,以致肝气久郁,气郁结聚于乳络则可发病,加之饮食不佳,脾胃受损,运化不利,则痰浊内生,加重病情。《慎斋遗书》中曾记载:“脾胃一伤,四脏皆无生气。”TNBC患者肝脾不合是其发病关键,而瘀血内停、痰浊内生为疾病演变基础,痰瘀互结为疾病主要病机转归,疾病发生、发展过程中虚、外伤、痰、瘀、郁相互促进,互为影响,虚实夹杂,疾病缠绵难愈,治疗则当以疏肝健脾、养血益气之法论治[9-10]。
卢雯平教授根据多年临床经验,拟定三阴方(即逍遥散合理冲汤化裁方)用于临床治疗晚期TNBC患者。逍遥散出自《太平惠民和剂局方》,养血健脾,疏肝清热;理冲汤出自《医学衷中参西录》,具有益气行血,调经祛瘀之功效。方中柴胡疏肝解郁,以调达肝气;白芍养血敛阴,柔肝缓急;党参、黄芪、白术补脾胃之元气,使气旺而促血行、祛瘀而不伤正。三棱、莪术破血、行气、消癥;枸杞子益精明目,滋补肝肾;天花粉清热泻火,生津止渴,排脓消肿;青蒿清热凉血;白花蛇舌草清热解毒、消痛散结。诸药合用,有疏肝益肾,调理冲任之功,且攻补兼施,祛邪不伤正。
经网络药理学数据发掘共得到三阴方筛选的136个活性成分及226个不同作用靶标,经过与TNBC相关作用靶标取交集得到110个药物与疾病相关活性成分与靶标,活性成分为黄酮类化合物及甾醇类化合物。以往研究证实黄酮类化合物可以抑制肿瘤细胞的上皮-间充质转化(EMT),从而抑制肿瘤转移[11];黄酮类植物成分不仅可以通过抑制细胞色素P4501B1酶逆转丙二醛-MB-468TNBC细胞对顺铂的耐药性,还可以通过抑制TNBC细胞的迁移来诱导阿霉素的抗肿瘤活性,提示黄酮类植物成分能够提高现有化疗药物对TNBC的疗效[11-12]。有报道槲皮素不仅可以通过调节Foxo3a活性诱导TNBC细胞凋亡和细胞周期阻滞,而且其可以增强电热疗诱导TNBC细胞凋亡[13-14]。槲皮素和姜黄素联合通过调节肿瘤抑制基因协同作用诱导治疗TNBC细胞株的抗癌活性[15]。同时它们可以与铈离子形成复合物从而提高光动力疗法治疗TNBC的疗效[16]。槲皮素联合没食子酸和没食子酸酯通过下调S期激酶蛋白2的表达,诱导TNBC细胞S期阻滞和凋亡[17]。木犀草素及其苷已往研究中被证实对TNBC的MDA-MB-231细胞侵袭和凋亡有作用,而且可以通过下调β-catenin的表达,逆转上皮向间充质的转移抑制TNBC的转移、细胞迁移和生存[18-20]。同时其可以通过AKT/mTOR信号通路表观遗传调控MMP9表达抑制雄激素受体阳性TNBC细胞增殖和转移,所以有研究表明木犀草素作为新型YAP/TAZ抑制剂是一种治疗TNBC的新药物[21-22]。有研究表明小剂量山柰酚可以抑制TNBC细胞的迁移和侵袭,诱导细胞周期阻滞、凋亡和DNA损伤,还可以通过抑制P-21激活激酶4(PAK4)的活性改善TNBC的预后[23-25]。有研究将异鼠李素(IH)联合氯喹(CQ)干预TNBC细胞和异种移植小鼠,可使小鼠的依赖性线粒体分裂和凋亡[26]。此外,异鼠李素与经典的自噬/有丝分裂抑制因子联合治疗TNBC是一种新的治疗策略。
在进行GO富集的BP、CC与MF分析过程中,我们富集出来许多高相关性的富集条目,如氧化应激反应,有研究表明黏蛋白1(MUC1)是一种异二聚体肿瘤蛋白,其可通过氧化应激反应降低TNBC细胞的耐药性[27];对金属离子的响应,有研究表明抗癌和抗血管生成药物,毛壳菌合成的真菌代谢产物Chetomin(CHET)可以通过促进钙超载和线粒体功能障碍诱导人TNBC细胞凋亡[28];对类固醇激素的反应,有研究表明雌二醇能够诱导TNBC BDNF/TrkB信号转导促进脑转移,且在雌激素受体β(ERβ)的TNBC细胞中具有抗增殖作用[29-30];对活性氧的反应,有研究表明二萜类天然化合物C4(Crassin)能够通过活性氧途径对TNBC细胞产生抑制作用[31];对抗生素的反应,有研究表明盐霉素不仅对TNBC细胞成活和迁移有影响,而且对TNBC细胞生长有抑制作用[32-33];活性氧代谢过程,有研究表明杨梅素通过过氧化氢产生铁依赖性活性氧介导诱导TNBC细胞凋亡[34];染色质,有研究表明染色质复合物可以抑制胆固醇生物合成在TNBC中发挥抑癌作用[35];转录因子复合物,有研究表明激活转录因子4通过SMAD2/3/4和mTORC2信号调节TGFβ诱导的乳腺癌侵袭性[36];膜筏,有报道证实脂筏破裂可以诱导TNBC细胞凋亡,降低TNBC细胞的成活率[37-38];主轴,有研究表明高水平的核仁纺锤体相关蛋白和低水平的BRCA1表达预示着TNBC预后不良[39];核受体活性,有研究表明孤儿核受体雌激素相关受体β(ERRβ或ESRRB)的小分子激动剂配体在TNBC细胞系中具有生长抑制和抗有丝分裂活性[40]。
通过网络药理学的KEGG通路分析,预测了三阴方治疗TNBC可能的主要药理学作用通路,如PI3K-AKT信号通路。PI3K-AKT信号通路是TNBC耐药和生存的重要途径之一[41]。有随机试验表明,PI3K-AKT信号通路抑制剂联合一线化疗可提高TNBC患者的无进展生存率(PFS)[42]。而双重抑制PI3K-AKT和MEK5-ERK5信号通路比单独抑制这2种途径更有效地降低TNBC的增殖和成活[43]。有研究发现雷帕霉素靶点(mTOR)联合阿霉素脂质体和贝伐单抗通过PI3K-AKT-mTOR通路治疗晚期化生性TNBC的安全性和有效性,蜈蚣总提取物(CME)可能通过抑制EGFR、PI3K/AKT/mTOR、核因子κB和STAT3通路治疗TNBC,MiR-193通过ING5/PI3K/AKT途径促进TNBC细胞增殖和侵袭,IL-8过表达通过PI3K-AKT信号通路和EMT促进TNBC细胞迁移[44-47];肿瘤坏死因子信号通路,有研究证明癌基因磷酸酶PRL-3通过肿瘤坏死因子信号通路导致TNBC细胞衰老和凋亡[48];p53信号通路,有研究证明环丙沙星通过p53信号通路诱导人乳腺癌MDA-MB-231细胞凋亡[49]。
通过靶标-通路图的绘制,我们发现AKT1、MAPK1、RELA、CCND1、CDKN1A、CHUK、IKBKB、BAX、CDK4、CASP9、CASP3、RAF1、RB1、E2F1、MAPK8、BCL2、JUN均与富集通路显著相关。有研究表明Copine1(CPNE1)通过AKT信号通路促进TNBC的肿瘤发生和抗辐射[50];MAPK的表达与肿瘤侵袭和TNBC转移密切相关,可作为TNBC患者预后不良的指标[51];磷酸化-Ser134-GR(pS134-GR)在TNBC中升高,通过MAPK信号转导为侵袭性TNBC治疗靶点[52];研究发现氟噻唑酰腙类化合物TSC-3C通过促进细胞凋亡、调节MAPK途径和诱导线粒体功能障碍等途径抑制TNBC细胞的活性[53];CRT0066101是一种蛋白激酶D(PRKD)抑制剂,其通过MAPK1/3、AKT等信号通路有效地治疗TNBC[54]。另有研究表明CDKN1A基因表达水平是影响TNBC患者预后的独立因素[55]。吲哚-3-甲醇环四聚体衍生物CTet通过TNBC细胞株中CDKN1A/p21的过度表达抑制肿瘤细胞的增殖[56]。肿瘤坏死因子通过CDKN1A/p21表达侵袭TNBC细胞[57]。
综上所述,三阴方用于治疗晚期TNBC临床疗效显著,可延长患者的PFS,明显改善患者的生命质量。通过网络药理学研究得到三阴方用于治疗晚期TNBC具有多个有效成分、多作用靶标及多作用通路的特点,为该方用于治疗TNBC提供了理论依据,也为进一步提取中药有效成分,研制TNBC药物提供了思路。
参考文献
[1]柳雪,李慧杰,李秀荣.乳腺癌相关性抑郁中医认识及研究进展[J].中华中医药杂志,2021,36(4):2219-2221.
[2]Elias AD.Triple-negative breast cancer:a short review[J].Am J Clin Oncol,2010,33(6):637-645.
[3]Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.
[4]Blows FM,Driver KE,Schmidt MK,et al.Subtyping of breast cancer by immunohistochemistry to investigate a relationship between subtype and short and long term survival:a collaborative analysis of data for 10,159 cases from 12 studies[J].PLoS Med,2010,7(5):e1000279.
[5]Park JH,Ahn JH,Kim SB.How shall we treat early triple-negative breast cancer(TNBC):from the current standard to upcoming immuno-molecular strategies[J].ESMO Open,2018,3(Suppl 1):e000357.
[6]Bevers TB,Anderson BO,Bonaccio E,et al.NCCN clinical practice guidelines in oncology:breast cancer screening and diagnosis[J].J Natl Compr Canc Netw,2009,7(10):1060-1096.
[7]國家中医药管理局.中医病证诊断疗效标准[S].南京:南京大学出版社,1994:131.
[8]董青,董雪燕,李忠,等.基于中医古籍探索乳腺癌认知源流[J].北京中医药,2019,38(4):355-359.
[9]田华琴,王艳杰,王斌,等.乳积方加减对激素受体阴性乳腺癌术后复发转移的影响[J].中国中西医结合杂志,2017,37(2):169-173.
[10]王贤彬,胡金辉,袁博,等.补肾活血汤联合化疗对三阴性乳腺癌骨转移患者免疫功能及生活质量的影响[J].中医药导报,2018,24(2):55-57.
[11]Srinivasan A,Thangavel C,Liu Y,et al.Quercetin regulates β-catenin signaling and reduces the migration of triple negative breast cancer[J].Mol Carcinog,2016,55(5):743-756.
[12]Sharma R,Gatchie L,Williams IS,et al.Glycyrrhiza glabra extract and quercetin reverses cisplatin resistance in triple-negative MDA-MB-468 breast cancer cells via inhibition of cytochrome P450 1B1 enzyme[J].Bioorg Med Chem Lett,2017,27(24):5400-5403.
[13]Nguyen LT,Lee YH,Sharma AR,et al.Quercetin induces apoptosis and cell cycle arrest in triple-negative breast cancer cells through modulation of Foxo3a activity[J].Korean J Physiol Pharmacol,2017,21(2):205-213.
[14]Danics L,Schvarcz CA,Viana P,et al.Exhaustion of Protective Heat Shock Response Induces Significant Tumor Damage by Apoptosis after Modulated Electro-Hyperthermia Treatment of Triple Negative Breast Cancer Isografts in Mice[J].Cancers(Basel),2020,12(9):2581.
[15]Kundur S,Prayag A,Selvakumar P,et al.Synergistic anticancer action of quercetin and curcumin against triple-negative breast cancer cell lines[J].J Cell Physiol,2019,234(7):11103-11118.
[16]Hosseinzadeh R,Khorsandi K,Esfahani HS,et al.Preparation of cerium-curcumin and cerium-quercetin complexes and their LEDs irradiation assisted anticancer effects on MDA-MB-231 and A375 cancer cell lines[J].Photodiagnosis Photodyn Ther,2021,34:102326.
[17]Huang C,Lee SY,Lin CL,et al.Co-treatment with quercetin and 1,2,3,4,6-penta-O-galloyl-β-D-glucose causes cell cycle arrest and apoptosis in human breast cancer MDA-MB-231 and AU565 cells[J].J Agric Food Chem,2013,61(26):6430-6445.
[18]Lee J,Park SH,Lee J,et al.Differential effects of luteolin and its glycosides on invasion and apoptosis in MDA-MB-231 triple-negative breast cancer cells[J].EXCLI J,2019,18:750-763.
[19]Lin D,Kuang G,Wan J,et al.Luteolin suppresses the metastasis of triple-negative breast cancer by reversing epithelial-to-mesenchymal transition via downregulation of β-catenin expression[J].Oncol Rep,2017,37(2):895-902.
[20]Cook MT,Liang Y,Besch-Williford C,et al.Luteolin inhibits lung metastasis,cell migration,and viability of triple-negative breast cancer cells[J].Breast Cancer(Dove Med Press),2017,9:9-19.
[21]Wu HT,Lin J,Liu YE,et al.Luteolin suppresses androgen receptor-positive triple-negative breast cancer cell proliferation and metastasis by epigenetic regulation of MMP9 expression via the AKT/mTOR signaling pathway[J].Phytomedicine,2021,81:153437.
[22]Cao D,Zhu GY,Lu Y,et al.Luteolin suppresses epithelial-mesenchymal transition and migration of triple-negative breast cancer cells by inhibiting YAP/TAZ activity[J].Biomed Pharmacother,2020,129:110462.
[23]Li S,Yan T,Deng R,et al.Low dose of kaempferol suppresses the migration and invasion of triple-negative breast cancer cells by downregulating the activities of RhoA and Rac1[J].Onco Targets Ther,2017,10:4809-4819.
[24]Zhu L,Xue L.Kaempferol Suppresses Proliferation and Induces Cell Cycle Arrest,Apoptosis,and DNA Damage in Breast Cancer Cells[J].Oncol Res,2019,27(6):629-634.
[25]Arowosegbe MA,Amusan OT,Adeola SA,et al.Kaempferol as a Potential PAK4 Inhibitor in Triple Negative Breast Cancer:Extra Precision Glide Docking and Free Energy Calculation[J].Curr Drug Discov Technol,2020,17(5):682-695.
[26]Hu J,Zhang Y,Jiang X,et al.ROS-mediated activation and mitochondrial translocation of CaMKⅡ contributes to Drp1-dependent mitochondrial fission and apoptosis in triple-negative breast cancer cells by isorhamnetin and chloroquine[J].J Exp Clin Cancer Res,2019,38(1):225.
[27]Hiraki M,Suzuki Y,Alam M,et al.MUC1-C Stabilizes MCL-1 in the Oxidative Stress Response of Triple-Negative Breast Cancer Cells to BCL-2 Inhibitors[J].Sci Rep,2016,6:26643.
[28]Dewangan J,Srivastava S,Mishra S,et al.Chetomin induces apoptosis in human triple-negative breast cancer cells by promoting calcium overload and mitochondrial dysfunction[J].Biochem Biophys Res Commun,2018,495(2):1915-1921.
[29]Contreras-Zárate MJ,Day NL,Ormond DR,et al.Estradiol induces BDNF/TrkB signaling in triple-negative breast cancer to promote brain metastases[J].Oncogene,2019,38(24):4685-4699.
[30]Wisinski KB,Xu W,Tevaarwerk AJ,et al.Targeting Estrogen Receptor Beta in a Phase 2 Study of High-Dose Estradiol in Metastatic Triple-Negative Breast Cancer:A Wisconsin Oncology Network Study[J].Clin Breast Cancer,2016,16(4):256-61.
[31]Richards CE,Vellanki SH,Smith YE,et al.Diterpenoid natural compound C4(Crassin) exerts cytostatic effects on triple-negative breast cancer cells via a pathway involving reactive oxygen species[J].Cell Oncol(Dordr),2018,41(1):35-46.
[32]Hero T,Bühler H,Kouam PN,et al.The Triple-negative Breast Cancer Cell Line MDA-MB 231 Is Specifically Inhibited by the Ionophore Salinomycin[J].Anticancer Res,2019,39(6):2821-2827.
[33]Rai G,Suman S,Mishra S,et al.Evaluation of growth inhibitory response of Resveratrol and Salinomycin combinations against triple negative breast cancer cells[J].Biomed Pharmacother,2017,89:1142-1151.
[34]Knickle A,Fernando W,Greenshields AL,et al.Myricetin-induced apoptosis of triple-negative breast cancer cells is mediated by the iron-dependent generation of reactive oxygen species from hydrogen peroxide[J].Food Chem Toxicol,2018,118:154-167.
[35]Alexandrova E,Giurato G,Saggese P,et al.Interaction Proteomics Identifies ERbeta Association with Chromatin Repressive Complexes to Inhibit Cholesterol Biosynthesis and Exert An Oncosuppressive Role in Triple-negative Breast Cancer[J].Mol Cell Proteomics,2020,19(2):245-260.
[36]González-González A,Muoz-Muela E,Marchal JA,et al.Activating Transcription Factor 4 Modulates TGFβ-Induced Aggressiveness in Triple-Negative Breast Cancer via SMAD2/3/4 and mTORC2 Signaling[J].Clin Cancer Res,2018,24(22):5697-5709.
[37]Badana AK,Chintala M,Gavara MM,et al.Lipid rafts disruption induces apoptosis by attenuating expression of LRP6 and survivin in triple negative breast cancer[J].Biomed Pharmacother,2018,97:359-368.
[38]Badana A,Chintala M,Varikuti G,et al.Lipid Raft Integrity Is Required for Survival of Triple Negative Breast Cancer Cells[J].J Breast Cancer,2016,19(4):372-384.
[39]Chen L,Yang L,Qiao F,et al.High Levels of Nucleolar Spindle-Associated Protein and Reduced Levels of BRCA1 Expression Predict Poor Prognosis in Triple-Negative Breast Cancer[J].PLoS One,2015,10(10):e0140572.
[40]Fernandez AI,Geng X,Chaldekas K,et al.The orphan nuclear receptor estrogen-related receptor beta(ERRβ) in triple-negative breast cancer[J].Breast Cancer Res Treat,2020,179(3):585-604.
[41]Khan MA,Jain VK,Rizwanullah M,et al.PI3K/AKT/mTOR pathway inhibitors in triple-negative breast cancer:a review on drug discovery and future challenges[J].Drug Discov Today,2019,24(11):2181-2191.
[42]Pascual J,Turner NC.Targeting the PI3-kinase pathway in triple-negative breast cancer[J].Ann Oncol,2019,30(7):1051-1060.
[43]Wright TD,Raybuck C,Bhatt A,et al.Pharmacological inhibition of the MEK5/ERK5 and PI3K/Akt signaling pathways synergistically reduces viability in triple-negative breast cancer[J].J Cell Biochem,2020,121(2):1156-1168.
[44]Basho RK,Gilcrease M,Murthy RK,et al.Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer:Evidence From a Phase 1 Trial of mTOR Inhibition in Combination With Liposomal Doxorubicin and Bevacizumab[J].JAMA Oncol,2017,3(4):509-515.
[45]Lee MM,Chan BD,Wong WY,et al.Anti-cancer Activity of Centipeda minima Extract in Triple Negative Breast Cancer via Inhibition of AKT,NF-κB,and STAT3 Signaling Pathways[J].Front Oncol,2020,10:491.
[46]Xu JH,Zhao JX,Jiang MY,et al.MiR-193 promotes cell proliferation and invasion by ING5/PI3K/AKT pathway of triple-negative breast cancer[J].Eur Rev Med Pharmacol Sci,2020,24(6):3122-3129.
[47]Deng F,Weng Y,Li X,et al.Overexpression of IL-8 promotes cell migration via PI3K-Akt signaling pathway and EMT in triple-negative breast cancer[J].Pathol Res Pract,2020,216(4):152902.
[48]Gari HH,DeGala GD,Lucia MS,et al.Loss of the oncogenic phosphatase PRL-3 promotes a TNF-R1 feedback loop that mediates triple-negative breast cancer growth[J].Oncogenesis,2016,5(8):e255.
[49]Beberok A,Wrze'sniok D,Rok J,et al.Ciprofloxacin triggers the apoptosis of human triple-negative breast cancer MDA-MB-231 cells via the p53/Bax/Bcl-2 signaling pathway[J].Int J Oncol,2018,52(5):1727-1737.
[50]Shao Z,Ma X,Zhang Y,et al.CPNE1 predicts poor prognosis and promotes tumorigenesis and radioresistance via the AKT singling pathway in triple-negative breast cancer[J].Mol Carcinog,2020,59(5):533-544.
[51]Jiang W,Wang X,Zhang C,et al.Expression and clinical significance of MAPK and EGFR in triple-negative breast cancer[J].Oncol Lett,2020,19(3):1842-1848.
[52]Perez Kerkvliet C,Dwyer AR,Diep CH,et al.Glucocorticoid receptors are required effectors of TGFβ1-induced p38 MAPK signaling to advanced cancer phenotypes in triple-negative breast cancer[J].Breast Cancer Res,2020,22(1):39.
[53]Zhang J,Dai J,Zheng Q,et al.The Fluoro-Thiazolylhydrazone Compound TSC-3C Inhibits Triple Negative Breast Cancer(TNBC) Cell Line Activity by Promoting Apoptosis,Regulating the MAPK Pathway and Inducing Mitochondrial Dysfunction[J].Int J Mol Sci,2020,21(3):1038.
[54]Liu Y,Wang Y,Yu S,et al.The Role and Mechanism of CRT0066101 as an Effective Drug for Treatment of Triple-Negative Breast Cancer[J].Cell Physiol Biochem,2019,52(3):382-396.
[55]Zhou ZR,Wang XY,Yu XL,et al.Building radiation-resistant model in triple-negative breast cancer to screen radioresistance-related molecular markers[J].Ann Transl Med,2020,8(4):108.
[56]De Santi M,Galluzzi L,Lucarini S,et al.The indole-3-carbinol cyclic tetrameric derivative CTet inhibits cell proliferation via overexpression of p21/CDKN1A in both estrogen receptor-positive and triple-negative breast cancer cell lines[J].Breast Cancer Res,2011,13(2):R33.
[57]Zaremba-Czogalla M,Hryniewicz-Jankowska A,Tabola R,et al.A novel regulatory function of CDKN1A/p21 in TNFα-induced matrix metalloproteinase 9-dependent migration and invasion of triple-negative breast cancer cells[J].Cell Signal,2018,47:27-36.
(2020-05-11收稿 責任编辑:杨觉雄)
