虚汗停颗粒对环磷酰胺模型大鼠免疫功能及肠道菌群的影响
2021-09-18宁娜刘珊珊黄秋凌李燕舞彭丹婷
宁娜 刘珊珊 黄秋凌 李燕舞 彭丹婷


摘要 目的:探討虚汗停颗粒对环磷酰胺模型大鼠免疫功能及肠道菌群的干预作用。方法:将SPF级SD大鼠随机分为5组,分别为正常对照组、环磷酰胺模型组、虚汗停低剂量组(1.7 g/kg)、高剂量组(3.4 g/kg)、匹多莫德组(0.23 g/kg)。除正常对照组外,其他各组大鼠采用环磷酰胺腹腔注射制备免疫功能抑制模型。用流式细胞计数法检测各组大鼠外周血淋巴细胞分类,ELISA法检测血清免疫球蛋白IgG、IgM及补体C3、C4含量,16S rDNA测序检测大鼠肠道菌群变化。常规固定大鼠脾脏,HE染色后光镜下进行形态学观察。结果:环磷酰胺模型大鼠外周血淋巴细胞中CD3、CD4、CD8细胞比例明显降低,虚汗停高剂量组及匹多莫德组对环磷酰胺模型大鼠外周血淋巴细胞中CD3细胞比例有明显提高,其他各组均无显著变化。模型大鼠血清中IgG、IgM、C4含量明显降低,虚汗停低剂量组及匹多莫德组模型大鼠血清IgG、IgM含量均显著升高。肠道菌群检测结果显示,模型大鼠菌群结构与正常大鼠菌群明显不同;药物干预各组与模型组微生物结构的差异均有统计学意义(均P<0.01)。结论:虚汗停颗粒可以调节环磷酰胺模型大鼠肠道菌群结构,改善部分免疫功能及脾脏病理形态,体现了中药复方多靶点效应,为临床应用提供了实验依据。
关键词 虚汗停颗粒;免疫调控;环磷酰胺;匹多莫德颗粒;免疫细胞因子;16S rRNA基因测序;脾脏病理形态;肠道菌群
Effects of Xuhanting Granule on Immune Function and Intestinal Microflora of Cyclophosphamide Model Rats
NING Na1, LIU Shanshan2, HUANG Qiuling2, LI Yanwu3, PENG Danting1
(1 Guangzhou Baiyunshan Qixing Pharmaceutical Company Limited, Guangzhou 510530, China; 2 Guangzhou Baiyunshan Zhongyi Pharmaceutical Company Limited, Guangzhou 510530, China; 3 Guangzhou University of Chinese Medicine, Guangzhou 510405, China)
Abstract Objective:To explore the effect of Xuhanting Granules on immune function and intestinal microflora of cyclophosphamide rats. Methods:A total of 50 rats were randomly divided into 5 groups:a normal control group, a cyclophosphamide model group, Xuhanting low, high dose groups (1.7 g/kg, 3.4 g/kg), and a pidotimod group (0.23g/kg). Except for the normal control group, the immunosuppressive model was established by intraperitoneal injection of cyclophosphamide. Flow cytometry was used to detect the classification of peripheral blood lymphocytes of rats, and ELISA method was used to detect the contents of serum immunoglobulin IgG, IgM and complement C3 and C4. 16S rDNA sequencing was used to detect the changes of intestinal flora in rats. The spleen of rats was fixed routinely, and morphological observation was carried out under light microscope after HE staining. Results:The proportion of CD3, CD4 and CD8 cells in peripheral blood lymphocytes of cyclophosphamide model rats was significantly decreased, and the proportion of CD3 cells in peripheral blood lymphocytes of rats with cyclophosphamide was significantly increased by xuhanding 3.4g/kg and pidotimod group. The contents of IgG, IgM and C4 in the serum of model rats were significantly decreased. The contents of IgG, IgM and C4 in serum of model rats were significantly increased by Xuhanting 1.7 g/kg and pidotimod. The results of intestinal microflora detection showed that the microflora structure of model rats was significantly different from that of normal rats, and there were significant differences in the microflora structure between the drug intervention groups and the model group (P<0.01).Conclusion:Xuhanting Granules can regulate the structure of intestinal microflora and improve partial immune function and pathological morphology of spleen in cyclophosphamide model rats, reflecting the multi-target effect of traditional Chinese medicine compound, and provide experimental basis for clinical application.
Keywords Xuhanting Granules; Immunoregulation; Cyclophosphamide; Pidotimod granule; Immune cell molecule; 16S rRNA gene sequencing; Pathological form of spleen; Intestinal flora
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.16.009
虚汗停颗粒是根据《太平惠民和剂局方》中记载的名方“牡蛎散”化裁而成的中成药,可显著改善临床患者自汗、盗汗症状。实验研究表明虚汗停颗粒具有显著的止汗、抗疲劳等药理作用[1-2]。中医认为,汗证多因卫表不固、腠理失司而致,脾居于中焦,为五脏之枢纽,脾的功能失调是汗证发生的重要原因[3]。免疫功能是中医“脾”功能的部分体现[4]。传统中药以口服为主,首先与之接触的是胃肠道,中药进入肠道后与肠道菌群的相互作用与机体免疫功能密切相关[5],菌群变化是中药多靶点效应的切入点[6]。因此,本研究以免疫功能及肠道菌群调节为切入点,进一步探讨虚汗停颗粒的药效作用。
1 材料与方法
1.1 材料
1.1.1 动物 选取SPF级SD大鼠50只,170~190 g,雌雄各半,由广东省医学实验动物中心提供,合格证号:44007200063727,许可证号:SYXK(粤)2018-0001。动物饲养场所:广州中医药大学实验动物中心SPF级大鼠饲养室,许可证号:SYXK(粤)2013-0001。动物福利伦理委员会批准通过(伦理审批号:20190404002)。
1.1.2 药物 虚汗停颗粒(广州白云山奇星药业有限公司,批号:18023B),其中药包括黄芪、浮小麦、糯稻根、煅牡蛎、大枣。匹多莫德颗粒(浙江仙琚制药股份有限公司,批号:181232);注射用环磷酰胺(百特国际有限公司,批号:8J266D)。
1.1.3 试剂与仪器 大鼠外周血淋巴细胞分离液(天津市灏洋生物制品科技有限公司,批号:2019212);FITC anti-rat CD4抗体(Biolegend,Inc,美国,批号:AB_313933);PE anti-rat CD3抗体(Biolegend,Inc,美国,批号:AB_2563272);FITC anti-rat CD8a抗体(Biolegend,Inc,美国,批号:AB_313974);FITC anti-rat CD161抗体(Biolegend,Inc,美国,批号:AB_2564547);大鼠IgG、IgM、C3、C4酶联免疫检测试剂盒(南京建成生物工程研究所,批号:20190617)。台式离心机(湘仪,型号:TDZ5-WS)。
1.2 方法
1.2.1 分组与模型制备 将SD大鼠随机分为5组,每组10只。分别为正常对照组、模型对照组、匹多莫德组、虚汗停低剂量组、虚汗停高剂量组。除正常对照组外其余4组大鼠腹腔注射35 mg/(kg·d)环磷酰胺,连续3 d,正常对照组腹腔注射等体积生理盐水。
1.2.2 干预方法 造模结束后,虚汗停低、高剂量组按1.7 g/kg、3.4 g/kg灌胃,匹多莫德组按0.23 g/kg灌胃。1次/d,连续7 d。
1.2.3 肠道菌群测序 末次给药后无菌管采集新鲜大鼠粪便,液氮保存备用,进行16S rDNA菌群测序分析。采用Illumina HiSeq测序平台,利用双末端测序的方法,构建小片段文库进行测序。通过对Reads拼接过滤,OTU聚类,并进行物种注释和丰度分析,进一步进行Alpha多样性分析、β多样性分析及显著物种差异分析等。
1.2.4 外周血IgM、IgG、补体C3、C4含量的检测 腹腔静脉取血(不抗凝)约2 mL,室温静置30 min,上机682×g离心,取血清,-20 ℃保存备用。采用酶联免疫法检测各组血清中IgM、IgG、补体C3、C4含量。
1.2.5 外周血淋巴细胞检测 腹腔静脉取血(肝素钠抗凝)5 mL,按1∶1比例缓慢加入大鼠外周血淋巴细胞分离液(5 mL)上层,上机598×g离心;离心后吸取分离液与血浆之间的白色絮状物即外周血淋巴细胞,加入清洗液清洗淋巴細胞2次。流式细胞仪检测CD3、CD4、CD8及NK细胞比例。
1.2.6 脾脏指数及形态 称取脾脏质量计算脾脏指数,取部分脾脏组织固定、切片、HE染色,显微镜下观察脾脏形态变化。
1.3 统计学方法 采用SPSS 17.0统计软件对研究数据进行分析,计数资料用百分率表示,采用χ2检验,计量资料用均数±标准差(±s)表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 虚汗停对各组大鼠血清IgM、IgG、补体C3、C4含量的影响 结果显示,环磷酰胺模型大鼠(模型对照组)血清中IgG、IgM、C4含量明显降低,匹多莫德组、虚汗停低剂量组可显著上调模型大鼠血清IgG、IgM含量,对补体C4、C3无明显作用。见表1。
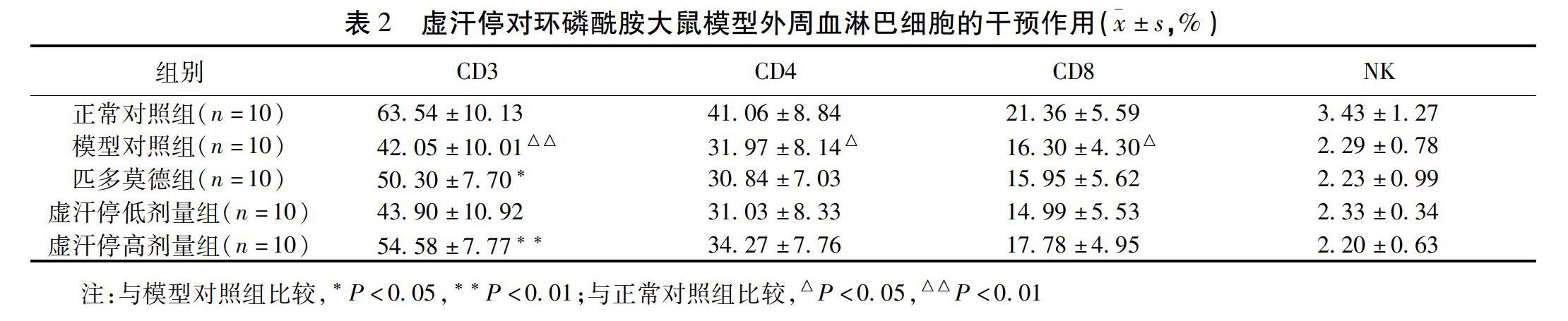
2.2 虚汗停对各组大鼠外周血淋巴细胞中CD3、CD4、CD8及NK细胞比例的影响 结果显示,环磷酰胺模型大鼠(模型对照组)外周血淋巴细胞中CD3、CD4、CD8、NK细胞比例明显降低。经药物干预,匹多莫德组及虚汗停高剂量组外周血淋巴细胞中CD3细胞比例升高,其他各组均无显著变化。见表2。
2.3 虚汗停对环磷酰胺模型大鼠肠道菌群的影响结果显示,各组样本物种分类在门水平上以厚壁菌门、拟杆菌门、疣微菌门、变形菌门及放线菌门为主;在属水平各组样本物种分类比例有所不同,其中虚汗停低、高剂量组均可增加乳酸杆菌属比例、降低拟杆菌属比例。见图1。Alpha多样性分析显示,各组样品物种多样性及丰度差异无统计学意义(P>0.05)。见图2。菌属水平采用PCoA分析显示,模型对照组样品的微生物组成结构明显偏离其他各组,采用Binary Jaccard法计算样品间的距离,结果显示药物干预各组与模型组微生物结构差异有统计学意义(P<0.01)。见图3。组间样品LEfSe分析显示了不同组间差异有统计学意义的标志性菌群:正常对照组以双歧杆菌、瘤胃球菌、放线菌、Gordonibacter、Turicibacter为优势菌,而模型对照组以Allobaculum、Holdemanella、Stoquefichus为优势菌,虚汗停不同剂量干预组对菌群的干预效应类似,优势菌均表现为Cyanobacterium、Catenibacterium、Mitochondria、Luchmannii、Oxyphotobacteria等,匹多莫德干预组优势菌表现为瘤胃球菌、Cyanobacterium、Muribaculaccac、Mitochaondria、Luchmannii、Turicibacter、Gordonibacter等。见图4。
2.4 对脾脏指数及形态的影响 结果显示,环磷酰胺模型大鼠(模型对照组)体质量显著低于正常组,脾质量及脾脏指数(脾质量/体质量)无明显变化,各药物组干预对模型大鼠体质量、脾质量无显著作用。见表3。形态学观察显示,正常大鼠脾脏白髓发达,环磷酰胺模型大鼠脾脏淋巴细胞减少,脾小结体积变小,小结周围有多量巨噬细胞,各药物干预组大鼠脾小结形态及淋巴细胞数量均有所恢复。见图5。
3 讨论
免疫抑制是机体免疫功能受损,对抗原应答能力下降的一种异常状态,可表现出中医“虚”的症状。虚汗停颗粒取自经典名方“牡蛎散”,在原著中用于“诸虚不足,及新病暴虚,津液不固”,其中黄芪、牡蛎是其核心药对[7]。现代药理学研究表明,黄芪具有调节免疫、强心、调节糖代谢及抗氧化等作用,黄芪多糖可提高免疫抑制小鼠腹腔巨噬细胞吞噬功能及外周血淋巴细胞转化率[8-9]。牡蛎则具有保肝、抗疲劳及调节免疫功能等作用[10-12]。本研究发现,环磷酰胺大鼠模型可出现脾脏形态受损,脾小结及淋巴细胞减少,外周血淋巴细胞CD3、CD4、CD8细胞比例明显降低,血清中IgG、IgM、C4含量明显降低等免疫力低下表现。虚汗停干预可显著提高环磷酰胺模型大鼠血清中IgG、IgM含量,上调环磷酰胺模型大鼠外周血淋巴细胞CD3比例,同时改善模型大鼠脾脏病理形态,提示虚汗停颗粒可促进环磷酰胺模型大鼠的免疫器官及免疫细胞功能的恢复。
人体的肠道菌群及其生存的肠道环境构成了肠道微生态,是人体最主要最复杂的微生态,其中肠道菌群占据肠道微生态的核心地位。肠道菌群与机体的免疫功能有密切的关系[13]。研究表明,中药口服后在肠道内容物中驻留的未被吸收的药物成分包括未被吸收的初生代谢产物和次生代谢产物,这些肠中移行成分可能刺激消化道内壁,产生免疫应答,或是干预和重塑肠道菌群,或是刺激菌群分泌生物活性物质产生效应[14-15]。中药复方及中药单体对肠道菌群的调节作用已成为研究热点。研究表明,七味白术散不仅可促进双歧杆菌、乳酸菌、酵母菌等有益菌的增殖,还可促进肠道营养物质的消化及吸收[16];补肺健脾颗粒可提高小鼠腸道内双歧杆菌、乳杆菌和类杆菌的丰度,有利于维持肠道内环境平衡,增强人体抵抗力[17];四君子汤能够抑制有害菌、促进有益菌增殖,恢复结肠炎大鼠的菌群平衡,促进短链脂肪酸的生产[18];补益类中药(如党参)含有皂苷类成分,这些成分可以促进肠道内双歧杆菌、乳酸杆菌等有益菌的生长,增加肠道中乙酸的含量,抑制有害菌的定植[19]。本研究发现,虚汗停颗粒不仅可以显著调节环磷酰胺模型大鼠肠道菌群结构,使之趋于正常,还可以显著增加乳酸杆菌、Cyanobacterium含量。值得注意的是免疫抑制模型大鼠肠道的优势菌Holdemanella通常是一类致病菌,会增加其他细菌的感染,可分解肠道黏液,与炎症介质IL-6、IL-1β、TNF-α水平正相关[20]。而药物干预组(虚汗停、匹多莫德)中的优势菌Cyanobacterium可以合成大量的次生代谢产物,包括具有抗菌、抗病毒、抗真菌和抗癌活性的生物化合物[21]。乳酸杆菌可以拮抗致病菌,有助于维持机体对抗原的细胞和体液免疫反应[22]。以上研究结果表明,虚汗停颗粒干预后的优势菌属对于机体免疫功能有正向调节作用,可能是药物发挥效应的靶点之一。
参考文献
[1]夏伟,卢磊,邱勇,等.虚汗停颗粒治疗自汗盗汗临床疗效及安全性荟萃分析[J].辽宁中医药大学学报,2013,15(9):100-102.
[2]刘声波,朱柏华,王汝俊,等.虚汗停颗粒的药效学研究[J].中医研究,2002,15(1):16-18.
[3]任士庞,张肖瑾,赵兴,等.浅谈调脾论治小儿自汗[J].亚太传统医药,2016,12(8):66-67.
[4]张志勇.浅谈脾脏的免疫功能[J].菏泽医学专科学校学报,1991,3(2):20-21.
[5]郑华,魏秋梅,蒋健林,等.中药与肠道菌群相互作用的研究进展[J].中国民族民间医药,2018,27(22):54-58.
[6]丁佳敏,张竞,肖明明,等.方剂“从肠道菌群论治”的理论与实践[J].世界科学技术-中医药现代化,2018,20(2):157-162.
[7]叶潇,吴莹莹,左铮云.牡蛎散中黄芪、牡蛎药对的配伍作用[J].中国中医药现代远程教育,2018,16(6):96-98.
[8]朱丽萍.黄芪的药理研究及进展[J].内蒙古中医药,2018,37(3):98-99.
[9]史晶晶,时博,苗明三.黄芪多糖对环磷酰胺致免疫抑制小鼠免疫功能的影响[J].中医学报,2016,31(2):243-246.
[10]杨韵,徐波.牡蛎的化学成分及其生物活性研究进展[J].中国现代中药,2015,17(12):1345-1349.
[11]张冬青,沈伯华,高颖,等.牡蛎提取物对小鼠免疫功能的正向调节作用[J].上海免疫学杂志,1995,15(1):18.
[12]陈江华,佟丽,刘玉生,等.牡蛎提取物对免疫功能低下小鼠的正向免疫调节作用[J].第一军医大学学报,1998,18(2):149.
[13]张晓波,孙辉.肠道菌群对人体健康的作用及其应用[J].生物医学转化,2021,2(2):39-45.
[14]Xu J,Lian F,Zhao L,et al.Structural modulation of gut microbiota during alleviation of type 2 diabetes with a Chinese herbal formula[J].ISME J,2015,9(3):552-562.
[15]Zhou SS,Xu J,Zhu H,et al.Gut microbiota-involved mechanisms in enhancing systemic exposure of ginsenosides by coexisting polysaccharides in ginseng decoction[J].Sci Rep,2016,6:22474.
[16]谭周进,吴海,刘富林,等.超微七味白术散对肠道微生物及酶活性的影响[J].生态学报,2012,32(21):6856-6863.
[17]李玉英,王玺坤.补肺健脾颗粒对脾虚小鼠肠道菌群变化影响的研究[J].中医药学刊,2001,19(4):377,401.
[18]陈新君.复方四君子汤及党参多糖调节溃疡性结肠炎小鼠肠道菌群的作用研究[D].兰州:兰州大学,2016.
[19]王广,马淑霞,胡新俊,等.党参多糖对双歧杆菌和大肠埃希菌体外生长的影响[J].中国微生态学杂志,2010,22(3):199-201.
[20]Tang W,Yao X,Xia F,et al.Modulation of the Gut Microbiota in Rats by Hugan Qingzhi Tablets during the Treatment of High-Fat-Diet-Induced Nonalcoholic Fatty Liver Disease[J].Oxid Med Cell Longev,2018,2018:7261619.
[21]Abed RM,Dobretsov S,Sudesh K.Applications of cyanobacteria in biotechnology[J].J Appl Microbiol,2009,106(1):1-12.
[22]屈岩峰,岳莹雪,王丙然,等.乳酸菌黏附特性及其免疫调节作用研究进展[J].食品科技,2019,44(12):12-16.
(2021-07-07收稿 责任编辑:吴珊,徐颖)
