二甲双胍抑制PI3K-AKT-mTOR信号通路对四氯化碳诱导的小鼠急性肝损伤的影响
2021-09-18牛艳邦王晓玲陈晨任益凡张海利董胜利
牛艳邦,王晓玲,陈晨,任益凡,张海利,董胜利
1.山西医科大学第二医院普通外科,山西 太原030000;
2.山西省中医院检验科,山西 太原030012;
3.山西医科大学第一医院肿瘤科,山西太原030001
肝脏是人体内脏中维持生命的关键器官之一,在体内起代谢、解毒、造血以及免疫功能等多种作用,但易受创伤、感染、药物、自身免疫异常等各种体内外致病因素和损伤因子侵袭而引起肝损伤[1]。一直以来,肝脏疾病始终给人类的健康带来严重危害,其中急性肝损伤是临床上常见的对患者生命造成威胁的疾病之一,由于许多肝细胞受损,导致肝功能异常,进一步可能发展为急性肝功能衰竭[2]。为了减缓机体肝脏的进一步损伤,临床上在急性肝损伤早期选择快速有效的治疗药物意义重大[3]。
二甲双胍在临床上广泛用于治疗2型糖尿病,药效显著且毒副作用较小、效价比高[4]。近几年研究发现,二甲双胍在抑制炎症、抗肿瘤[5-6]、缓解非酒精性脂肪性肝炎症状[7]、预防酒精性肝损伤[8]方面也起到一定作用。此外,有文献报道,PI3K-AKTmTOR信号通路具有免疫协调功能[9-10],而且可平衡抗炎和促炎作用[11-13],而二甲双胍可抑制该信号通路[14]。因此,二甲双胍在急性肝损伤中可能参与PI3K-AKT-mTOR信号通路发挥抗炎作用。
本研究应用二甲双胍干预四氯化碳(carbon tetrachloride,CCL4)诱导小鼠急性肝损伤模型,研究其能否通过下调PI3K蛋白活化,进而导致AKT及mTOR蛋白的磷酸化受抑制,从而抑制mTOR活性实现抗炎作用,通过组织病理学,细胞炎症因子IL-6、TNFα、IL-10水平,PI3K、AKT、mTOR蛋白及相关转录因子Foxp3、ROR-γt蛋白表达水平,探讨二甲双胍在小鼠急性肝损伤中的抗炎作用及机制。
1 材料与方法
1.1 实验动物18只SPF级健康C57BL/6小鼠,雄性,6~8周龄,体重约20 g,由山西医科大学动物实验中心提供,机构许可证号:SYXK(晋)2015/0001。本实验在分子生物学系动物实验室进行,给与昼夜12 h光照,每笼6只,给予灭菌处理的饮用水和小鼠饲料,自由哺食。
1.2 主要试剂及仪器CCL4购自天津市风船化学试剂科技有限公司;橄榄油购自陕西圣瑞医药科技有限公司;盐酸二甲双胍片(格华止)购自中美上海施贵宝制药有限公司;TNF-α、IL-6和IL-10 ELISA试剂盒购自上海西唐生物科技有限公司;Trizol试剂购自美国Bosterbio公司;反转录试剂盒RevertaidTMFirst Strand cDNA Synthesis购自赛默飞世尔科技有限公司;兔抗人PI3K多克隆抗体、兔抗p-AKT多克隆抗体、兔抗AKT多克隆抗体、兔抗mTOR多克隆抗体和兔抗Foxp3多克隆抗体购自万类生物科技有限公司;兔抗ROR-γt多克隆抗体、兔抗p-mTOR多克隆抗体和兔抗p-PI3K多克隆抗体购自美国Bioworld Techology,Inc;BCA蛋白浓度测定试剂(minibioTM)购自百奥生物科技有限公司;核蛋白和胞浆蛋白提取试剂盒(KeyGE BioTECH)购自江苏凯基生物技术股份有限公司;RT-qPCR试剂盒TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseHPlus)购自日本TaKaRa Bio;实时定量PCR仪购自美国Applied Biosytems、全波长酶标仪(SpectraMaxR iD3)购自美国MOLECULAR DEVICES;化学发光凝胶成像系统(ChemicDocTMImaging System)购自美国Bio-Rad公司;BECKMAN AU5821全自动生化分析仪购自美国Beckman Coulter,Inc。
1.3 小鼠急性肝损伤模型的建立及分组给药 将18只C57BL/6小鼠平均分成3组:正常对照组、模型组、模型+干预组,每组6只。分别经小鼠腹腔注射等量生理盐水、生理盐水、二甲双胍(溶于生理盐水,按照小鼠体重400 mg/kg剂量给药)预处理6 h,随后将CCL4加入橄榄油中按2∶3配制成混合溶液,按5 mL/kg剂量分别经腹腔注射模型组和模型+干预组小鼠,同时正常对照组注射等量生理盐水。给药18 h后,称量各组小鼠体重,用4%水合氯醛麻醉小鼠,摘眼球取血,离心分离上清,将血清置-20℃保存备用;在无菌条件下打开小鼠腹腔,取出完整肝脏,肉眼观察肝脏的表观形态变化并拍照称重,计算小鼠肝重体重比;随机取部分肝组织置于多聚甲醛固定液中,石蜡包埋肝组织制备切片;将剩余肝组织分装冻存管中-80℃保存备用。
1.4 肝组织病理学观察 将制备的肝组织切片进行HE染色,显微镜观察肝细胞的形态结构、肝小叶等的改变并拍照,分析肝脏组织病理变化。
1.5 血清转氨酶检测 使用BECKMAN AU5821全自动生化分析仪检测各组小鼠血清转氨酶ALT、AST水平。
1.6 肝组织中炎症因子IL-6、IL-10、TNF-α水平的检测
1.6.1 ELISA法 按照试剂盒说明书操作。
1.6.2 RT-qPCR法 用Trizol试剂提取各组小鼠肝组织总RNA,取1 μL RNA,使用反转录试剂盒反转成cDNA,以其为模板进行PCR扩增,反应条件为:94℃预变性5 min;95℃变性60 s,60℃退火45 s,72℃延伸60 s,共40个循环。相关引物序列信息见表1,引物由生工生物工程(上海)股份有限公司合成。

表1 RT-qPCR引物序列Tab.1 Primer sequences for RT-qPCR
1.7 肝组织中PI3K-AKT-mTOR信号通路相关蛋白表达的检测 采用Western blot法。取小鼠肝脏组织100 mg,在冰上按照核蛋白和胞浆蛋白提取试剂盒说明书提取核蛋白、浆蛋白。BCA法测定总蛋白浓度,蛋白样品经10%SDS-PAGE分离后,转移至PVDF膜上,TBST缓冲液洗膜3次,每次5 min,用5%脱脂奶粉室温封闭2 h;TBST缓冲液洗膜3次,每次10 min,加入兔抗p-PI3K(1∶1 000稀释)、PI3K(1∶500稀释)、p-AKT(1∶1 000稀释)、AKT(1∶1 000稀释)、p-mTOR(1∶500稀释)、mTOR(1∶500稀释)、Foxp3(1∶500稀释)、ROR-γt(1∶1 000稀释)多克隆抗体,4℃孵育过夜;TBST缓冲液洗膜后,加入HRP标记的山羊抗兔IgG(1∶5 000稀释),室温孵育1 h;TBST缓冲液洗膜3次,增强化学发光试剂显影,分析灰度值,计算各蛋白在肝组织中的相对表达量。
1.8 统计学分析 采用SPSS 21.0软件进行统计学分析,对所有分析数据进行正态分布检验,方差齐性检验,采用单因素方差分析比较多组样本均数差异,组间数据两两比较采用LSD-t法,不服从正态分布数据经转换后再进行统计学分析,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠肝脏的形态学及肝重体重比变化 与正常对照组相比,模型组小鼠肝脏颜色灰暗肿胀,质地偏硬,肝重体重比明显升高(F=5.363,P=0.026),提示肝脏出现炎性渗出、水肿;与模型组相比,给予二甲双胍预保护后,肝脏肿胀减轻,肝重体重比明显下降(F=5.363,P=0.040)。见图1和图2。

图1 各组小鼠肝脏的表观形态Fig.1 Appearance of livers of mice in various groups
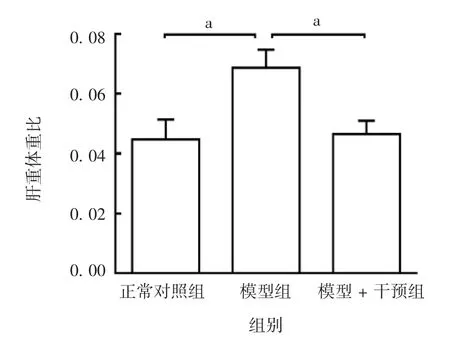
图2 各组小鼠的肝重体重比Fig.2 Ratios of liver weight to body weight of mice in various groups
2.2 小鼠肝脏病理学改变 正常对照组小鼠肝脏细胞排列整齐,组织结构完整,未见异常病理学变化;与正常对照组相比,模型组小鼠肝脏细胞核质比变大,出现不同程度的气球样变及坏死灶,且肝小叶不规则;与模型组相比,给予二甲双胍预保护后,小鼠肝细胞气球样变和坏死灶明显减少,肝组织结构较完整。见图3。
2.3 小鼠血清转氨酶变化 与正常对照组相比,模型组小鼠血清中ALT、AST水平均明显上升(F分别为16.126和25.568,P均<0.001);而给予二甲双胍预保护后,小鼠血清ALT和AST水平均明显下降(F分别为16.126和25.568,P分别为0.007和0.006)。见图4。

图4 各组小鼠血清中ALT(A)和AST(B)水平Fig.4 ALT(A)and AST(B)levels in sera of mice in various groups
2.4 小鼠肝组织中炎症因子IL-6、IL-10、TNF-α水平的变化
2.4.1 ELISA法 与正常对照组相比,模型组小鼠肝组织匀浆中IL-6、IL-10、TNF-α的水平均明显升高(F分别为92.88、165.1和115.6,P均<0.001);给予二甲双胍预保护后,小鼠肝组织匀浆中IL-6、TNF-α的水平明显降低(F分别为92.88和115.6,P均<0.05),IL-10水平明显升高(F=165.1,P=0.020)。见图5。

图5 各组小鼠肝组织匀浆中IL-6(A)、IL-10(B)和TNFα(C)水平Fig.5 IL-6(A),IL-10(B)and TNF-α(C)levels in liver tissue homogenate of mice in various groups
2.4.2 RT-qPCR法 与正常对照组相比,模型组小鼠肝组织中IL-6和TNF-α基因mRNA水平明显升高(F分别为8.012和9.878,P分别为0.004和0.0014),IL-10基因mRNA水平也升高,但差异无统计学意义(F=21.15,P=0.127);给予二甲双胍预保护后,小鼠肝组织中IL-6和TNF-α基因mRNA水平显著下降(F分别为8.012和9.878,P分别为0.042和0.036),而IL-10基因mRNA水平更高(F=21.15,P=0.015)。见图6。

图3各组小鼠的肝组织病理观察(HE染色)Fig.3 Histopathological examination of livers of mice in various groups(HE staining)

图6 各组小鼠肝组织中IL-6(A)、IL-10(B)和TNF-α(C)基因mRNA水平Fig.6 IL-6(A),IL-10(B)and TNF-α(C)mRNA levels in liver tissue of mice in various groups
2.5小鼠肝组织中PI3K-Akt-mTOR信号通路相关蛋白表达的变化 与正常对照组相比,模型组小鼠肝组织中p-PI3K、p-AKT、p-mTOR、ROR-γt、Foxp3蛋白的表达量均显著升高(F分别为16.08、9.208、7.888、20.07和22.08,P<0.05);给予二甲双胍预保护后,p-PI3K、p-AKT、p-mTOR、ROR-γt蛋白的表达量均有不同程度的降低(F分别为16.08、9.208、7.888和20.07,P<0.05),而Foxp3蛋白的表达水平仍上升(F=22.08,P<0.05)。见图7和图8。
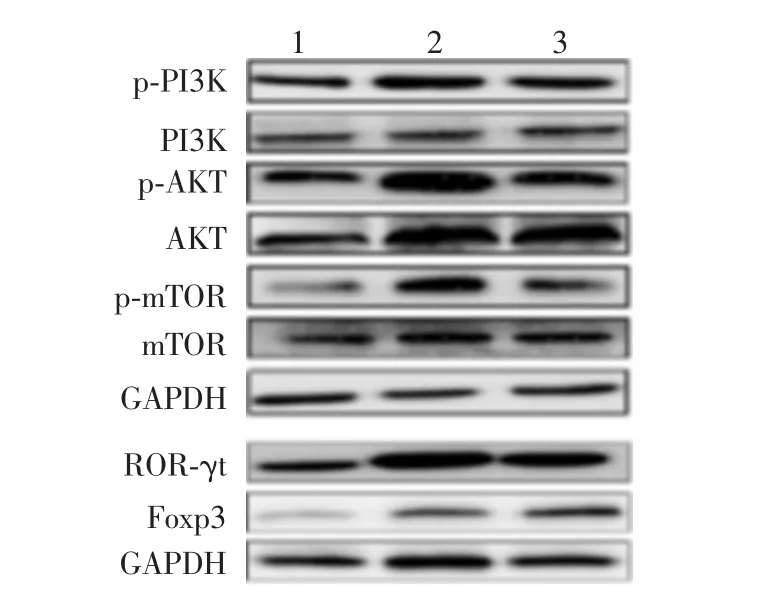
图7 Western blot法分析各组小鼠肝组织中PI3K-AktmTOR信号通路相关蛋白的表达Fig.7 Western blotting of expression of PI3K-Akt-mTOR signaling pathway-associated proteins in liver tissue of mice in various groups
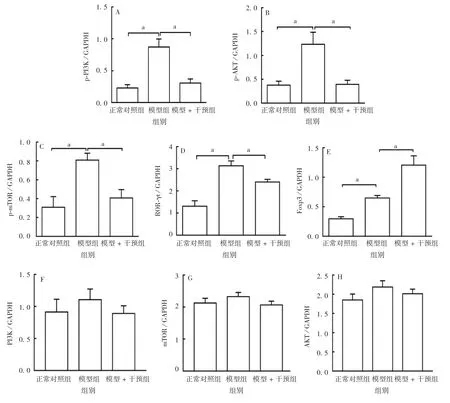
图8 各组小鼠肝组织中PI3K-Akt-mTOR信号通路相关蛋白的表达Fig.8 Expression of PI3K-Akt-mTOR signaling pathway-associated proteins in liver tissue of mice in various groups
3 讨论
急性肝损伤主要是由有毒化学物质、药物、病毒和细菌等多种因素造成的肝功能异常[15],其中CCL4作为一种细胞毒性物质,诱导的肝损伤为经典的实验研究模型,是目前最常用的急性肝损伤模型之一。
PI3K-Akt-mTOR通路在细胞中参与多种功能活动。PI3K为一种细胞内磷脂酰肌醇激酶,研究发现,在Toll样受体(Toll-like receptor,TLR)介导的炎症发生时抑制PI3K信号,可抑制巨噬细胞和树突状细胞促炎因子的分泌以及增加抗炎因子IL-10的分泌[13]。AKT也称蛋白激酶B,为PI3K下游重要的效应物。PI3K转导信号可通过激活Akt下游的NFκB促进促炎细胞因子(如TNF-α、IL-6)表达[13]。mTOR为一类丝氨酸/苏氨酸激酶,可调控基因转录、蛋白合成,在细胞生长、增殖分化、凋亡等方面发挥重要作用,另外,mTOR还可以通过影响T细胞分化调节免疫。研究发现,抑制mTOR蛋白表达可抑制CD4+T细胞分化为Th17细胞,同时可以增强Treg细胞的生成[16-17]。目前,mTOR被广泛认为是参与Treg细胞分化与增殖的负性调控因子,因此,抑制PI3K/Akt/mTOR通路可促使Treg/Th17平衡向免疫耐受方向转变。
Th17细胞为一种能够加重炎症反应的受转录因子(ROR-γt)调控的特异性CD4+T细胞[18-19],Treg细胞为一种具有免疫抑制作用的受转录因子叉状头盒P3(Foxp3)调控的CD4+T细胞亚群,通过释放IL-10和TGF-β减轻炎症反应[20-21]。ROR-γt和Foxp3作为主要的标志性转录因子,分别在Th17和Treg细胞内特异性高表达。
本研究首先观察小鼠肝脏的形态学、组织病理学变化,初步评估小鼠肝脏的受损程度。与模型组相比,给予二甲双胍预保护可显著改善肝脏的光泽,减少肝细胞气球样变性及灶状坏死,其肝细胞、肝索排列较整齐,肝小叶结构相对完整,表明二甲双胍对CCL4诱导的急性肝损伤具有一定的缓解作用。
一般情况下,肝脏发生病变肝细胞受损时,存在于肝细胞内的血清转氨酶会被释放到血液中,转氨酶的升高程度常与肝细胞损伤一致。本研究发现,小鼠腹腔注射CCL4 18 h后,可引起血清转氨酶上升,而给予二甲双胍预保护处理,小鼠血清转氨酶浓度明显低于模型组。因此,通过小鼠肝脏形态学、组织病理学及血清学变化得知,二甲双胍对CCL4诱导的急性肝损伤具有一定的保护作用。
当肝脏发生急性肝损伤时,会发生炎症反应产生并释放炎症因子,过度炎症反应会促进肝细胞损伤坏死,肝功能发生紊乱[22]。本研究通过测定小鼠肝组织中炎性因子的表达变化发现,与正常对照组相比,小鼠腹腔注射CCL4 18 h后,IL-6、TNF-α、IL-10表达水平都均升高;而经二甲双胍预保护6 h,小鼠体内的IL-6、TNF-α的表达水平明显下降,而IL-10表达水平更高,表明二甲双胍可有效抑制小鼠急性肝损伤的炎症。
为明确PI3K-Akt-mTOR信号通路参与急性肝损伤的炎症反应,本研究通过Western blot检测小鼠肝组织中PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR、Foxp3及ROR-γt的表达情况,结果发现,与正常对照组相比,小鼠腹腔注射CCL4可显著引起PI3K-AktmTOR信号通路的磷酸化,给予二甲双胍预保护6 h,PI3K-Akt-mTOR信号通路的磷酸化受到一定抑制,表明二甲双胍可通过抑制PI3K-Akt-mTOR信号通路对急性肝损伤起到保护作用。同时,Foxp3及ROR-γt表达水平的变化表明抑制PI3K/Akt/mTOR通路可促进Treg细胞分化,同时抑制Th17细胞生成,调节肝组织的免疫反应。
综上所述,二甲双胍可通过抑制PI3K-AKT-mTOR信号通路调节炎症反应,从而减轻CCL4诱导的小鼠急性肝损伤,对小鼠肝脏起到一定的保护作用,为研究二甲双胍减轻急性肝损伤的作用机制及临床治疗提供了一种新的思路。但PI3K/Akt/mTOR信号通路在二甲双胍改善急性肝损伤过程中不是唯一途径,相关通路机制仍需进一步研究。
