人凝血因子Ⅷ制品中聚山梨酯80残留量高效液相色谱-电喷雾检测器检测方法的建立及验证
2021-09-18邵天舒丁锐周长明郭雷
邵天舒,丁锐,周长明,郭雷
北京市药品检验所国家药品监督管理局仿制药研究与评价重点实验室中药成分分析与生物评价北京市重点实验室,北京102206
人凝血因子Ⅷ制品是由健康人血浆经分离、提取、纯化、冻干等工艺制得的一种血液制品,是甲型血友病患者目前最有效的预防及治疗出血的方法即凝血因子替代疗法不可或缺的主要产品,患者通常需终生用药[1-2]。鉴于该产品是以人血浆为原料,存在传播人类免疫缺陷病毒(human immunodeficiency virus,HIV)、乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)等病毒的重大风险,原国家食品药品监督管理局于2002年发布的《血液制品去除/灭活病毒技术方法及验证指导原则》提出“凝血因子类制品生产过程中应有特定的去除/灭活脂包膜和非脂包膜病毒的方法”的要求[3]。目前,各生产企业对人凝血因子Ⅷ制品中脂包膜病毒普遍采用有机溶剂/表面活性剂(S/D)法进行灭活,其中聚山梨酯80为该方法中常用的表面活性剂之一[4]。由于聚山梨酯80具有很强的破裂细胞膜的作用,特别是注射剂中的聚山梨酯80能直接进入血液,可引起溶血、血管扩张及血压下降等不良反应;此外,其在人体内水解后释放出的油酸还有诱发组胺释放,发生急性超敏反应的风险[5]。因此,为最大限度降低血友病患者的用药风险,《中国药典》三部(2015版)规定,人凝血因子Ⅷ制品中聚山梨酯80残留量应≤100 μg/mL,测定方法(简称药典方法)是利用其化学结构中的聚乙氧基可与硫氰酸钴铵反应形成蓝色复合物,将该复合物溶于二氯甲烷,通过测定其在波长620 nm处的吸光度测定含量[6]。该方法为经典方法已使用多年,但需先将样品蛋白沉淀后离心取上清液,再通过空气吹扫浓缩后进行显色反应,且显色反应过程需在室温放置1.5 h,并每15 min振荡1次,加之二氯甲烷极易挥发,不仅操作步骤繁琐不便,难以满足生产企业及药检机构大批量快速测定的需求,且试验过程大量使用有机溶剂二氯甲烷,易造成环境污染,危害操作者健康。因此,有必要建立一种更准确、便捷、环保的方法来检测人凝血因子Ⅷ制品中的聚山梨酯80残留量。
聚山梨酯80是由山梨醇及其失水、双失水化合物(山梨醇酐)与油酸和环氧乙烷缩合制得的一类强亲水性化合物。由于其化学结构中含有较多的亲水性基团,在常规C18色谱柱上几乎无保留,难以测定,且其属于大分子聚合物,在有关文献报道中,采用高效液相色谱(HPLC)法测定聚山梨酯80含量的大多选择分子排阻色谱[7-8]。由于人凝血因子Ⅷ制品中含有大量蛋白类物质,在分子排阻过程中难以与聚山梨酯80峰分离。因此,本实验选用一种将离子交换与反相分配相结合的色谱柱,该色谱柱由两种混合模式的填料组成,即在聚N-乙烯基吡咯烷酮的表面键合N’,N’-二甲基丁胺,前者作为反相分离基质,后者则作为离子交换分离基质,使该色谱柱同时具备反相和离子交换双重分离机理,可共同对聚山梨酯80产生保留作用,适用于人凝血因子Ⅷ等含蛋白质量较高的生物制品中聚山梨酯80的分离。同时,由于聚山梨酯80无生色基团,仅有末端紫外吸收,因此一般采用蒸发光散射检测器(evaporative light scattering detector,ELSD)进行检测[9],但该检测器普遍存在重现性差、灵敏度低等问题。而近年来出现的电喷雾检测器(charged aerosol detection,CAD)是利用电晕装置(高压铂金电极)使氮气形成带电粒子,与挥发掉溶剂的溶质颗粒在碰撞室充分碰撞混合,使后者带上正电,再经高灵敏度的静电计测量出总电信号,检测信号与溶质质量呈正相关。该检测器灵敏度高、重现性好,且为通用型检测器,逐渐成为检测无紫外吸收物质的优选方法[10-11]。
本研究建立了以反相-离子交换混合模式色谱柱分离、CAD检测人凝血因子Ⅷ制品中聚山梨酯80含量的方法,并进行验证,同时与ELSD方法进行比较,旨在为人凝血因子Ⅷ制品质量标准的提高提供参考。
1 材料与方法
1.1 样品及标准品10批人凝血因子Ⅷ样品(批号分别为:201908054、201909056~201909060、2019-09062、201909063、201910066、201910068,规格:200 IU/瓶)由国内A企业生产,为北京市药品检验所批签发留样;聚山梨酯80标准品(批号:R072G0)为美国药典USP标准品。
1.2 主要试剂及仪器 异丙醇(色谱级)购自德国Merck公司;无水甲酸(优级醇)购自国药集团化学试剂有限公司;UltiMate3000高效液相色谱仪(配备Corona Ultra型CAD)购自美国Thermo Fisher Scientific公司;岛津20AT高效液相色谱仪购自日本岛津公司;Alltech 2000ES型ELSD购自美国Alltech公司;反相-离子交换混合色谱柱Oasis MAX(2.1 mm×20 mm,30 μm)购自美国Waters公司;Milli-Q型超纯水机购自美国Millipore公司;WD-A药物稳定性检查仪购自天津药典标准仪器厂。
1.3 溶液的制备
1.3.1 标准品溶液 精密称取聚山梨酯80标准品1.025g,用超纯水定容至100 mL,配制为10.25 mg/mL的聚山梨酯80标准品溶液,作为标准品贮备液。分别精密量取标准品贮备液0.125、0.25、0.5、1.0、2.0、
2.5 mL,加超纯水定容至100 mL量瓶,摇匀,配制为12.8、25.6、51.3、102.5、205.0、256.3 μg/mL聚山梨酯80的系列标准品溶液。
1.3.2 供试品溶液 取201908054、201909056~201909060、201909062、201909063、201910066、2019-10068批样品各1瓶,分别精密加入超纯水10 mL,溶解摇匀,作为供试品溶液备用。
1.4 色谱条件设置 采用色谱柱Oasis MAX;流动相A液为含2%(V/V)甲酸的异丙醇∶水(20∶80)溶液,B液为含2%(V/V)甲酸的异丙醇溶液。CAD条件:流动相流速为1.0 mL/min,柱温为30℃,进样量为30 μL,CAD雾化气压力为253.4 Pa,氮气流速为4 L/min,雾化室温度为30℃,采样频率为2 Hz。ELSD条件:流动相流速、柱温、进样量条件同CAD条件,ELSD漂移管温度为105℃,空气流速为1.6 L/min,分流模式为开。梯度洗脱程序见表1。

表1 梯度洗脱程序Tab.1 Gradient elution procedure
1.5 方法的验证
1.5.1 系统适用性 取浓度为102.5 μg/mL的标准品溶液、供试品溶液、加标样品溶液(1瓶样品中加入25.6 μg/mL标准品溶液溶解)及空白溶液(超纯水),分别按1.4项色谱条件检测,采集色谱图。
1.5.2 线性范围 取系列标准品溶液,分别按1.4项色谱条件检测,以聚山梨酯80浓度为横坐标,峰面积为纵坐标绘制标准曲线,进行线性回归,计算相关系数(r)。
1.5.3 定量限及检测限 精密量取12.8 μg/mL的标准品溶液适量,进行系列稀释后分别按1.4项色谱条件检测,以色谱峰信噪比(S/N)≥3确定检测限,S/N≥10确定定量限。
1.5.4 重复性 取201910066批供试品溶液6份,按1.4项色谱条件检测,计算聚山梨酯80残留量的RSD。
1.5.5 稳定性 取201910066批供试品溶液,于室温分别放置0、2、4、6、8、10 h,按1.4项色谱条件检测,计算聚山梨酯80残留量的RSD。
1.5.6 准确性 分别精密量取标准品贮备液1.6、2.0、2.4 mL,置50 mL量瓶中,加超纯水定容,摇匀。取201909059批样品9瓶,分别加入定容后的标准品贮备液10 mL,配制低、中、高浓度(32.8、41.0、49.2 μg/mL)的加标样品各3份,按1.4项色谱条件检测,按下式计算加标样品中聚山梨酯80的加标回收率及RSD。
加标回收率(%)=(实测浓度-理论浓度)/加标浓度×100%
1.6 方法的应用 分别采用药典方法及1.4项色谱条件检测201908054、201909056~201909060、2019 09062、201909063、201910066及201910068批样品,按标准曲线法计算样品中聚山梨酯80残留量,共检测2次。
2 结果
2.1 方法的验证
2.1.1 系统适用性 聚山梨酯80标准品、供试品及加标样品中聚山梨酯80色谱峰的保留时间均为5.9 min,供试品及加标样品在11 min可见其他色谱峰,但与聚山梨酯80色谱峰充分分离(分离度为9.0),无干扰;空白溶液未见色谱峰。见图1~4。表明系统适用性良好。
2.1.2 线性范围 采用CAD检测,聚山梨酯80标准品在12.8~256.3 μg/mL范围内,回归方程y=121.42x+1.321 7,r=0.998 0,线性关系良好。采用ELSD检测,因其中聚山梨酯80色谱峰面积与浓度不呈线性关系,以峰面积对数为纵坐标,浓度对数为横坐标进行线性回归,聚山梨酯80浓度在12.8~256.3 μg/mL范围内,回归方程y=1.316 1x+3.088 5,r=0.998 8,线性关系良好。见图2。

图2 CAD(A)及ELSD检测(B)聚山梨酯80标准品的标准曲线Fig.2 Standard curve for determination of polysorbate content by CAD(A)and ELSD(B)
2.1.3 定量限及检测限 采用CAD检测,定量限约为3.20 μg/mL,检测限约为1.07 μg/mL。采用ELSD检测,定量限约为6.41 μg/mL,检测限约为2.14 μg/mL。表明采用CAD法优于ELSD法。
2.1.4 重复性 采用CAD检测,6份供试品溶液中聚山梨酯80浓度分别为55.05、54.67、53.85、53.95、53.99和53.82 μg/mL,RSD为0.86%,表明方法重复性良好。采用ELSD检测,6份供试品溶液中聚山梨酯80浓度分别为38.69、38.05、37.59、38.00、31.58和30.98 μg/mL,RSD为9.01%,表明该方法重复性较CAD法欠佳。
2.1.5 稳定性 采用CAD检测,室温放置0、2、4、6、8、10 h时,供试品溶液中聚山梨酯80浓度分别为54.08、54.92、54.13、53.88、54.44和53.97 μg/mL,RSD为0.65%,表明方法稳定性良好。因ELSD检测检测重复性欠佳,未对其稳定性进行考察。
2.1.6 准确性 采用CAD检测,低、中、高浓度的加标样品回收率在96.85%~101.49%之间,RSD为1.54%,见表2,表明该方法准确性良好。采用ELSD检测,低、中、高浓度的加标样品回收率在57.55%~63.75%之间,RSD为3.03%,见表3,表明该方法准确性较CAD法欠佳。
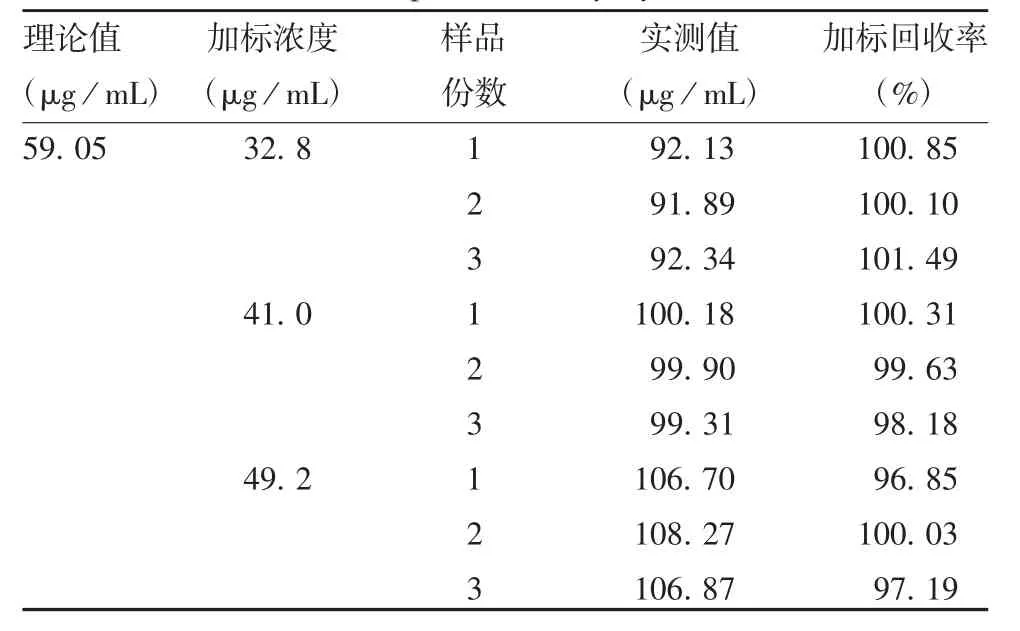
表2 CAD检测的加标回收率Tab.2 Determination of spike recovery by CAD

表3 ELSD检测的加标回收率Tab.3 Determination of spike recovery by ELSD
2.2 方法的应用10批样品中聚山梨酯80残留量经CAD检测,为56.09~66.75 μg/mL,RSD为4.9%;经ELSD检测,为40.16~50.40 μg/mL,RSD为6.9%;经药典方法检测,为51~68 μg/mL,RSD为8.6%。见表4。结果均符合《中国药典》要求。
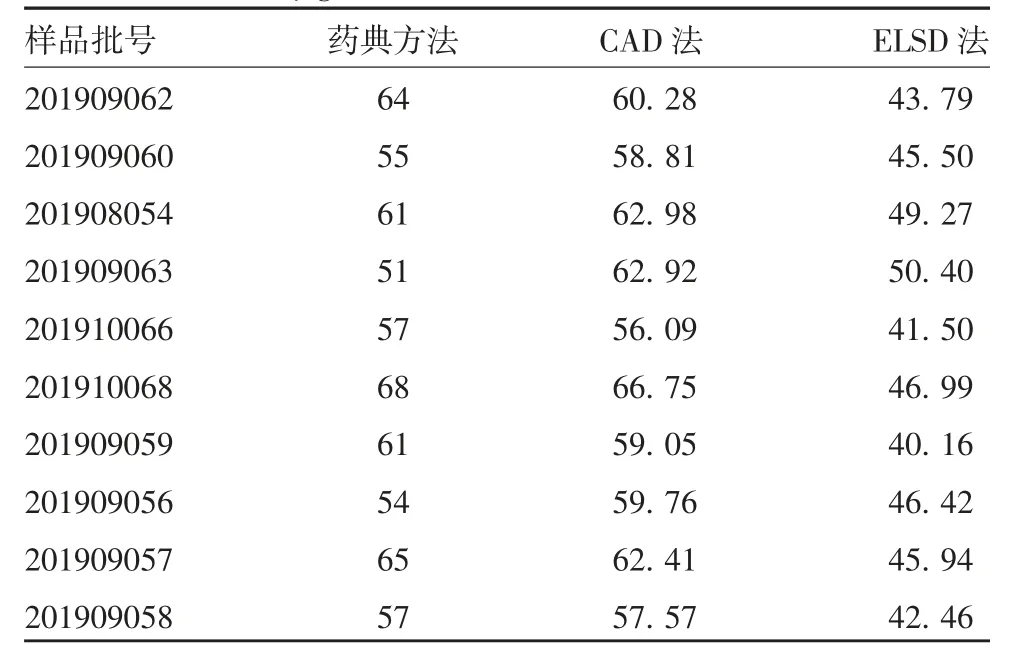
表4 10批样品中聚山梨酯80残留量的药典方法、CAD及ELSD法检测结果(μg/mL)Tab.4 Determination results of polysorbate contents in ten batches of samples by the method in Chinese Pharmacopeia,CAD and ELSD(μg/mL)

图1空白溶液(A)、聚山梨酯80标准品(B)、人凝血因子Ⅷ供试品(C)、加标样品(D)的色谱图Fig.1 Chromatogram of blank solution(A),polysorbate 80 standard(B),human coagulation factorⅧsample(C)and spike sample(D)
3 讨论
从本文方法的验证结果比较可看出,CAD与ELSD检测仅在线性范围上无差异,在定量限、检测限、重复性及准确性方面CAD均明显优于ELSD检测,其原因主要有两点:一是ELSD检测在梯度洗脱的两相转换过程中的基线漂移较明显,且达到平衡时间较长,而CAD检测则相对平稳,且达到平衡较快;二是由于目前CAD检测本身具有流路切换功能,采用该功能可使死时间内被冲出的蛋白质直接进入废液而避免对检测器造成污染,而常规ELSD检测因不具备该功能,使得较高浓度的蛋白质进入检测器,在0~1 min被洗脱,出现1个极大的蛋白峰,对后续基线平衡造成影响,同时由于大量蛋白质在漂移管中,致使在连续进样多针后其基线噪音升高,峰面积下降,造成重复性、准确性均较差。
10批样品按药典方法检测聚山梨酯80残留量的RSD为8.6%,高于CAD检测的RSD(4.9%),主要原因是药典方法操作步骤复杂,特别是在乙醇-氯化钠饱和溶液洗涤及空气吹扫浓缩的步骤,不同样品之间的操作极易产生差异,加之溶剂二氯甲烷易挥发,上述问题均有可能导致结果出现较大偏差。
本实验测定的10批人凝血因子Ⅷ制品均为同一企业2019年下半年生产,10批样品中聚山梨酯80残留量最高值与最低值的差为10.66 μg/mL,RSD为4.9%。采用S/D灭活的聚山梨酯80通常于病毒灭活工艺完成后,在后续的超滤层析等步骤中除去。尽管10批产品的聚山梨酯80残留量均未超出《中国药典》三部(2015版)规定的限值,但鉴于聚山梨酯80有引起不良反应的风险,仍建议生产企业通过不断改进工艺等措施对产品中聚山梨酯80残留量进行更为有效的控制。
综述所述,本研究成功建立了检测人凝血因子Ⅷ制品中聚山梨酯80残留量的HPLC-CAD法,该方法在重复性、准确性及灵敏度方面均优于ELSD,为人凝血因子Ⅷ制品质量标准的提升提供了参考。
