近端肾小管上皮细胞5羟色胺降解系统激活与肾脏缺血再灌注损伤的关系
2021-09-18金佳琦梁秀睿张誉馨袁安生刘润坤傅继华
徐 凡 金佳琦 张 怡 关 晶 梁秀睿 张誉馨 袁安生 刘润坤 傅继华
肾脏缺血再灌注损伤(RIRI)在临床上具有高发病率和死亡率[1]。肾脏属于高灌流器官,在肾移植、化学毒物刺激等情况时,易造成RIRI、甚至肾衰竭[2]。尽管RIRI的完整病理机制尚未了解,但可以确定的是再灌注产生的活性氧(ROS)可能是关键诱导因子,从而导致氧化应激、炎症、细胞凋亡等[3-4]。
已有文献报道5羟色胺(5-HT) 对肾脏具有重要的生理作用。芳香族L-氨基酸脱羧酶(AADC)的表达已在肾近端细胞中得到证实[5],而5-HT的合成正是以色氨酸为底物,经色氨酸羟化酶(Tph)、AADC两步催化形成[6]。5-HT可在线粒体被单胺氧化酶A(MAO-A)催化降解。在大鼠RIRI时, MAO-A已被确定为细胞内ROS的重要来源[7],肾脏皮质中MAO-A产生的ROS在早期缺血再灌注(IR)阶段中对氧化应激、炎症、细胞凋亡和坏死起着至关重要的作用[8]。研究表明,外周5-HT系统过度激活会导致周围血管疾病和糖尿病性肾病[9-11],使用5-HT2A受体(5-HT2AR)拮抗剂盐酸沙格雷酯(SH)可以治疗缺血性心脏病,再灌注损伤和糖尿病肾病等[9],提示5-HT2AR也参与IR导致器官损伤的过程。
本课题组前期研究发现,外周5-HT合成、5-HT2AR、5-HT降解与动脉粥样硬化、糖尿病性疲劳、非酒精性脂肪肝及炎症等慢性代谢性疾病密切相关[12-15]。我们推测,RIRI的发生可能也与5-HT系统的异常激活相关。本研究通过建立大鼠RIRI模型,结合药物治疗研究,评估肾脏5-HT系统在RIRI时所起的作用。
材料与方法
材料和试剂清洁级Wistar大鼠,体重 200~220g,购自扬州大学比较医学中心,在标准实验环境(光照12h,黑暗12h和室温 21℃±2℃)喂养。实验方案均获得中国药科大学实验动物伦理委员会审查和批准。
SH (上海乾劲化工);卡比多巴(CDP)(浙江手心制药);血清肌酐(SCr)、尿素氮(BUN)、丙二醛(MDA)、总超氧化物歧化酶(T-SOD)检测试剂盒(南京建成生物工程研究所);5-HT、ROS、肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)ELISA试剂盒(上海酶联);TUNEL FITC凋亡检测试剂盒(南京诺唯赞生物科技有限公司)、B淋巴细胞瘤2 (Bcl-2)抗体(沈阳万类);5-HT2AR、MAO-A、半胱氨酸天冬氨酸蛋白酶3(Caspase3)、Caspase9、Bcl-2相关X蛋白(Bax)抗体(美国Santa Cruz);Tph1及AADC抗体(美国Signalway Antibody);β-acin抗体(武汉三鹰生物技术)。
方法
RIRI模型的建立 参考文献方法[16],大鼠腹腔注射10%水合氯醛麻醉,右肾切除,左肾分离肾动脉和静脉,用动脉夹夹闭致肾缺血45 min,然后放开行再灌注24h,构建RIRI模型。假手术组摘除右肾,分离左肾动脉及静脉,但不进行IR处理。实验结束后,经麻醉后腹主动脉取血获得血清,取肾组织。
分组和给药 48只大鼠适应性喂养1周后随机分为6组:假手术组、RIRI模型组、SH给药组、CDP给药组、SH+CDP联合预防组(p-SC)及治疗(t-SC)组,每组8只。药物以0.5% 羧甲基纤维素钠(CMC-Na)溶液助溶。p-SC、t-SC中SH、CDP用量比率为SH∶CDP=2∶1,该比率SH、CDP接近等摩尔剂量用药。各组给药剂量相同,均为60 mg/(kg·次),灌胃给药(i.g.)。除假手术组、RIRI模型组及t-SC组i.g. CMC-Na溶液外,其他给药组需在造模前预防性给药,每12h给药一次,连续给药2d,建立RIRI模型。t-SC组于造模后30 min、8h、20h各给药一次;p-SC组于造模前2h,造模后6h、14h、20h各给药一次。24h后处死动物。
生化指标检 测按照试剂盒说明,测定大鼠SCr、BUN、MDA、T-SOD含量;使用ELISA试剂盒检测5-HT、ROS、TNF-α、IL-6含量。酶标仪(M200 Pro,瑞士Tecan)测量OD值。
肾组织HE、免疫组化及TUNEL染色 (1)苏木精-伊红(HE)染色肾组织进行HE染色,显微镜观察肾组织细胞形态;(2)免疫组化染色按免疫组化两步法检测肾组织5-HT2AR、AADC、Tph1、MAO-A蛋白表达,显微镜下观察;(3)TUNEL染色使用试剂盒评估肾组织凋亡,激光共聚焦显微镜进行观察。
Western印迹 使用RIPA(RIPA:PMSF:磷酸酶抑制剂=100∶1∶1)裂解肾组织。将等量蛋白在10% SDS-聚丙烯酰胺凝胶上电泳分离,湿法转膜,用5% BSA封闭、加相应一抗并在4℃下孵育过夜,将膜与二抗在37℃下孵育。全自动化学发光仪(Tanon 5200,上海天能)检测灰度。以β-actin为内参照,使用Image J软件对目的条带半定量分析。
统计学方法用《SPSS 17.0》软件对数据进行统计学处理。符合正态分布的计量资料采用均数±标准差表示,两组间比较采用t检验;多组间比较用单因素方差分析,选择LSD检验(方差齐)或Games-Howell检验(方差不齐)。P<0.05为差异有统计学意义。
结 果
IR致大鼠肾损伤及SH、CDP的治疗作用与假手术组比较,RIRI模型组血液SCr、BUN及肾组织MDA、TNF-α、IL-6显著升高而T-SOD活力降低(P<0.05) (表1),提示模型组肾功能明显受损、肾组织出现氧化应激、炎症。肾组织HE染色发现,模型组皮质部肾小球周围肾小管出现明显病变,见肾小管上皮细胞脱落、坏死,管腔扩张,管形破坏(图1A);而髓质部肾小管病变轻微,肾小管破坏不明显(图1B)。与模型组比较,各给药组的SCr、BUN、MDA、TNF-α、IL-6水平均明显降低、T-SOD升高(P<0.05);其中,p-SC、t-SC组效果明显好于SH、CDP组(P<0.05),p-SC、t-SC组间没有差异(P>0.05);HE染色也可见各给药组皮质部肾小管病变明显减轻,尤其p-SC、t-SC组已没有病变。结果提示,SH、CDP治疗可明显抑制IR引起的肾功能降低,肾组织氧化应激、炎症及肾小管病变,联合给药显示更好疗效、有强烈的抑制作用。
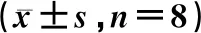
表1 各组肾功能、氧化应激及炎症因子的比较
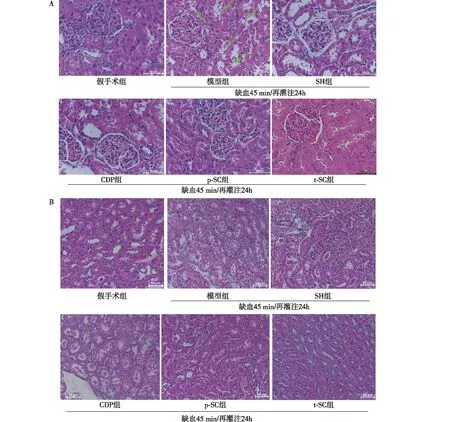
图1 A:各组肾皮质部区域病理图,模型组肾小管上皮细胞脱落、坏死,管控扩张,管形破坏(↑)(HE,×400);B:各组肾髓质部区域病理图,模型组肾小管病变轻微,肾小管破坏不明显(HE,×200)
肾脏IRI与5-HT系统激活的关系Western印迹表明(图2),与假手术组比较,Tph1、AADC、5-HT2AR和MAO-A在RIRI模型肾组织中的表达量显著升高(P<0.05);与模型组比较,SH组、p-SC组及t-SC组Tph1、AADC、MAO-A的表达量明显被抑制(P<0.05),但所有给药组均不能抑制5-HT2AR表达量的升高(P>0.05),且CDP组只明显抑制MAO-A表达量的升高(P<0.05); p-SC与t-SC组间没有差异(P>0.05),两组对Tph1、AADC上调的抑制作用与SH组也没有明显差异(P>0.05),但对MAO-A上调的抑制作用明显好于SH组及CDP组(P<0.05)。假手术组和模型组肾组织免疫组化表明:肾组织存在Tph1、AADC、5-HT2AR和MAO-A表达,主要表达在肾小管上皮细胞;这些蛋白在模型组皮质部肾小管上皮细胞的表达量明显升高,且5-HT2AR、MAO-A在病变部位表达量最高(图3A);在模型组髓质部肾小管(图3B),这些蛋白的表达量虽也升高,但明显不及皮质部。结果表明,模型组肾组织Tph1、AADC、5-HT2AR和MAO-A表达升高的部位,与病变部位是高度重叠的。依据文献报道[17],判定这个部位为近端肾小管。进一步检测表明,模型组肾脏5-HT和ROS水平(图3C、D)也显著升高(P<0.05);与模型组比较, SH和CDP治疗,可明显降低5-HT和ROS水平(P<0.05),且p-SC、t-SC组疗效更好(P<0.05),p-SC组及t-SC组间没有差异(P>0.05)。

图2 各组肾组织Western印迹检测Tph1、AADC、5-HT2AR、MAO-A蛋白表达结果(n=4)
图3 A、B:假手术组和模型组肾组织皮质部(A:IH,×400)及髓质部(B:IH,×200)免疫组化典型照片;C、D:各组5-HT和ROS含量结果(n=8)
RIRI与细胞凋亡及SH、CDP的治疗作用Western印迹表明(图4A),与假手术组相比,模型组大鼠肾组织中Bax、Caspase3、Caspase9表达量显著上调,Bcl-2表达显著下调(P<0.05);与模型组比较,经SH、CDP治疗后,Bax、Caspase3、Caspase9表达量明显降低、Bcl-2表达量明显升高(P<0.05);其中,p-SC、t-SC组效果明显好于SH、CDP组(P<0.05),p-SC、t-SC组间没有差异(P>0.05)。肾组织TUNEL染色表明(图4B),模型组皮质部肾小管出现重度细胞凋亡;经SH、CDP治疗后,细胞凋亡明显减轻,尤其p-SC、t-SC组几乎未见细胞凋亡。
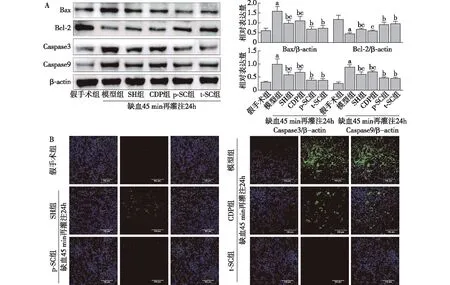
图4 各组大鼠肾组织凋亡相关蛋白表达及TUNEL染色结果
讨 论
本实验显示,动物RIRI的表现与临床上患者的表现相似,肾损伤部位主要出现在皮质部近端肾小管[17]。RIRI是由于能量需求和氧气、营养物质输送之间的不平衡,导致大量ROS产生,造成氧化应激及炎症、凋亡的发生[18]。前期我们已揭示,细胞存在一个5-HT降解系统,包括5-HT2AR、5-HT合成酶Tph1、AADC及5-HT降解酶MAO-A。5-HT合成增多及5-HT2AR、MAO-A表达上调,导致线粒体5-HT降解及ROS产生增多,引起细胞发生氧化应激、炎症和凋亡[12-15];其中,5-HT2AR的作用在于调控5-HT合成酶及MAO-A的表达,间接控制5-HT降解[13-14]。本研究表明,肾脏也存在5-HT降解系统;并且,发生RIRI时大鼠肾脏5-HT系统被最大程度地激活,其高表达部位在皮质部近端肾小管,这与病理切片显示的肾脏损伤部位重叠;用5-HT2AR拮抗剂SH可明显抑制Tph1、AADC及MAO-A的表达上调,从而抑制5-HT合成及降解;而AADC抑制剂CDP可通过减少5-HT合成及抑制MAO-A表达上调,从而降低RIRI导致的5-HT降解;联合用5-HT2AR拮抗剂及AADC抑制剂可达到更好效果。
氧化应激是一种细胞状态失衡的表现,主要因为ROS生成增多,机体内的氧化与抗氧化平衡被破坏,导致细胞损伤[19],MDA、SOD是氧化应激的标志物。持续的氧化应激会导致炎症因子风暴。肾小管上皮细胞凋亡已被公认为是RIRI的典型表现[20-21]。抗凋亡蛋白Bcl-2及促凋亡蛋白Bax的相对水平,决定了细胞是存活还是凋亡[22]。另外,Bcl-2家族蛋白还调节凋亡相关途径中Caspase活性[23],例如Caspase3和Caspase9[24]。本研究表明,给予SH、CDP治疗后,可显著提高肾脏的抗氧化能力,降低ROS、MDA含量、升高SOD活力;降低炎症因子TNF-α、IL-6含量;还降低Bax、Caspase3、Caspase9蛋白表达量,升高Bcl-2蛋白表达量,抑制细胞凋亡的发生;从而明显改善RIRI时的肾功能,降低SCr、BUN浓度。并且,SH、CDP联合给药时,不管是预防性给药还是缺血后的治疗性给药,疗效明显好于SH、CDP单独给药。实验中,SH和CDP联合给药组的疗效具有“1+1>2”的效应,即协同效应。
目前,已有研究表明ROS产生可能是诱导RIRI的关键原因[3-4,18]。然而,IR是如何引起ROS产生的?依旧没有阐明。本研究发现RIRI时肾脏ROS的产生可能是细胞5-HT降解系统激活的后果。其基本的病理机制,与高血糖、高血脂诱导肝细胞、骨骼肌异常[13-14],甚至动脉粥样硬化时巨噬细胞的泡沫化[12]的机制相似。5-HT2AR拮抗剂和5-HT合成抑制剂抑制RIRI、保护肾功能,治疗AKI的前景值得深入研究。
