精子DNA损伤对IVF-ET/ICSI助孕患者妊娠结局的影响
2021-09-16龙婷张慧彭露唐石欢谢巍伟贺育兰廖婷李卓敏刘玲
龙婷 张慧 彭露 唐石欢 谢巍伟 贺育兰 廖婷 李卓敏 刘玲

[關键词] 精子DFI;IVF-ET;ICSI;妊娠结局
[中图分类号] R711 [文献标识码] B [文章编号] 1673-9701(2021)15-0104-05
Effect of sperm DNA damage on pregnancy outcome of IVF-ET/ICSI assisted fertility patients
LONG Ting1, 2 ZHANG Hui2 PENG Lu2 TANG Shihuan2 XIE Weiwei2 HE Yulan2 LIAO Ting2 LI Zhuomin2 LIU Ling2 TANG Xian2 ZHANG Xianping2
1.Jishou University School of Medicine, Jishou 416000, China; 2.Reproductive Medicine Center,Loudi Central Hospital in Hunan Province, Loudi 417000, China
[Abstract] Objective To explore the effect of sperm DNA damage on pregnancy outcome of IVF-ET/ICSI patients. Methods A total of 63 patients who underwent IVF-ET/ICSI in Loudi Central Hospital from August 2019 to September 2020 were enrolled. They were divided into three groups according to the level of DFI, including group A: DFI<25% (n=34), group B: 25%≤DFI≤35% (n=18), group C: DFI>35% (n=11). The differences in semen routine analysis (abstinence time, sperm concentration, total motility, PR%), normal fertilization rate, cleavage rate, available embryo rate, high-quality embryo rate, blastocyst formation rate, implantation rate and clinical pregnancy rate among three groups were compared. Results There was no statistically significant difference between the three groups in general data, including male and female age, BMI (P>0.05). The difference in abstinence time and sperm concentration between group A and B was not statistically significant(P>0.05). The vitality and PR% of group C were lower than those of group A and B, and the difference was statistically significant (P<0.05). Correlation analysis showed that sperm DFI was negatively correlated with total vitality and PR%(r were -0.362 and -0.290, P<0.05). Sperm DFI had no correlation with abstinence time and sperm concentration(P>0.05). The differences in normal fertilization rate, cleavage rate, and usable embryo rate in the three groups were not statistically significant(P>0.05). The high quality embryo rate and blastocyst formation rate of group B were lower than those of group A, and the difference was statistically significant(P<0.05).The high-quality embryo rate, blastocyst formation rate, implantation rate and clinical pregnancy rate of group C were all lower than group A, and the difference was statistically significant(P<0.05). There was no statistically significant difference in indicators among other groups(P>0.05). Conclusion Sperm DNA damage is negatively correlated with total motility and PR%. Increased sperm DNA damage may lead to a decrease in implantation rate and clinical pregnancy rate in IVF-ET/ICSI patients.
[Key words] Sperm DFI; IVF-ET; ICSI; Pregnancy outcome
女性无避孕性生活至少12个月而未孕,称为不孕症,在男性则称为不育症[1]。据世界卫生组织调查显示,全世界每年约有6000万余对夫妇存在生育问题,其中男性因素不育患者可高达50%左右[2]。目前精液常规分析仍是评估男性不育的重要参考指标,但不能全面反应精子的质量和功能,缺乏对精子内部结构如精子DNA的评估[3]。而精子DNA是男方遗传信息的载体,在受到内、外源性不利因素影响时会形成DNA碎片。目前评判精子DNA碎片的常用指标为DNA碎片指数(DNA fragmentation index,DFI)。本研究通过检测精液常规分析及精子DFI,探讨精子DNA损伤对常规体外受精-胚胎移植(In vitro fertilization embyo transfer,IVF-ET)和卵胞浆内单精子显微注射(Intracytoplasmic sperm injection,ICSI)患者助孕治疗后正常受精率、卵裂率、可移植胚胎率、优质胚胎率、囊胚形成率、着床率及临床妊娠率的影响,现报道如下。
1 资料与方法
1.1 一般资料
1.1.1 研究对象 选取2019年8月至2020年9月在娄底市中心医院生殖医学中心行IVF-ET/ICSI助孕患者共63周期。本研究经医院生殖医学伦理委员会批准并同意,行IVF-ET/ICSI治疗的所有患者夫妻双方均签署知情同意书。
1.1.2 IVF-ET/ICSI适应证[4] ①输卵管梗阻;②排卵障碍;③子宫内膜异位症;④男方为少、弱精子症;⑤免疫性不孕(育)。
1.1.3 纳入标准 女方因素:①单纯为盆腔或输卵管因素不孕;②月经规律、卵巢储备功能正常;③染色体正常。男方因素:染色体正常。
1.1.4 排除标准 ①诊断为多囊卵巢综合征;②患有严重的呼吸、心血管、内分泌系统疾病等;③睾丸和睾丸后性因素导致的不育;④患有外伤或感染性疾病;⑤男女双方任何一方有辅助IVF-ET/ICSI治疗禁忌的患者。
1.2 方法
1.2.1 精液采集与分析 男方在禁欲2~7 d后,通过手淫收集完整的精液样本,取精前应要求研究对象排空膀胱、洗净双手、清洗阴茎,使用统一的无菌标本杯收集完整的精液。取精后立即将样本送往实验室,于37℃孵育箱内静置,待精液完全液化后,取小部分精液行精液常规检测及DFI检测。精液常规检测根据《世界卫生组织人类精液检查与处理实验室手册》第5版[5]的标准进行分析计数,对于精子浓度过高的精液样本(>50×106个/mL),将其精液稀释,调整精子浓度成(1~2)×106个/mL。
1.2.2 精子DFI检测 采用精子DNA碎片染色质扩散(SCD)检测试剂盒(深圳博锐德公司)检测精子DNA损伤情况。①检测方法:严格遵循试剂盒的使用说明方法进行检测。②精子DNA碎片判定标准:精子的头部仅产生较小光晕或无光量,且单侧光晕的厚度不超过精子头部最小直径的1/3。根据精子晕轮宽度与头部横径比值,分为大、中、小和无光晕4个等级,大晕轮:晕轮宽度>2/3精子头部横径;中晕轮:晕轮宽度和精子头部横径比值为1/3~2/3;小晕轮:晕轮宽度<1/3精子头部横径。DNA完整的精子产生扩散的大晕轮或中晕轮,而DNA损伤的精子不产生或产生很小的晕轮。DFI=(小晕轮精子+无晕轮精子)/精子总数×100%。正常参考值:DFI<25%。
1.2.3 精液優化处理方法 取卵当日精液采取密度梯度离心后上游法优化处理,胚胎培养基及精液处理试剂盒均于SAGE公司采购,取卵当日患者手淫取精,精液标本置于37℃热台至完全液化,镜下观察并记录优化处理前精液常规,分别取1.5 mL的40%梯度试剂和1.5 mL的80%梯度试剂加入15 mL离心管,使之形成界面清晰的两层,再加入1.5~3.0 mL完全液化后的精液,150 g离心 20 min后,沉淀混匀后再次150 g,5 min离心2次,收集精子沉淀后置于培养箱中上游待用。
1.3 观察指标及评价标准
1.3.1 体外受精、胚胎观察与移植 女方在本中心常规行超促排卵方案,经阴道B超下监测卵泡,根据血清激素水平及卵泡的大小来决定注射人绒毛膜促性腺激素(HCG)时机;待卵泡成熟后,肌注HCG 10 000 IU,36~40 h后在阴道B超引导下取卵,同时男方手淫取精,常规IVF授精,授精后16~18 h后观察原核受精情况,0原核(Pronucleus,PN)、1 PN、≥3 PN的为异常受精,2 PN的为正常受精,66~68 h观察胚胎情况,优质胚胎卵裂球为8~10个、碎片不足20%、无空泡。取卵后3~5 d按照我中心常规行新鲜胚胎移植,移植12~14 d抽血查HCG判断是否生化妊娠,移植28 d行超声检查见孕囊以确定临床妊娠。根据患者HCG日雌二醇水平、获卵数及相关临床表现来评估患者发生卵巢过度刺激综合征(Ovarian hyperstimulation syndrome,OHSS)的风险,酌情是否取消本周期鲜胚移植。
1.3.2 公式计算 IVF正常受精率=正常受精数/获卵总数×100%;ICSI正常受精率=正常受精数/注射MII卵子总数×100%;卵裂率=卵裂胚胎数/受精卵子数×100%;胚胎发育质量:D3日胚胎发育的形态作为胚胎发育质量的评估标准,胚胎分为I、Ⅱ、Ⅲ级胚胎,可利用胚胎率=D3日(I+Ⅱ+Ⅲ级胚胎)数/卵裂胚胎数×100%;优质胚胎率=D3日(I+Ⅱ级胚胎)数/正常受精卵裂胚胎数×100%;囊胚形成率=囊胚形成数/囊胚培养数×100%;着床率=孕囊数/总移植胚胎数×100%;临床妊娠率=临床妊娠周期数/移植周期数×100%。
1.4 统计学方法
采用SPSS 18.0统计学软件进行统计学分析,计量资料符合正态分布以(x±s)表示,采用单因素方差分析,应用Pearson直线分析DFI与精液参数的相关性;计数资料以[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 三组患者一般情况比较
三组的男女方年龄、体质量指数(BMI)比较,差异均无统计学意义(P>0.05)。见表1。
2.2 三组精液常规参数比较
三组患者禁欲时间及精子浓度比较,差异无统计学意义(P>0.05);C组精子总活力和前向运动精子百分率(Progressive sperm rate,PR)均低于A组和B组,差异有统计学意义(P<0.05);而A、B组比较,差异无统计学意义(P>0.05)。见表2。
2.3 精子DFI与精液常规参数相关性分析
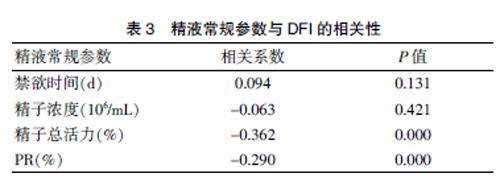
精子DFI与禁欲时间无相关性(r=0.094,P>0.05);精子DFI与精子浓度无相关性(r=-0.063,P>0.05);精子DFI与总活力呈负相关(r=-0.362,P<0.05);精子DFI与PR呈负相关(r=-0.290,P<0.05)。见表3。
2.4 三组IVF-ET/ICSI患者妊娠结局比较
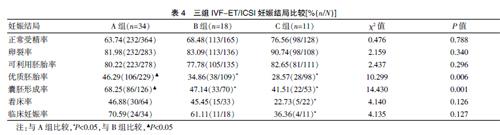
三组患者正常受精率、卵裂率及可利用胚胎率比较,差异无统计學意义(P>0.05);与A组比较,B组优质胚胎率和囊胚形成率下降,差异有统计学意义(P<0.05),而着床率和临床妊娠率比较,差异无统计学意义(P>0.05),C组优质胚胎率、囊胚形成率、着床率和临床妊娠率均下降,差异有统计学意义(P<0.05);与B组比较,C组优质胚胎率、囊胚形成率、着床率和临床妊娠率均略有下降,但差异无统计学意义(P>0.05)。见表4。
3 讨论
目前精液常规分析为评估精液质量的主要参考指标,其主要包括对精子浓度、总活力及PR的评估[6],但其波动范围大,极易受禁欲时间、外界环境及生活方式等影响,不能满足所有场景下对精子质量的检查要求[7-9]。有研究表明,约15%的男性不育患者精液常规分析结果正常[10];在精液参数正常的患者中,约8%的患者精子DFI水平升高[11]。另有学者指出,高度完整的精子DNA对成功受精、维持正常胚胎发育是不可缺少的[12]。精子DNA的完整性可能直接关系到男性的生育能力,是评估精子质量的重要参考指标。
本研究结果显示,C组总活力和PR均低于A组和B组,差异有统计学意义;此外精子DFI与精子总活力及PR具有负相关,验证了张丹等[13]研究结论。提示精子DFI越高,精子的前向运动能力越弱,推测精子的运动可能与精子Na+-K+-ATP酶的浓度有关,当DNA发生损伤时,会引起编码ATP酶的基因发生改变,导致ATP酶变性,使ATP不能水解释放能量,故转运到精子尾部的能量就会减少,从而导致精子前向活动能力变弱。而另有研究[14-15]指出,精子DFI与精液参数无相关性。这可能与纳排标准、精子DNA损伤检测方法及研究对象分组不同有关。
本研究结果提示,A、B、C三组的正常受精率、卵裂率及可利用胚胎率比较;差异无统计学意义(P>0.05);C组患者优质胚胎率、囊胚形成率、着床率及临床妊娠率均低于A组,差异有统计学意义(P<0.05),与梁泳娜等[16]的研究结果相符合。李婷婷等[17]研究发现,随着DFI水平增加,IVF受精率、卵裂率显著下降;但又有研究表明[18-21],精子DFI不会对受精过程造成影响,与IVF-ET/ICSI妊娠结局无相关性。因此精子DFI与IVF-ET/ICSI胚胎质量及妊娠结局是否有关,临床尚无统一定论。本研究发现,精子DFI升高(≥25%)对受精卵早期增殖发育无明显影响,但高DFI(>35%)会导致着床率和临床妊娠率下降,推测可能由于成熟卵子受精形成受精卵,继而卵裂形成2~4细胞胚胎均依赖卵母细胞发育和成熟阶段积累的线粒体RNA,卵母细胞中具有很高的DNA修复酶活性,所以一定量的精子DNA损伤可以得到复制后修复机制的修复。但胚胎发育至6~8细胞及囊胚期时,父源性基因初步表达,当受到内、外源性不利因素的影响时,精子DNA会发生单链或双链的断裂,若精子DNA损伤程度超过卵母细胞的修复能力,修复机制无法完全修复,那么受精卵的基因组中就会存在新突变体,可致父源基因组完整性异常,带有DNA碎片的精子能够与成熟卵母细胞结合受精,其中有缺陷的父源基因激活可损害胚胎的发育,导致植入前和植入后的胚胎发育阻滞或停滞,从而影响辅助生殖技术的结局[22]。此推测与Dhawan等[23]研究结果相吻合。
综上所述,精子DFI升高可能通过降低总活力和PR%,导致男性生育力下降,从而可能影响IVF-ET/ICSI患者妊娠结局。但鉴于本研究的患者数量有限,后期还需进一步扩大样本量来进一步证实此结论。
[参考文献]
[1] 马莉莉,刘鹏.不育症患者精子DNA碎片指数与精液参数关系分析[J].中国性科学,2019,28(7):30-32.
[2] Wang W,Ren L,Wei D,et al,Effect of maternal and embryonic factors on frozen-thawed IVF-ET Outcome after pre-equilibration with hyaluronan[J]. Arch Gynecol Obster,2019,299(1):247-258.
[3] 世界卫生组织.不育夫妇标准检查与诊断手册[M].北京:北京协和医院国家科学技术研究所,1997:10-21.
[4] 梁晓燕,方丛,黄睿,等.辅助生殖临床技术-实践与提高[M].北京:人民卫生出版社,2018:103-279.
[5] 谷诩群.世界卫生组织人类精液检查与处理实验室手册[M].北京:人民卫生出版社,2011:25-44.
[6] 王娟,吕玉珍,田可可,等.精子DNA碎片指数与体外受精-胚胎移植临床结局的相关研究[J].中国妇产科临床杂志,2020,21(4):406-408.
[7] 关小川,孙刚,姜力.等.精子DNA完整性对男性不育症患者精液常规参数和精子形态的影响[J].中国性科学,2018,27(2):100-104.
[8] Sun Tie-Cheng,Zhang Yan,Li Hong-Tu,et al. Sperm DNA fragmentation index, as measured by sperm chromatin dispersion, might not predict assisted reproductive outcome[J]. Taiwanese Journal of Obstetrics & Gynecology,2018,57(4):493-498.
[9] Frins S,Cruzat VF,Keane KN,et al. The effect of cigarette smoking, alcohol consumption and fruit and vegetable consumption on IVF outcomes:A review and presentation of original data[J]. Reprod Biol Endocrinol,2015,13:134.
[10] Agarwal A,Allamaneni SS. Sperm DNA damage assessment:A test whose time has come[J].Fertil Steril,2005,84(4):850-853.
[11] Panner Selvam,Manesh Kumar,Agarwal Ashok.A systematic review on sperm DNA fragmentation in male factor infertility:Laboratory assessment[J].Arab Journal of Urology,2018,16(1):65-76.
[12] Baskaran Saradha,Agarwal Ashok,Panner Selvam Manesh Kumar,et al. Tracking research trends and hotspots in sperm DNA fragmentation testing for the evaluation of male infertility:A scientometric analysis[J].Reproductive Biology and Endocrinology:RB&E,2019, 17(1):378-382.
[13] 張丹,谭丽,窦倩.精子DNA碎片率对胚胎质量及体外受精-胚胎移植者妊娠结局的影响[J].河南医学研究,2020,29(17):3124-3126.
[14] Khalili MA,Aghaie-Maybodi F,Anvari M,et al. Sperm nuclear DNA in ejaculates of fertile and infertile men:Correlation with semen parameters[J]. Urol J,2006,3(3):154-159.
[15] Cho C,Agarwal A. Role of sperm DNA fragmentation in male factor infertility: A systematic review[J].Arab J Urol,2018,16(1):21-34.
[16] 梁泳娜,谢斯盛,梁见弟,等.精子DNA碎片指数对评估体外受精-胚胎移植患者妊娠结局的临床价值[J].中国优生与遗传杂志,2019,27(1):95-98.
[17] 李婷婷,彭金涛,刘贵华,等.精子DNA碎片对体外受精-胚胎移植胚胎发育的影响[J].中国男科学杂志,2016, 22(5):467-470.
[18] Zeyad A, Hamtal. Relationships between bacteriospermia,DNA integrity,nuclear protamine alteration,sperm quality and ICSI oad M Amor H,eutcome[J].Reprod Biol,2018,18(1):115-121.
[19] Casanovas A,Ribas-Maynou J,Lara-Cerrillo S,et al. Doullestranded sperm DNA damage is cause of delay in embryo development and can impair implantation rates[J].Fertil Steril,2019,111(4):699-707.
[20] Basar MM,Kahraman S. Clinical utilityof sperm DNA fragmentation testing practice recommendation based on clinical scenarios[J]. Transl Androl Urol,2017,6(Supp14):S574-S576.
[21] Chi HJ,Kwak SJ,Kim SG,et al. Efficient isolation of sperm with high DNA integrity and stable chromatin packaging by a combination of density-sradient centrifug ation and magnetic-activated celsoring[J]. Clin Exp Reprod Med,2016,43(4):199-206.
[22] Xiao-Bin Zhu,Qian Chen,Wei-Min Fan,et al. Sperm DNA fragmentation in Chinese couples with unexplained recurrent pregnancy loss[J].First International Journal of Andrology,2020,22(3):296-301.
[23] Dhawan V,Kumar M.Deka D,Malhotra N,et al.Paternal factors and embryonic development:Role in recurrent pregnancy loss[J]. Andrologia,2019,51(1):e13 171.
(收稿日期:2021-01-07)
