基于AOX1和MCM5基因水芹地方品种的遗传关系分析及‘玉祁红芹’ISSR-SCAR标记建立
2021-09-16张艳梅孙小芹杭悦宇周广灿
王 月, 刘 佳, 陈 闽, 张艳梅, 孙小芹, 杭悦宇, 周广灿,2,①
〔1. 江苏省中国科学院植物研究所(南京中山植物园), 江苏 南京 210014; 2. 菏泽学院农业与生物工程学院, 山东 菏泽 274015〕
水芹〔Oenanthejavanica(Bl.) DC.〕为多年生草本植物,水生,不仅是富含维生素、矿质元素和膳食纤维的蔬菜[1],也是具有降血压[2-3]、降血脂[3-4]和抗癌[5]功效的药用植物。江苏太湖流域作为水芹主产区之一,拥有大量的、具有早熟和耐寒等优良性状的地方品种,如‘常熟白芹’(‘Changshubaiqin’)、‘苏州圆叶芹’(‘Suzhouyuanyeqin’)、‘溧阳白芹’(‘Liyangbaiqin’)、‘玉祁红芹’(‘Yuqihongqin’)、‘江阴青芹’(‘Jiangyinqingqin’)和‘梅南水芹’(‘Meinanshuiqin’)等,均为水芹遗传育种和品种改良的重要种质资源。
植物遗传多样性研究是植物育种和遗传保护的重要基础[6]。在分子标记开发和应用方面,相对于叶绿体DNA和细胞核rDNA,低拷贝核基因具有进化速率更快、含双亲的遗传物质和积累多个非连锁位点的潜力等[7-8]优势。近年来,AOX1和MCM5等低拷贝核基因被广泛用于植物遗传关系分析[9-11]。
上述地方品种中,‘玉祁红芹’原产于江苏无锡和常州一带,株高40 cm,生长势强、基部粗壮,低温时全株叶片变紫红色,耐寒性强;嫩茎和软化叶鞘质地柔嫩,纤维少、蛋白质含量高,是水芹杂交育种中常用的、重要的亲本材料[12]。由于水芹大部分品种的植株、花和果实形态相似,通过形态学鉴别方法难以将‘玉祁红芹’与其他地方品种有效区分。随着生物技术的发展,分子标记已成为鉴别植物种类的重要辅助手段[13-14]。研究水芹地方品种间的遗传多样性以及开发鉴定‘玉祁红芹’的分子标记均有助于更好地开发水芹种质资源。
基于前人研究结果[15-16],本研究比较了水芹野生种以及‘常熟白芹’、‘苏州圆叶芹’、‘溧阳白芹’、‘玉祁红芹’、‘江阴青芹’和‘梅南水芹’6个地方品种中AOX1和MCM5基因的变异特征,并构建了对应的最大似然法(maximum likelihood,ML)遗传关系树;此外,结合ISSR-SCAR技术,开发‘玉祁红芹’的特异性分子标记,以期为水芹杂交育种中亲本选择和杂交后代优势预测提供分子基础。
1 材料和方法
1.1 材料
供试水芹野生种采自南京中山植物园;6个地方品种采自苏州市漕湖蔬菜产业园,包括‘常熟白芹’、‘苏州圆叶芹’、‘溧阳白芹’、‘玉祁红芹’、‘江阴青芹’和‘梅南水芹’。每种材料采集8个单株,取幼嫩且无病虫害的干净叶片,硅胶干燥后保存、备用。
1.2 方法
1.2.1 植物总DNA的提取 采用CTAB法提取水芹野生种和地方品种各单株叶片的总DNA,提取的总DNA样品经检测后置于-20 ℃保存、备用。
1.2.2AOX1和MCM5基因的PCR扩增 以伞形科胡萝卜(Daucuscarotavar.sativaHoffm.)的AOX1(DCAR_028361)和MCM5(DCAR_014827)基因作为查询序列,在水芹转录组数据库中搜寻同源序列并在该基因的非保守区域两端设计引物。扩增水芹AOX1基因所用上游和下游引物的序列分别为5′-ATGTTGATGCGTCATGGCACT-3′和5′-CGAAGCAAAGTGGTTAACATCTC-3′,扩增水芹MCM5基因序列所用上游和下游引物的序列分别为5′-GCAGTTGCAGTTAGACAGCC-3′和5′-CATCGATGCAGACAACTCCAC-3′。以提取的水芹总DNA为模板进行PCR分析。PCR扩增体系总体积25.0 μL,包括20 ng模板DNA、0.2 μmol·L-1上游和下游引物、1.5 mmol·L-1MgCl2、0.5 mmol·L-1dNTPs、50 mmol·L-1Tris-HCl (pH 8.3)以及1 U高保真PCR聚合酶PrimeSTAR〔宝生物工程(大连)有限公司〕。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性45 s、53 ℃~55 ℃退火45 s、72 ℃延伸2 min,35个循环;最后于72 ℃延伸10 min。PCR扩增产物经质量体积分数1%琼脂糖凝胶电泳(2 000 bp DNA Ladder,电压100 V,电泳0.5 h)后,溴化乙锭(EB)染色,用Tanon 3500全自动数码凝胶成像分析系统(上海天能科技有限公司)观察、拍照。
1.2.3 扩增产物的克隆、测序及数据分析 PCR扩增产物纯化后,连接到pMD19-T载体〔宝生物工程(大连)有限公司〕,然后将连接产物转化到大肠杆菌DH5α感受态细胞,经氨苄青霉素抗性平板筛选后,挑取单菌落进行PCR检验,将阳性克隆交由上海华大基因生物科技有限公司测序。使用Sequencher 4.5软件对测序结果进行拼接,通过MEGA5.0软件对序列进行排序和手动校正。使用MEGA5.0软件对核苷酸序列及其编码氨基酸序列的相似性进行分析。用胡萝卜基因组(https:∥phytozome.jgi.doe.gov)中的AOX1、AOX2a(DCAR_021859)、AOX2b(DCAR_029210)、MCM5和MCM3(DCAR_021877)基因作为外类群,构建ML遗传关系树分析各材料间的遗传关系。每种材料选择5个单株用于遗传关系分析。
1.2.4 ‘玉祁红芹’特异性分子标记的建立
1.2.4.1 ISSR-SCAR特异性条带的克隆及测序 使用ISSR-880引物(5′-GGAGAGGAGAGGAGA-3′)对6个地方品种8个单株总DNA的混合样进行扩增,PCR扩增体系和扩增程序同“1.2.2”。PCR扩增产物经质量体积分数2%琼脂糖凝胶电泳(2000 bp DNA Ladder,电压80 V,电泳1.5 h)后,EB染色,用上述凝胶成像分析系统观察、拍照。选择在‘溧阳白芹’中扩增出的特异性条带切胶回收,将回收产物连接到pMD19-T载体,然后将连接产物转化到大肠杆菌DH5α感受态细胞。挑取单菌落进行PCR检验,将阳性克隆交由南京锐真生物技术有限公司测序。根据DNA序列分析结果,设计1对SCAR引物用于后续反应。
1.2.4.2 ISSR-SCAR标记的验证 使用上述合成的SCAR引物对6个地方品种所有单株进行特异性验证。PCR扩增体系总体积20.0 μL,包括20 ng·μL-1模板DNA 1.0 μL、2×Reaction Mix(含20 mmol·L-1Tris-HCl、100 mmol·L-1KCl、3 mmol·L-1MgCl2和400 μmol·L-1dNTPs)10.0 μL、10 mmol·L-1上游和下游引物各0.8 μL以及2.5 U·μL-1TaqDNA聚合酶0.4 μL,最后用双蒸水补足至20.0 μL。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性45 s、55 ℃退火45 s、72 ℃延伸1 min,30个循环;最后于72 ℃延伸8 min。PCR扩增产物的检测方法同“1.2.2”。
按照上述步骤使用ISSR-836引物(5′-AGAGAGAGAGAGAGAGYA-3′)进一步对‘溧阳白芹’和‘玉祁红芹’进行特异性条带的克隆、测序及验证。
2 结果和分析
2.1 AOX1和MCM5基因变异位点分析
2.1.1AOX1基因变异位点分析 克隆和测序结果显示:水芹野生种和6个地方品种各单株均可扩增出AOX1基因,野生种扩增出2条条带,长度分别为1 112和1 305 bp;6个地方品种均扩增出1条条带,长度为1 305~1 316 bp。其中,编码区长度为885 bp。水芹野生种和地方品种中AOX1基因的变异位点见表1,AOX1基因的核苷酸序列及其编码氨基酸序列的相似性见表2。
结果(表1)显示:水芹野生种和6个地方品种AOX1基因中共检测到22个SNP位点和7个插入/缺失(InDel)位点。上述SNP位点和InDel位点在水芹野生种AOX1a和AOX1b基因中的排列模式差异较大,表明已发生遗传分化。其中,AOX1b基因与6个地方品种AOX1基因的相似性更高,且变异位点和变异模式也相似。与AOX1b基因相比,AOX1a基因内含子1中有11 bp的插入(318~328位点)。
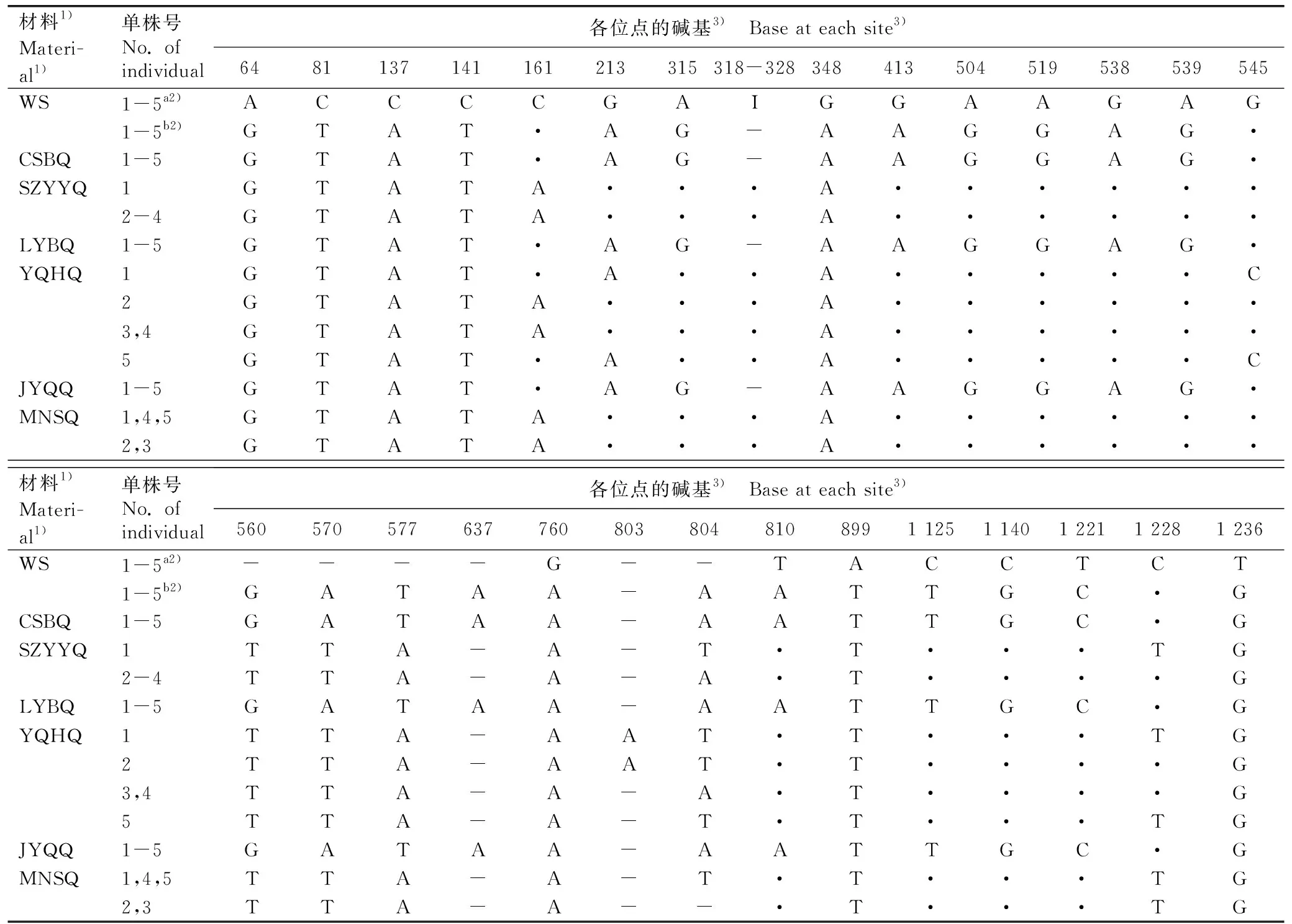
表1 水芹野生种和地方品种AOX1基因变异位点的比较
结果(表2)显示:与水芹野生种AOX1a基因相比较,AOX1b基因与6个地方品种AOX1基因的核苷酸序列的相似性无明显差异,而编码氨基酸序列的相似性较高,相似性为99.0%~100.0%。不同地方品种间,‘常熟白芹’、‘溧阳白芹’和‘江阴青芹’间AOX1基因的核苷酸序列及其编码氨基酸序列相似性均较高,分别为99.9%~100.0%和100.0%;‘玉祁红芹’与‘苏州圆叶芹’和‘梅南水芹’AOX1基因的核苷酸序列及其编码氨基酸序列的相似性也较高,分别为99.8%~99.9%和99.7%。
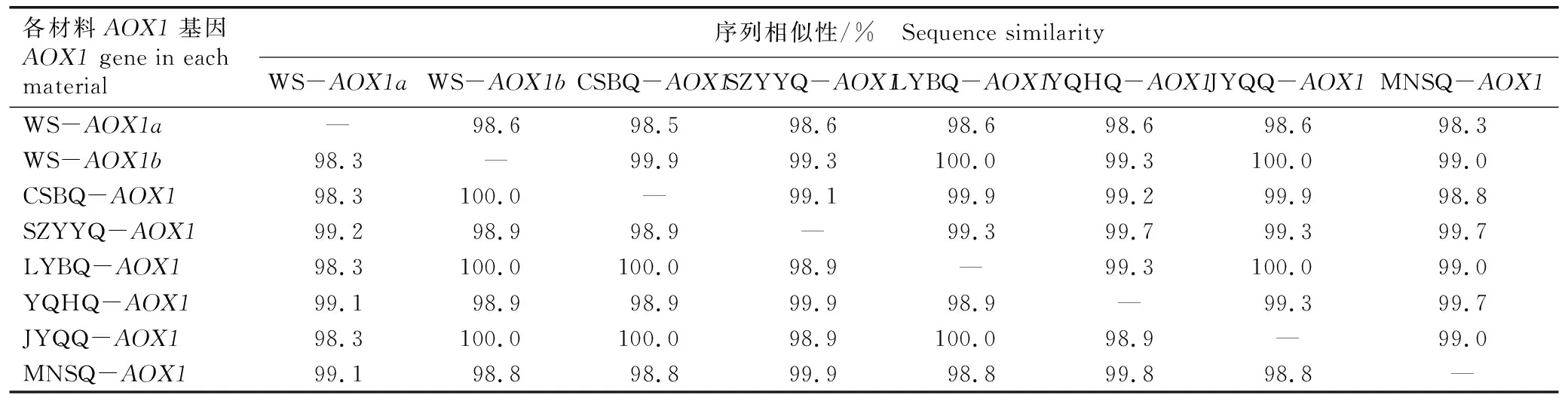
表2 水芹野生种和地方品种AOX1基因的核苷酸序列及其编码氨基酸序列的相似性1)
2.1.2MCM5基因变异位点分析 克隆和测序结果显示:水芹野生种和6个地方品种MCM5基因的长度为1 432或1 433 bp。水芹野生种和地方品种中MCM5基因的变异位点见表3,MCM5基因的核苷酸序列及其编码氨基酸序列的相似性见表4。
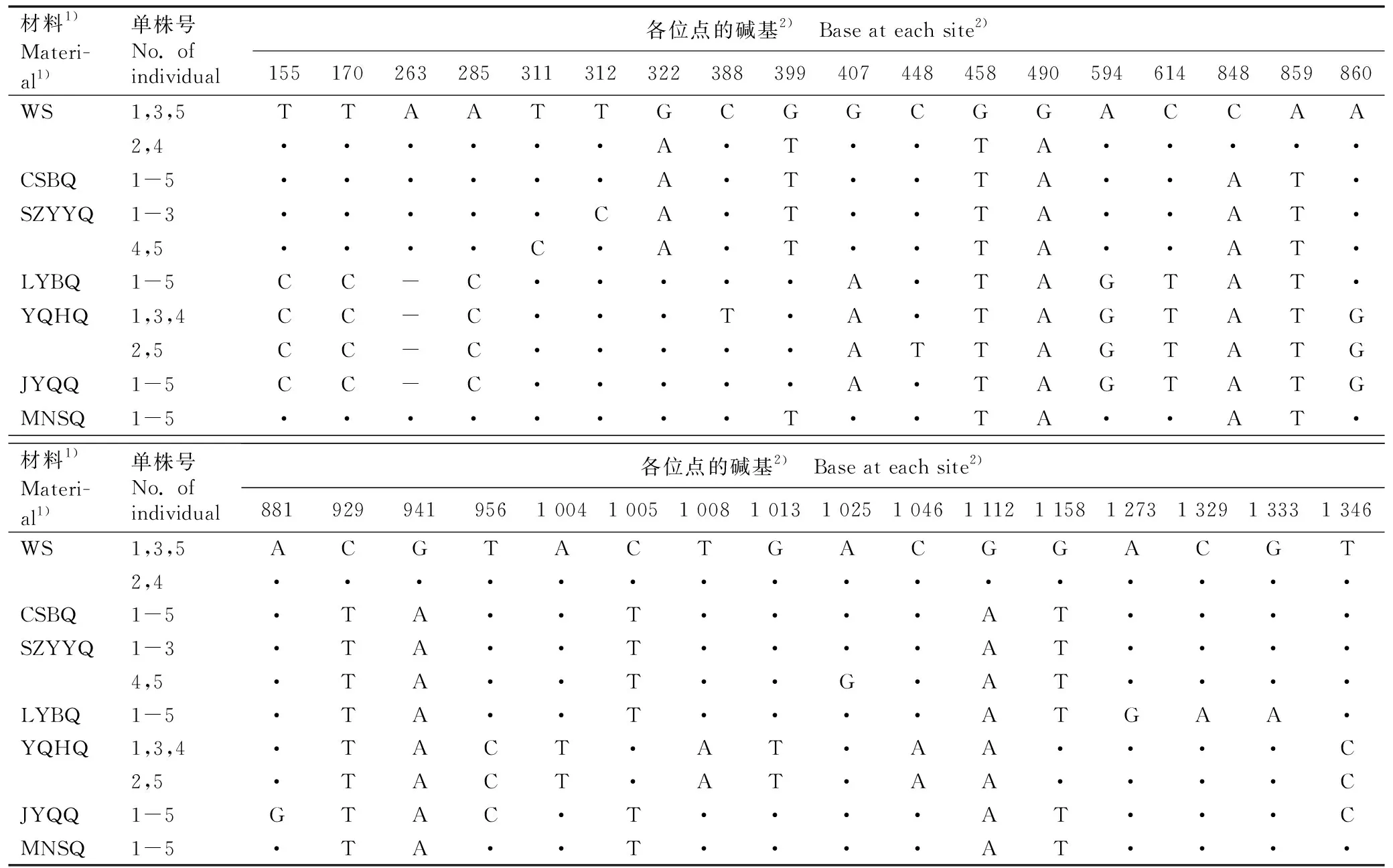
表3 水芹野生种和地方品种MCM5基因变异位点的比较
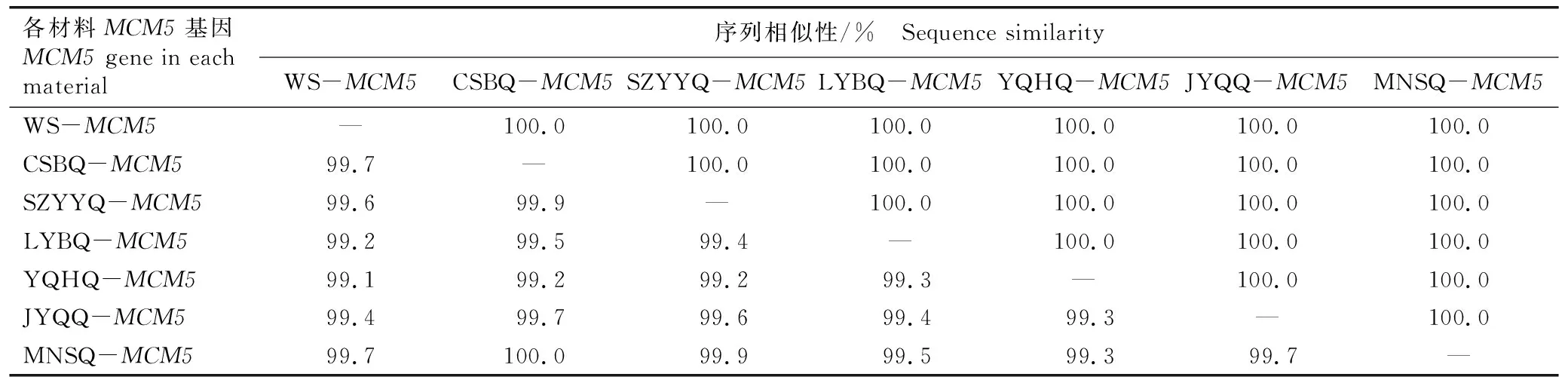
表4 水芹野生种和地方品种MCM5基因的核苷酸序列及其编码氨基酸序列的相似性1)
结果显示:水芹野生种和6个地方品种MCM5基因中共检测到33个SNP位点和1个位于非编码区的InDel位点。基于MCM5基因的SNP位点总体可将供试7种水芹材料分为3组,第1组仅包括水芹野生种,第2组包括‘溧阳白芹’、‘玉祁红芹’和‘江阴青芹’,第3组包括‘常熟白芹’、‘苏州圆叶芹’和‘梅南水芹’。水芹野生种和6个地方品种MCM5基因的核苷酸序列相似性为99.1%~100.0%,编码氨基酸序列的相似性达100.0%。总体而言,与AOX1基因相比,供试水芹材料的MCM5基因较保守。
2.2 水芹野生种和地方品种间的遗传关系分析
基于AOX1和MCM5基因构建水芹野生种和地方品种的ML遗传关系树见图1。结果显示:AOX1基因的ML遗传关系树(图1-A)先分为2个单系遗传分支,其中,水芹野生种的AOX1a基因组成基部分支Ⅰ,AOX1b基因与6个地方品种的AOX1基因组成分支Ⅱ。单系遗传分支Ⅱ可进一步分为2个亚支,其中,亚支Ⅱa由水芹野生种的AOX1b基因及‘常熟白芹’、‘溧阳白芹’和‘江阴青芹’的AOX1基因组成,显示6个地方品种的AOX1基因是野生种AOX1b基因的直系同源基因;亚支Ⅱb由‘苏州圆叶芹’、‘玉祁红芹’和‘梅南水芹’的AOX1基因组成。
MCM5基因的ML遗传关系树(图1-B)的主要结构与AOX1基因的ML遗传关系树相同,先分为2个分支,水芹野生种的MCM5基因位于遗传关系树的基部分支Ⅰ,6个地方品种的MCM5基因组成分支Ⅱ。分支Ⅱ进一步分为2个亚支,但是2个亚支的组成与AOX1基因的遗传关系树不同,亚支Ⅱa由‘常熟白芹’、‘苏州圆叶芹’和‘梅南水芹’组成,亚支Ⅱb由‘溧阳白芹’、‘玉祁红芹’和‘江阴青芹’组成。
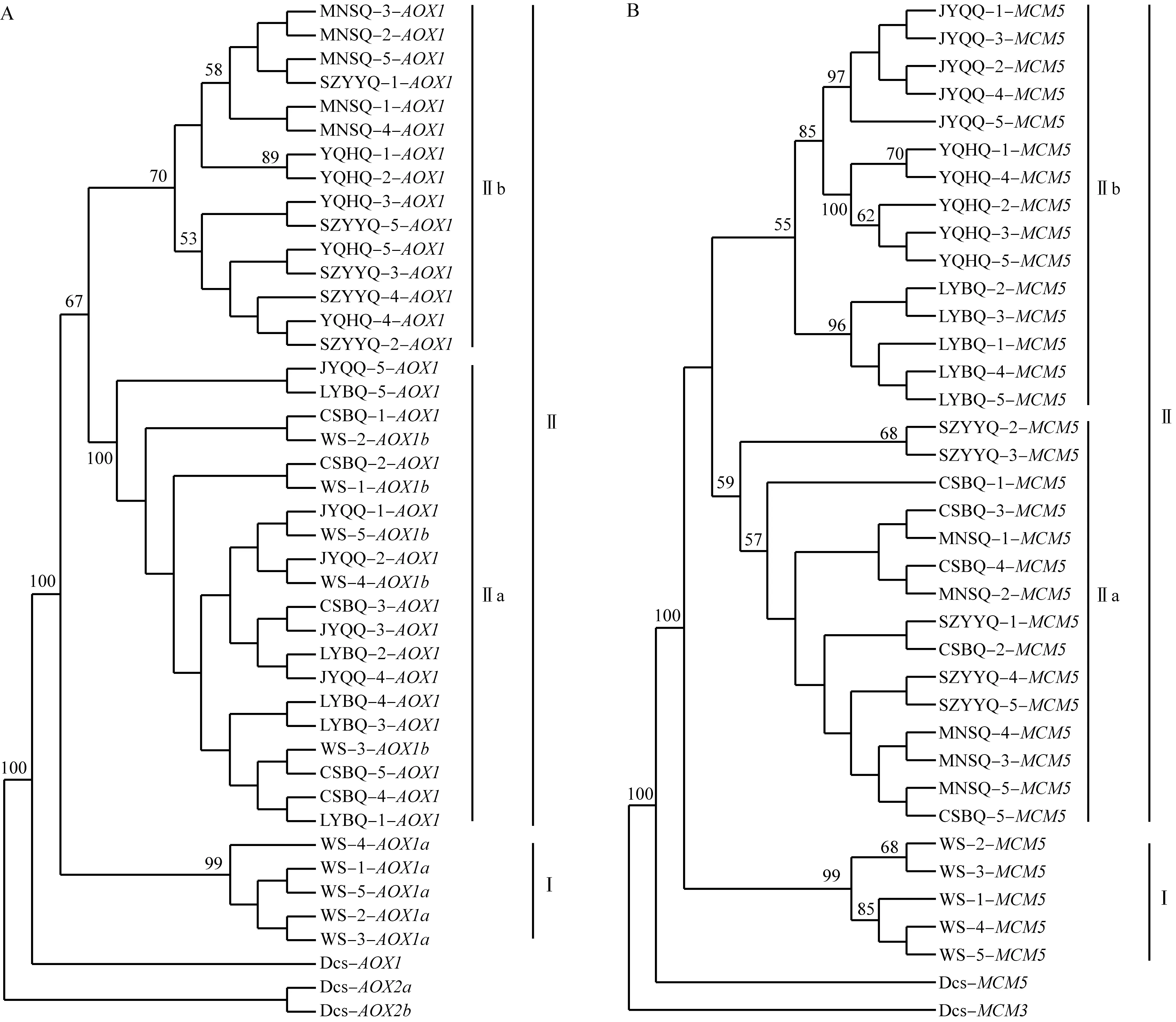
分支上数据表示基于1 000次重复的支持率(%),仅显示支持率大于50%的数据The datums on the branches represent the support rate (%) based on 1 000 repeats, and show the support rate greater than 50% only. WS: 水芹野生种Wild species of Oenanthe javanica (Bl.) DC.; CSBQ: ‘常熟白芹’‘Changshubaiqin’; SZYYQ: ‘苏州圆叶芹’‘Suzhouyuanyeqin’; LYBQ: ‘溧阳白芹’‘Liyangbaiqin’; YQHQ: ‘玉祁红芹’‘Yuqihongqin’; JYQQ: ‘江阴青芹’‘Jiangyinqingqin’; MNSQ: ‘梅南水芹’‘Meinanshuiqin’; Dcs: 胡萝卜Daucus carota var. sativa Hoffm.图1 基于AOX1(A)和MCM5(B)基因构建的水芹野生种和地方品种的ML遗传关系树Fig. 1 ML genetic relationship tree of wild species and local cultivars of Oenanthe javanica (Bl.) DC. based on AOX1 (A) and MCM5 (B) genes
进一步将AOX1和MCM5基因手动拼接,构建水芹野生种和地方品种的ML遗传关系树(图2)。结果显示:该遗传关系树的结构与AOX1基因的遗传关系树相似,水芹野生种的AOX1a和MCM5基因拼接后组成分支Ⅰ,分支Ⅱ中‘玉祁红芹’、‘苏州圆叶芹’和‘梅南水芹’的AOX1和MCM5基因拼接后组成亚支Ⅱa,野生种的AOX1b和MCM5基因拼接后以及‘常熟白芹’、‘溧阳白芹’和‘江阴青芹’的AOX1和MCM5基因拼接后组成亚支Ⅱb。
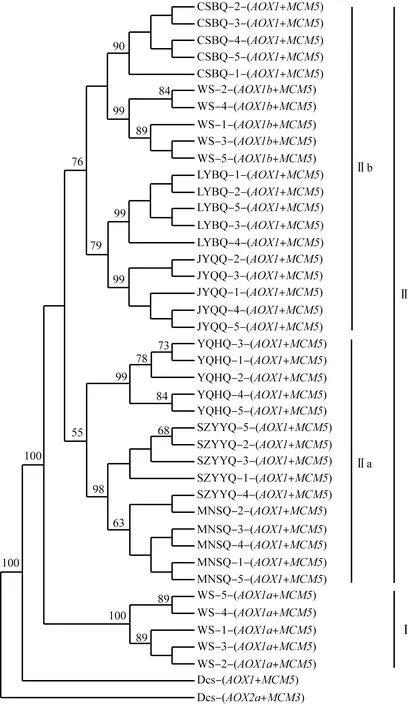
分支上数据表示基于1 000次重复的支持率(%),仅显示支持率大于50%的数据The datums on the branches represent the support rate (%) based on 1 000 repeats, and show the support rate greater than 50% only. WS: 水芹野生种Wild species of Oenanthe javanica (Bl.) DC.; CSBQ: ‘常熟白芹’‘Changshubaiqin’; SZYYQ: ‘苏州圆叶芹’‘Suzhouyuanyeqin’; LYBQ: ‘溧阳白芹’‘Liyangbaiqin’; YQHQ: ‘玉祁红芹’‘Yuqihongqin’; JYQQ: ‘江阴青芹’‘Jiangyinqingqin’; MNSQ: ‘梅南水芹’‘Meinanshuiqin’; Dcs: 胡萝卜Daucus carota var. sativa Hoffm.图2 基于AOX1和MCM5基因拼接后构建的水芹野生种和地方品种的ML遗传关系树Fig. 2 ML genetic relationship tree of wild species and local cultivars of Oenanthe javanica (Bl.) DC. based on spliced AOX1 and MCM5 genes
2.3 ‘玉祁红芹’特异性分子标记的建立
基于ISSR-880引物水芹地方品种的PCR扩增结果及特异性片段的序列和SCAR引物位点见图3。结果显示:基于ISSR-880引物,‘溧阳白芹’扩增出长度约900 bp的特异性条带(图3-A),将该特异性条带切胶回收、克隆测序,得到长度为1 148 bp的序列(图3-B)。根据该序列设计第1对SCAR引物3-880-F(5′-GGAAGAGTTTAGGTAAGACTTTCTCG-3′)和3-880-R(5′-GGTTGTAAAAGGTTACACTGATGC-3′),分别对应‘溧阳白芹’特异性片段全序列的50~75及1 096~1 119位点。
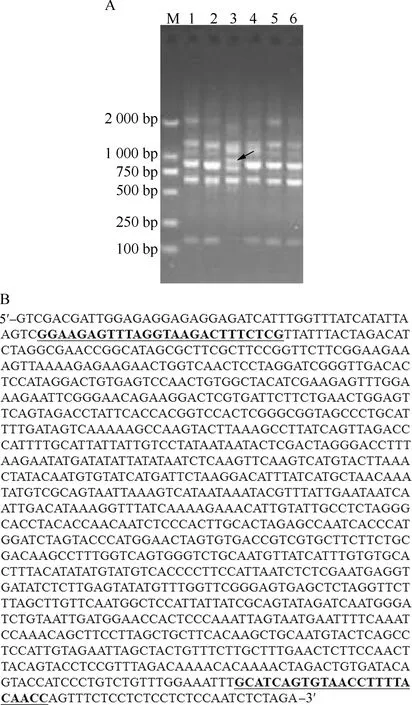
M: 2 000 bp DNA Ladder; 1: ‘常熟白芹’‘Changshubaiqin’; 2: ‘苏州圆叶芹’‘Suzhouyuanyeqin’; 3: ‘溧阳白芹’‘Liyangbaiqin’; 4: ‘玉祁红芹’‘Yuqihongqin’; 5: ‘江阴青芹’‘Jiangyinqingqin’; 6: ‘梅南水芹’‘Meinanshuiqin’. 箭头示特异性条带The arrow shows the specific band. 下划线示SCAR引物位点The underlines show SCAR primer sites.图3 基于ISSR-880引物水芹地方品种的PCR扩增结果(A)及特异性片段的序列和SCAR引物位点(B)Fig. 3 PCR amplification result of local cultivars of Oenanthe javanica (Bl.) DC. based on ISSR-880 primer (A) and sequence of specific fragment and SCAR primer sites (B)
采用上述SCAR引物对6个地方品种的所有单株进行验证,结果见图4。结果显示:‘溧阳白芹’和‘玉祁红芹’的8个单株中均扩增出1条清晰的、长度为1 069 bp的条带,其他4个地方品种的所有单株中均未扩增出该特异性条带。

M: 2 000 bp DNA Ladder; 1-8: ‘常熟白芹’‘Changshubaiqin’; 9-16: ‘苏州圆叶芹’‘Suzhouyuanyeqin’; 17-24: ‘溧阳白芹’‘Liyangbaiqin’; 25-32: ‘玉祁红芹’‘Yuqihongqin’; 33-40: ‘江阴青芹’‘Jiangyinqingqin’; 41-48: ‘梅南水芹’‘Meinanshuiqin’.图4 基于第1对SCAR引物水芹地方品种单株的扩增结果Fig. 4 Amplification result of individuals of local cultivars of Oenanthe javanica (Bl.) DC. based on the first pair of SCAR primers
为了进一步区分‘溧阳白芹’和‘玉祁红芹’,采用ISSR-836引物进行扩增,将‘玉祁红芹’长度约500 bp的特异性条带(图5-A)切胶回收、克隆测序,得到长度为514 bp的序列(图5-B)。根据该序列设计第2对SCAR引物4-836-F(5′-ATGAAGCAGAGGAAGAGACATTC-3′)和4-836-R(5′-ACTACCCTCTTTACCTCTGATGTAC-3′),分别对应‘玉祁红芹’特异性片段全序列的45~67和448~472位点。
采用这对SCAR引物对‘玉祁红芹’和‘溧阳白芹’的所有单株进行验证,结果见图6。结果显示:‘玉祁红芹’8个单株均可扩增出1条清晰的、长度为428 bp的条带,而‘溧阳白芹’8个单株均未扩增出该特异性条带。

M: 2 000 bp DNA Ladder; 1: ‘溧阳白芹’‘Liyangbaiqin’; 2: ‘玉祁红芹’‘Yuqihongqin’. 箭头示特异性条带The arrow shows the specific band. 下划线示SCAR引物位点The underlines show SCAR primer sites.图5 基于ISSR-836引物水芹地方品种‘溧阳白芹’和‘玉祁红芹’的PCR扩增结果(A)及特异性片段的序列和SCAR引物位点(B)Fig. 5 PCR amplification result of local cultivar ‘Liyangbaiqin’ and ‘Yuqihongqin’ of Oenanthe javanica (Bl.) DC. based on ISSR-836 primer (A) and sequence of specific fragment and SCAR primer sites (B)

M: 2 000 bp DNA Ladder; 1-8: ‘溧阳白芹’‘Liyangbaiqin’; 9-16: ‘玉祁红芹’‘Yuqihongqin’.图6 基于第2对SCAR引物水芹地方品种‘溧阳白芹’和‘玉祁红芹’单株的扩增结果Fig. 6 Amplification result of individuals of local cultivar ‘Liyangbaiqin’ and ‘Yuqihongqin’ of Oenanthe javanica (Bl.) DC. based on the second pair of SCAR primers
3 讨 论
3.1 水芹地方品种间AOX1和MCM5基因的变异
本研究基于低拷贝核基因AOX1和MCM5进行扩增,在水芹野生种的所有单株中均扩增出长度分别为1 112(AOX1a)和1 305 bp(AOX1b)的2条条带,而在6个地方品种的所有单株中仅扩增出1条条带,长度为1 305~1 316 bp。为了明确品种间存在的差异,本研究对碱基变异位点、插入/缺失(InDel)分析以及核苷酸序列和编码氨基酸序列进一步比对,结果表明:水芹6个地方品种的AOX1基因是AOX1b基因的直系同源基因,而其旁系同源基因AOX1a可能在水芹驯化过程中丢失。此外,AOX1a和AOX1b基因的主要区别在于AOX1a基因内含子1中有11 bp的插入,这些变异位点可能通过调控转录和选择性剪接过程影响植物基因的表达[17-21],从而造成不同品种的表型差异。
本研究扩增的MCM5基因位于E6-E10区域,该区域对应的蛋白质结构域可与MCM2、MCM3、ORC2L、ORC6L和STAT1等染色质蛋白因子结合组成DNA复制起始复合体[16,22-23]。该MCM5基因中共有33个SNP位点,其中有3个SNP位点位于编码区,且均为同义突变。AOX1蛋白参与应激反应[15],MCM5蛋白参与DNA复制[16],与AOX1基因相比,MCM5基因比较保守,这可能是2个基因编码蛋白的功能不同,受到的选择压力也不同所致。
3.2 水芹地方品种间的遗传关系
在基于AOX1基因构建的ML遗传关系树上,‘常熟白芹’、‘溧阳白芹’和‘江阴青芹’3个地方品种聚为一个亚支,‘苏州圆叶芹’、‘梅南水芹’和‘玉祁红芹’3个地方品种聚为另一个亚支,这2个亚支组成的分支与水芹野生种AOX1a基因所在分支之间的支持率较高,因此,该遗传关系树稳定、可靠。尽管低拷贝核基因遵守双亲遗传方式且能提供大量信息位点,可用于研究低等分类阶元之间的系统发育关系,但是不同的低拷贝核基因在物种演化过程中所受的演化压力不同,因此,筛选合适的低拷贝核基因是构建低等分类阶元之间稳定系统发育关系的重要前提。
3.3 ‘玉祁红芹’的特异性标记
太湖流域的水芹地方品种中,‘玉祁红芹’具有许多优良品质。目前,仅通过形态观察将‘玉祁红芹’与其他地方品种进行区分,存在一定的局限性,不利于种质资源的保护和利用。在开发‘玉祁红芹’特异性分子标记的过程中发现,水芹地方品种间差异较小,分子标记开发存在难度。本研究基于ISSR-SCAR标记开发了两步法鉴别‘玉祁红芹’的特异性位点PCR分子标记,该方法先基于ISSR-880引物扩增得到‘溧阳白芹’的特异性片段,设计的第1对SCAR引物将‘溧阳白芹’和‘玉祁红芹’与其他4个地方品种区分开,再基于ISSR-836引物扩增得到‘玉祁红芹’特异性片段,设计的第2对SCAR引物将‘玉祁红芹’与‘溧阳白芹’区分开。与传统的基于形态、理化指标或非特异性分子标记相比,该标记具有准确性高、重现性好、稳定、可靠的优点。‘玉祁红芹’特异性分子标记的开发为其他优质水芹地方资源的种质鉴定、保存和创新利用提供了理论依据和指导意义。
