腹泻型肠易激综合征外周血Treg/Th17细胞因子失衡与肠黏膜优势菌的相关性研究
2021-09-16张铭承
张铭承,林 琳
1.东莞市妇幼保健院综合内科,广东广州 523000;2.东莞东华医院/中山大学附属东华医院消化内科,广东广州 523000
腹泻型肠易激综合征(D-IBS)是一种常见的胃肠道疾病,其病因和发病机制尚不明确。近年来研究表明,肠道菌群失衡与D-IBS的发病关系十分密切,肠道菌群能够一定程度地将肠道中的免疫系统激活,引发D-IBS,另外,肠道菌群可以利用自身结构的特殊性以及相应的代谢产物,并通过调剂脑-肠轴来引发肠道症状[1]。多数D-IBS患者常常出现细菌移位。细菌、内毒素原存在于肠腔内,经过某些方式穿过肠黏膜屏障,侵入肠系膜淋巴结,侵入体循环和肝、脏等远处脏器。在重症胰腺炎、重症监护患者等重症患者因自身损伤的肠屏障功能,导致原来定植在肠腔中的各种细菌及其分泌的内毒素转移至门脉系统、肠淋巴和结外周血,进而激活黏膜下层免疫细胞,释放大量的炎性介质,引发炎性反应综合征[2-3]。辅助性T细胞17(Th17)及其细胞因子参与了调节慢性炎症及自身免疫性疾病,而调节性T细胞(Treg)及其细胞因子可抑制炎性反应和维持免疫耐受[4-5]。为了探讨D-IBS外周血Treg/Th17细胞因子失衡与肠黏膜优势菌的相关性,本文选取东莞市妇幼保健院收治的90例D-IBS患者作为研究对象。现将其研究结果报道如下。
1 资料与方法
1.1一般资料 选取2016年1月至2020年2月东莞市妇幼保健院收治的90例D-IBS患者作为D-IBS组,所有患者均经过肠镜检查确诊,男性50例、女性40例,年龄31~56岁、平均(38.42±9.85)岁。纳入标准:均符合Rome Ⅲ诊断标准[6]。本研究经过患者及家属知情同意,伦理委员会批准。排除标准:近3个月应用过抗菌药物;近3周内服用过胃肠动力药物;有腹部手术史;有其他肠道疾病如免疫性肠病、肛瘘等;有严重心、肝、肾等脏器疾病;恶性肿瘤患者、免疫系统疾病患者、精神疾病患者、妊娠者、甲状腺功能亢进患者。选取健康志愿者50例作为对照组,男性27例、女性23例,年龄32~55岁,平均(38.13±9.52)岁。两组一般资料比较,差异无统计学意义(P>0.05)。
1.2方法 采集2 mL左右的静脉血放置于含10%EDTA和抑肽酶的特殊试管内,低速离心分离血浆,-20 ℃保存待检。采用酶联免疫吸附测定(ELISA)测定血浆中的细胞因子:白细胞介素(IL)-10、转化生长因子β1(TGF-β1)、IL-17、IL-21,试剂盒来自上海西唐生物科技有限公司,检测设备为美国Bio-Rad model 550酶标仪;通过实时荧光定量PCR(qPCR)检测肠黏膜优势菌:拟杆菌门、厚壁菌门、梭菌属、普氏杆菌。
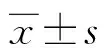
2 结 果
2.1两组间外周血Treg/Th17细胞因子比较 D-IBS组外周血IL-10、TGF-β1水平显著低于对照组(P<0.05),IL-17、IL-21水平显著高于对照组(P<0.05),见表1。
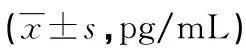
表1 两组间外周血Treg/Th17细胞因子比较
2.2两组间肠黏膜优势菌水平比较 D-IBS组拟杆菌门、厚壁菌门、梭菌属、普氏杆菌水平均显著低于对照组(P<0.05),见表2。
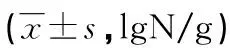
表2 两组肠黏膜优势菌比较
2.3D-IBS患者Treg/Th17细胞因子与肠黏膜优势菌的相关性分析 经过Spearman相关性分析,IL-10、TGF-β1与D-IBS患者拟杆菌门、厚壁菌门、梭菌属、普氏杆菌水平均呈正相关(P<0.05),IL-17、IL-21与D-IBS患者拟杆菌门、厚壁菌门、梭菌属、普氏杆菌水平均呈负相关(P<0.05)。见表3。
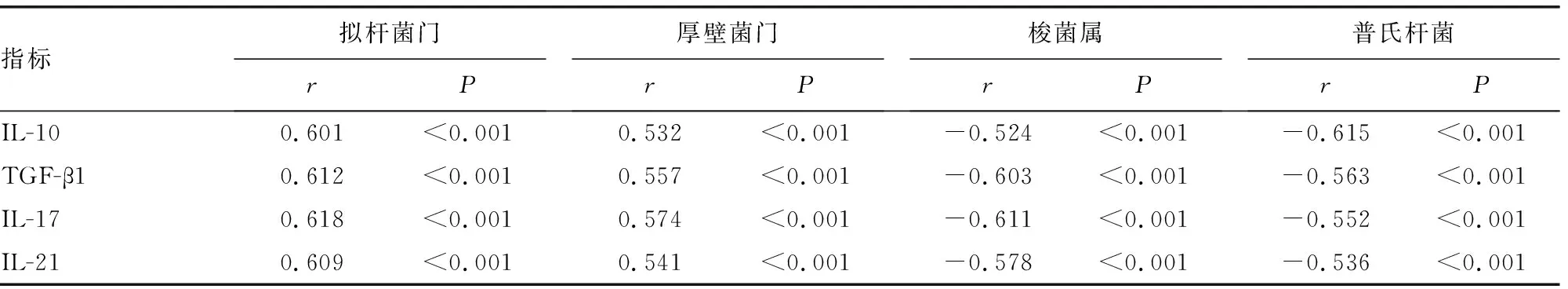
表3 D-IBS患者Treg/Th17细胞因子与肠黏膜优势菌的相关性分析
3 讨 论
D-IBS作为消化内科常见的功能性疾病病之一,大多数D-IBS患者容易受到腹痛的困扰,且临床并无特效治愈药,给患者的日常生活带来很大影响,给其带来巨大的经济负担和心理压力[7]。目前关于D-IBS致病原因和机制并不是特别明确,有研究认为与胃肠动力改变、异常增加的中枢神经系统感知、内脏敏感性、脑肠轴调节和炎性反应、情绪异常等因素相关[8]。随着肠道微生态研究的不断发展,越来越多的研究表明D-IBS发病是由于肠道微生物发生变化所致[9]。无论D-IBS最早是源自外界化学刺激物或感染,其最终都会导致肠道菌群发生变化,当肠道内的正常菌群和其他有害菌的生态平衡发生紊乱时会导致疾病的发生[10]。
本研究表明,D-IBS组外周血IL-10、TGF-β1显著低于对照组,IL-17、IL-21显著高于对照组(P<0.05)。Treg细胞能够分泌IFN-γ、IL-2和TNF-α等炎性因子,可发挥抗细菌、寄生虫的作用。Th17细胞可以分泌细胞因子IL-17、IL-22,其中的IL-17作为机体的效应因子,能够诱导机体大量表达IL-6、TNF-α、IL-8等发挥炎性反应,并调控中性粒细胞的增殖[11]。而IL-22可促进角质细胞增殖,介导IL-23发挥表皮细胞增殖和促进炎症;Th17细胞虽然不能直接分泌IL-23,但它作为确保Th17细胞能否生存的重要因子,可以诱导CD4+T细胞转变为Th17细胞,激活Th17分泌大量的细胞因子,从而产生IL-23/IL-17,最终影响D-IBS的发生、发展[12]。当它们维持一定平衡状态时,机体能够维持正常的生理防御、免疫监视等功能;当平衡状态被打破,会导致机体打破对肠道常驻细菌的耐受状态,使抗原微生物免疫和异物排斥反应增强。SCHMULSON等[13]报道,炎性反应会慢慢改变肠黏膜内的细胞结构,从而增加肠易激综合征患者肠内的炎性因子表达。T淋巴细胞亚群是一种可以用来评估细胞免疫功能的指标,Treg/Th17细胞因子失衡会造成患者免疫功能失调,对机体不利的免疫因子大量释放,造成持续性的炎性反应,进一步损伤细胞,最终影响人体的胃肠道的运动、感觉及分泌功能[14-15]。
D-IBS组拟杆菌门、厚壁菌门、梭菌属、普氏杆菌水平均显著低于对照组(P<0.05)。梭菌属作为厚壁菌门中的优势菌群,该菌属和肠黏膜完整性密切相关;拟杆菌门可以促进肠黏膜血管再生,加快肠道免疫系统发育,维持肠道菌群的平衡;这些菌群的数量直接反映患者的肠道微生态是否失衡、肠黏膜完整性有无破坏[16-17]。本研究发现,IL-10、TGF-β1与D-IBS患者拟杆菌门、厚壁菌门、梭菌属、普氏杆菌均呈正相关(P<0.05),说明在一定程度上IL-10、TGF-β1水平可反映肠道黏膜菌群的特点;而IL-17、IL-21与D-IBS患者拟杆菌门、厚壁菌门、梭菌属、普氏杆菌均呈负相关(P<0.05),提示IL-17、IL-21可能与肠道致病菌的清除作用相关。
综上所述,D-IBS患者存在Treg/Th17细胞因子失衡,且与肠黏膜优势菌含量的变化有关。
