TRIF在血栓闭塞性脉管炎患者血管组织中的表达水平及临床意义*
2021-09-16尹江燕
尹江燕,郭 轶
1.重庆医科大学附属第一医院超声科,重庆 400016;2.重庆大学附属中心医院/重庆市急救医疗中心普外科,重庆 400014
血栓闭塞性脉管炎(TAO)是一种病因尚不明确的主要累及中、小型动静脉的节段性、炎症性和闭塞性疾病[1]。近期许多研究发现,过度自身免疫反应诱发靶器官炎症进而导致的血管痉挛、炎性闭塞和血栓形成与TAO的起病及进展密切相关[2-4]。β干扰素Toll样受体结构域衔接蛋白(TRIF)信号通路是Toll样受体家族重要的下游通路,其被证实与多种自身免疫性疾病密切相关[5-6],本课题组前期研究发现TRIF在TAO患者的腰交感神经节中有高表达,其通过诱发神经节炎症间接地导致血管痉挛,可能参与TAO的发病过程[7]。但在TAO患者受损最严重的靶器官外周血管组织中TRIF的表达情况及其意义却少见报道,因此本课题组对TAO患者血管组织中TRIF的表达水平进行了检测,并分析了其在血管组织中的表达特点,旨在进一步阐明TRIF信号通路与TAO发病的相关性。
1 资料与方法
1.1一般资料 选取2017年1月至2019年12月重庆医科大学附属第一医院和重庆市急救医疗中心临床诊断为TAO并行下肢截肢的患者(在术后病理诊断确诊为TAO,排除术后病理无法确诊及确诊为其他疾病的患者)作为TAO组,共纳入26例,其中男26例、女0例,年龄36~52岁(中位年龄42.2岁)。选取同期重庆医科大学附属第一医院和重庆市急救医疗中心无血管相关疾病病史因其他疾病行下肢截肢的患者(术后病理检查均排除血管相关疾病)作为对照组,共纳入18例,其中男11例、女7例,年龄26~55岁(中位年龄44.5岁)。
1.2仪器与试剂 TRIF、CD31、SAM抗体购自Sigma公司,生物素化二抗(博士德,武汉),辣根过氧化物酶(HRP)标记二抗(中杉,北京),RNA提取和扩增试剂盒(TaKaRa),蛋白质裂解试剂盒,BCA蛋白浓度试剂盒,配胶试剂盒,ECL显影试剂盒(碧云天,江苏),荧光采集处理与分析系统(Leicaqwin,德国)。
1.3反转录PCR(RT-PCR)检测 取上述纳入研究者血管组织标本(均为下肢),先用Trizol法进行总RNA的提取,每50~100 mg组织标本碾碎后加入1 mL Trizol试剂行组织裂解,取裂解液加入0.2 mL氯仿,振荡后室温放置5 min,4 ℃离心10 min(12 000 r/min), 转移水相后加入异丙醇再次离心,弃上清液后加入预冷的75%乙醇洗涤、离心并检测RNA浓度。然后按照PCR试剂盒说明书进行RNA的反转录和目的基因扩增。PCR扩增引物(由上海英骏生物有限公司合成),TRIF上游引物:5′-AAACCAGCACCAACTACCCA-3′;下游引物:5′-CTTCCAAACTTCACGCTCT-3′;扩增片段为293 bp。GAPDH上游引物:5′-AGTCCACTGGCGTCTTCA-3′;下游引物:5′-AGTCCTTCCACGATACCAA-3′;扩增片段为232 bp。扩增条件为94 ℃预变性2 min;随后94 ℃ 30 s,72 ℃延伸30 s,共35个循环;最后72 ℃延伸10 min。最后运用Gene凝胶图像仪进行图像采集、分析、测量、统计分析。
1.4Western blot检测 取少许新鲜血管组织放入预先加入1 mL蛋白提取缓冲液和蛋白酶抑制剂的匀浆器中,冰上研磨后吸取研磨液,冰上孵育10 min,4 ℃离心10 min(12 000 r/min)。吸取上清液用BCA蛋白质定量试剂盒测量蛋白浓度后分装。按照1∶5的比例加入上样缓冲液后置于100 ℃沸水中3 min进行蛋白变性。10%SDS聚丙烯酰胺凝胶中,每孔上样量30 μL,60 V、30 min,再用100 V、1 h,PVDF膜100 mA转膜1 h,5%脱脂奶粉封闭2 h,加入按1∶1 000稀释的TRIF一抗,4 ℃孵育过夜。加入二抗,37 ℃孵育2 h,TBST清洗后用ECL发光试剂盒进行曝光。选用GAPDH为内参对照。用ECL发光试剂盒进行检测,Image Lab凝胶成像分析软件进行图像扫描与分析。
1.5免疫荧光共聚焦检测 取冰冻临床手术标本组织,用4%多聚甲醛缓冲液固定24 h后,用15%和30%蔗糖梯度脱水,沉底后进行切片。加入5%山羊血清37 ℃,20 min。去血清后加入一抗TRIF抗体(1∶100),并分别加入CD31和SAM抗体(1∶250),4 ℃过夜。次日加入二抗,37 ℃,50 min,加入DAPI,37 ℃,6 min。封片后在激光共聚焦显微镜下进行观察和采图。
2 结 果
2.1TRIF mRNA和蛋白在TAO组和对照组患者血管组织中表达 RT-PCR结果显示,TRIF和内参GAPDH的PCR扩增片段分别为293、232 bp;TAO组TRIF mRNA的吸光度值为0.831±0.033,明显高于对照组TRIF mRNA的吸光度值(0.192±0.008),差异有统计学意义(P<0.05),见图1。同时Western blot结果显示,TRIF和内参GAPDH的蛋白相对分子质量大小分别为66×103、37×103;TAO组TRIF蛋白的吸光度值为0.806±0.015,明显高于对照组TRIF蛋白的吸光度值(0.162±0.017),组间比较差异有统计学意义(P<0.05),见图2。

图1 TRIF mRNA RT-PCR检测的电泳图

图2 TRIF蛋白表达水平检测的Western blot图
2.2TRIF在TAO患者血管组织细胞中的表达特点 免疫荧光组织染色显示,在TAO患者血管组织中在可以见到TRIF的高表达,以SAM染色代表平滑肌,可观察到两者共表达,见图3。TAO患者血管中膜的平滑肌细胞可以分泌TRIF蛋白,并且TRIF主要在细胞质和细胞膜上表达。
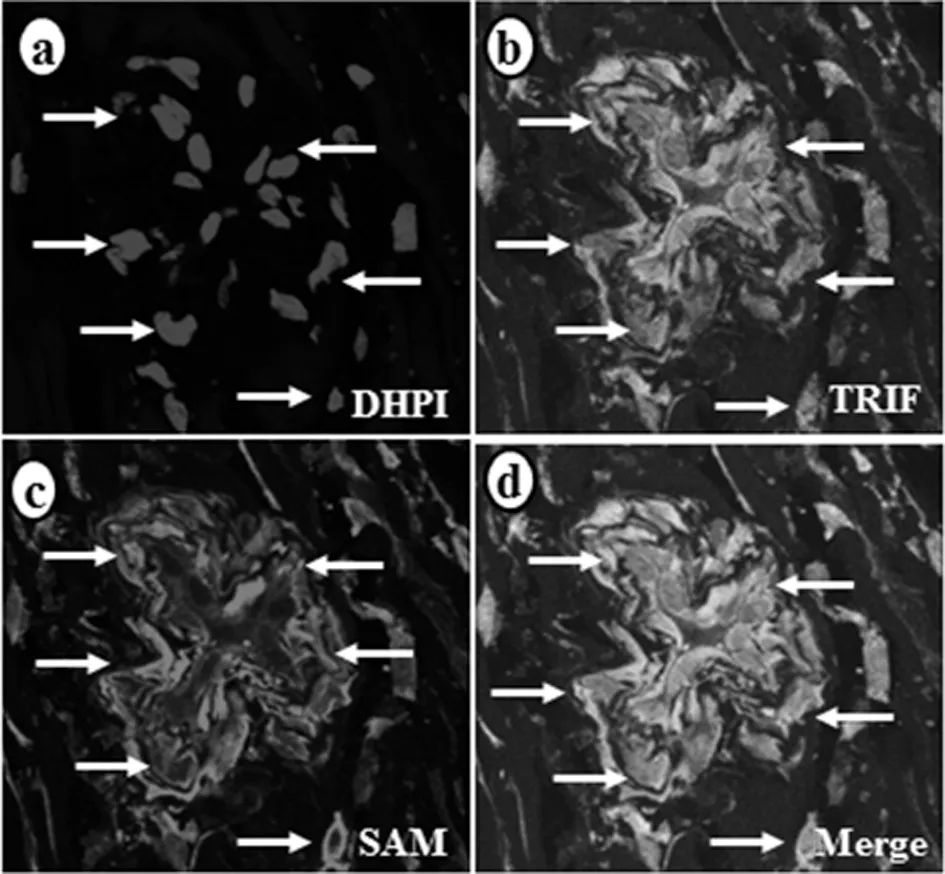
注:a表示细胞核染色;b为血管组织中TRIF的表达;c为平滑肌的SAM染色;d表示SAM和TRIF的共表达情况。
3 讨 论
TAO又称Buerger′s病,于1908年被首次报道。虽经过了一个多世纪的探索和研究,TAO的发病机制仍未阐明,其治疗效果亟待提高,截肢仍是绝大多数TAO患者的最终结局[3,8]。近期许多研究发现TAO的起病与烟草、细菌感染及寒冷刺激诱发的自身免疫性炎症密切相关[9];TAO患者的病理生理改变主要为血管痉挛、血管组织炎性损伤及继发血栓形成,但其具体机制尚不明确[4,10]。因此,自身免疫性炎症损伤与TAO发病的相关性逐渐成为TAO的研究热点之一。自身免疫性炎症是复杂的分子生物过程,多种免疫相关信号通路参与其中[11],Toll样受体(TLRs)通路是机体最重要的非特异性固有免疫应答途径,其可通过激活一系列下游信号通路进而调节机体免疫应答和自身免疫性炎性反应[12];近期许多研究也发现TLRs通路与多种自身免疫性疾病密切相关[13]。TRIF信号通路是TLRs最重要的下游通路之一,其主要与TLR4结合参与多种炎性疾病及自身免疫性疾病的发病过程[14],但TRIF通路与TAO的相关性的相关研究仍较少。本试验检测TRIF在TAO患者血管组织中的表达情况,初步探讨TRIF通路与TAO发病的相关性。
在TAO的发病及进展过程中,血管痉挛是最早和最主要的临床表现之一,而且血管痉挛贯穿TAO的整个病程[15]。绝大多数TAO患者起病初期以血管痉挛为主要表现,血管痉挛与交感神经功能紊乱密切相关,因此,早期的TAO患者行腰交感神经切除术或用药物阻断缺血患肢的周围交感神经可明显改善下肢血管痉挛进而减轻缺血症状[15-16],但诱发及促进TAO患者血管痉挛的机制尚未明确。有研究发现,TAO患者血管外膜神经分布异常和儿茶酚胺的缺乏可能是导致其血管痉挛的重要因素[17]。支配四肢小血管舒缩功能的神经纤维来自交感神经节,主要是交感缩血管神经纤维,若神经节发生病变,可导致神经递质释放异常,进而引发神经炎症性血管痉挛[18],但其具体机制有待进一步阐明。本课题组前期研究发现TRIF在TAO患者腰交感神经节中高表达,该通路可能参与神经功能异常诱发TAO患者血管痉挛的发病过程[7]。
但随着TAO的进展,血管痉挛会进行性加重,而且行腰交感神经切除术或用药物阻断患肢的周围交感神经无法缓解血管痉挛。这种现象提示随着TAO的进展,血管痉挛可能存在多因素的联合作用。血管平滑肌在血管的收缩中也起重要作用,血管痉挛和血管平滑肌的功能也存在密切相关[19]。研究发现,血管平滑肌的炎症或者功能异常均可导致血管痉挛[20];同时有研究发现TRL4信号通路可以参与脑血管痉挛的病理生理过程,其作用机制可能与TRL4通过TRIF通路激活下游的NF-κB通路进而诱发的平滑肌炎症有关[21]。因此,结合本课题组前期研究,笔者推测TRIF通路也可能通过诱发TAO患者血管壁平滑肌的炎性反应进而加重血管痉挛的发生。本研究通过检测TAO患者血管组织标本中TRIF的mRNA、蛋白发现其TAO患者血管组织中的表达远高于对照组。同时荧光共聚焦显示TRIF主要在TAO患者血管肌层的平滑肌细胞的细胞质和细胞膜表达,在血管内膜的内皮细胞未见明显表达。这些结果证实TRIF通路可能也可以诱发血管平滑肌的炎症进而加重TAO患者的血管痉挛,导致疾病的进展。其具体机制可能是TRIF通路激活其下游的NF-κB通路进而活化一系列炎性反应。首先NF-κB通路可以诱导激活物蛋白1(AP-1)直接导致平滑肌细胞的损伤,导致平滑肌细胞失去弹性并保持僵硬状态诱发持续性血管痉挛[22];同时,NF-κB通路还可以诱导白细胞分泌大量炎性介质如白细胞介素(IL)家族(IL-1、IL-2、IL-8等),这些炎性介质可以诱发平滑肌炎性反应,引起平滑肌细胞收缩进而导致血管痉挛[23];最后,NF-κB通路还可以促进血管内皮细胞分泌内皮细胞间黏附分子-1(ICAM-1)、血管细胞间黏附分子-1(VCAM-1)等炎性介质进而诱发血管壁平滑肌细胞间的炎性黏附导致血管痉挛[24]。但是各种炎性介质诱发的炎性反应导致平滑肌细胞强烈收缩的机制仍需进一步研究。
综上所述,TRIF在TAO患者血管组织的高表达与TAO的发病和进展密切相关。其可能的机制是TRIF激活下游的NF-κB通路诱发血管平滑肌细胞发生一系列严重的炎性反应,进而引导持续性的血管痉挛导致TAO的发病及进展,但是其具体的作用机制仍有待进一步的研究。同时针对TRIF的靶向治疗可能成为TAO治疗的新方法。
