miR-361-3p对儿童肺炎炎性损伤的保护作用及机制研究
2021-09-16李晓波
刘 莉,张 军,李晓波
汉中市三二〇一医院:1.检验科;2.微免科,陕西汉中 723000
肺炎是一种常见的感染性疾病,在儿童中的发病率和病死率较高。2015年,全世界大约有70万名5岁以下儿童死于肺炎[1]。微小RNA(miRNA)作为一种小型非编码RNA,通过结合3′端非翻译区(3′UTR)调控其下游靶基因表达,参与细胞增殖、迁移、凋亡以及固有免疫、炎症和感染等过程[2-3]。研究发现,大量miRNA在儿童肺炎的炎性损伤中发挥重要作用[4-6]。肺部感染后,大量促炎性因子的产生可加重肺组织损伤[7]。有研究表明,miR-361-3p在克罗恩病中发挥重要作用[8],但其在肺炎中的研究未见报道。本研究通过检测肺炎患儿血清中miR-361-3p表达,同时利用脂多糖(LPS)刺激人胚肺成纤维细胞WI-38构建肺炎损伤细胞模型,采用“敲减-回复”的研究策略探讨miR-361-3p对肺炎中促炎性细胞因子水平的影响,旨在为临床肺炎的治疗提供新的方向。
1 资料和方法
1.1一般资料 将20例3~5岁的肺炎患儿(女性10例,男性10例)纳入研究,患儿均根据临床表现、呼吸道症状、细菌感染及胸部影像学检查确诊为肺炎,来自本院急诊科,在采血前未接受任何治疗。另外,选取同期在本院进行体检的性别、年龄匹配与纳入研究肺炎患儿相匹配的健康儿童作为对照。所有参与研究儿童的合法监护人均对本研究知情同意,并签署知情同意书;研究通过本院伦理委员会审查批准。
1.2实验材料 人胚肺成纤维细胞WI-38购自中国典型培养物保藏中心(中国武汉);DMEM培养基、胎牛血清购自Gibco公司;LPS、MyD88抗体和GAPDH抗体购自Abcam公司;逆转录试剂盒、实时荧光定量PCR(qPCR)检测试剂盒购自Bimake公司;白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α和IL-1β酶联免疫吸附测定(ELISA)试剂盒购自上海酶联生物科技有限公司;Lipofectamine 3000试剂购自Invitrogen公司;一抗稀释液、SDS试剂盒、PBS购自碧云天公司。miR-361-3p模拟物、抑制物,pcDNA3.1-MyD88质粒(oe-MyD88)及各自的阴性对照(NC)由上海Gene Pharma公司合成。
1.3方法
1.3.1细胞培养和转染 WI-38细胞培养采用含10%胎牛血清和1%青霉素、链霉素的DMEM培基,置于37 ℃、5%CO2培养箱中培养。采用转染miR-361-3p模拟物或抑制物提高或敲减WI-38细胞中miR-361-3p的表达,采用转染oe-MyD88在WI-38细胞中过表达MyD88。具体方法如下:将对数期的2×105个WI-38细胞接种于6孔板内,24 h后换新鲜培基,将50 nmol/L miR-361-3p模拟物、100 nmol/L miR-361-3p抑制物或2~4 μg oe-MyD88质粒加入6孔板内,同时加入Lipofectamine 3000试剂4.5 μL,培养48 h。细胞采用5 μg/mL LPS处理72 h,构建体外肺炎细胞模型。miR-361-3p模拟物序列为5′-TTA TCA GAA TCT CCA GGG GTA C-3′,miR-361-3p抑制物序列为5′-AAT GTC TTA GAG GAC CCC ATG-3′。
1.3.2qPCR检测 收集细胞,采用Trizol法提取总mRNA,按Bimake逆转录试剂盒说明书进行操作,获取cDNA。qPCR反应体系的配制:SYBR Premix Ex Taq 5 μL,上、下游引物各0.2 μL,cDNA 2 μL、ddH2O 3.6 μL。反应条件:95 ℃ 20 s预变性;95 ℃ 5 s,60 ℃ 20 s,共扩增45个循环。采用2-ΔΔCt计算目的基因的相对表达量。引物序列见表1。
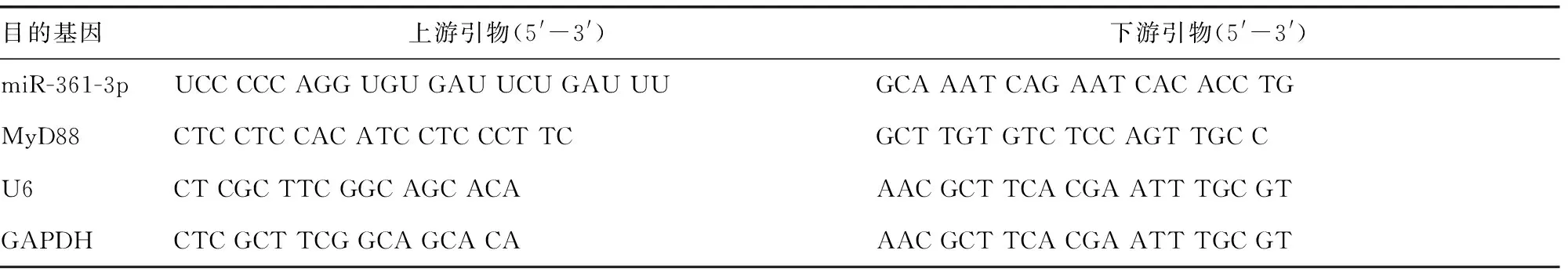
表1 引物序列
1.3.3ELISA检测 采集肺炎组和对照组每位儿童的外周静脉血2 mL,离心取血清作为检测标本;收集经LPS处理和未经LPS处理(作为对照)的WI-38细胞上清液作为检测标本。用相应的ELISA试剂盒检测标本中的IL-6、TNF-α和IL-1β水平,均按试剂盒操作说明进行操作,用酶标仪在450 nm处检测吸光度,根据标准品得到线性校准曲线,进行均一化水平计算。
1.3.4Western blot检测 收集待测细胞,用PBS洗两遍,加细胞裂解液80 μL置冰上裂解30 min,吸取液体,离心收集蛋白,用BCA试剂盒进行蛋白定量检测。取蛋白30 μg上样,进行SDS-PAGE电泳后转膜,用5%的脱脂牛奶3 ℃封闭1 h。MyD88抗体作为一抗按1∶1 000进行稀释,4 ℃孵育过夜。加HRP标记的二抗37 ℃避光孵育2 h,PBS-T反复洗涤,加ECL试剂,采用化学发光仪检测目的蛋白。
1.3.5荧光素酶报告基因试验 从美国国家生物信息中心(NCBI)数据库中下载人MyD88-3′UTR基因序列,采用Primer5.0软件进行引物设计。将含有miR-361-3p结合位点的MyD88、3′UTR野生型(WT)或突变型(MuT)片段插入psiCHECK-2载体中。取2×104个WI-38细胞接种于24孔板中,培养24 h。转染前更换新鲜培基,将脂质转染试剂Lipofectamine 3000与质粒及miR-361-3p模拟物溶液混合,共转染至WI-38细胞中。转染24 h后,用荧光素酶报告基因检测系统检测荧光素酶活性。
2 结 果
2.1血清miR-361-3p和MyD88在肺炎患儿和健康儿童中的相对表达水平比较 与健康儿童比较,肺炎儿童血清miR-361-3p相对表达水平显著降低(P<0.05),见图1A;与健康儿童比较,肺炎儿童血清MyD88相对表达水平显著升高(P<0.05),见图1B;与健康儿童相比,肺炎儿童促炎性因子IL-6、TNF-α和IL-1β的水平均显著升高(P<0.05),见图1C。
2.2miR-361-3p减轻肺炎炎性损伤的体外模型研究 建立了LPS诱导的体外肺炎模型。在LPS损伤的WI-38细胞中,miR-361-3p表达水平比对照细胞显著降低(P<0.05),见图2A。随后,采用miR-361-3p模拟物和miR-361-3p抑制物转染WI-38细胞,用LPS处理后检测miR-361-3p的表达,结果显示miR-361-3p模拟物能显著提高miR-361-3p表达,miR-361-3p抑制物显著降低了miR-361-3p的表达(P<0.05),见图2B。ELISA结果显示,miR-361-3p模拟物降低了LPS损伤的WI-38细胞炎性因子IL-6、TNF-α和IL-1β的水平(P<0.05),见图2C~2E。miR-361-3p抑制物提高了LPS损伤的WI-38细胞炎性因子IL-6、TNF-α和IL-1β的水平(P<0.05)。
2.3miR-361-3p下调MyD88的表达 为了探究miR-361-3p调控儿童肺炎炎性损伤的分子机制,本课题组采用TargetScan Human预测到MyD88为miR-361-3p的下游靶基因。MyD88基因的3′UTR与miR-361-3p序列互补(图3A)。采用荧光素酶报告基因实验进一步确认MyD88是否为miR-361-3p的直接靶基因。结果显示,在psiCHECK-2-MyD88-野生型中,miR-361-3p模拟物显著降低了荧光素酶的相对活性,而在psiCHECK-2-MyD88-突变型无明显变化(图3B),表明MyD88是miR-361-3p的直接靶基因。此外,本课题组检测了经LPS处理的WI-38细胞中miR-361-3p和MyD88表达的关系。qPCR和Western Blot结果显示,miR-361-3p上调抑制MyD88 mRNA和蛋白的表达(图3C~3E)。
2.4MyD88在体外逆转miR-361-3p在肺炎炎性损伤中的保护作用 为了研究MyD88在miR-361-3p调控的儿童肺炎炎性损伤中的作用,本课题组检测了MyD88在经LPS处理的WI-38细胞中的表达,结果显示相较于未经处理的对照组细胞,LPS损伤的WI-38细胞中MyD88表达水平更高(P<0.05,图4A)。在WI-38细胞中过表达MyD88,MyD88的表达水平明显增加(P<0.05,图4B)。在过表达miR-361-3p的WI-38细胞中增加MyD88的表达,促炎性因子表达明显升高(P<0.05,图4C~4E)。表明MyD88能在体外逆转miR-361-3p在肺炎炎性损伤中的保护作用。

注:A为qPCR检测肺炎儿童和健康儿童血清miR-361-3p的相对表达水平;B为qPCR检测肺炎儿童和健康儿童血清MyD88的相对表达水平;C为ELISA检测肺炎儿童和健康儿童血清中IL-6、TNF-α和IL-1β的水平;与健康儿童比较,**P<0.01,***P<0.001。
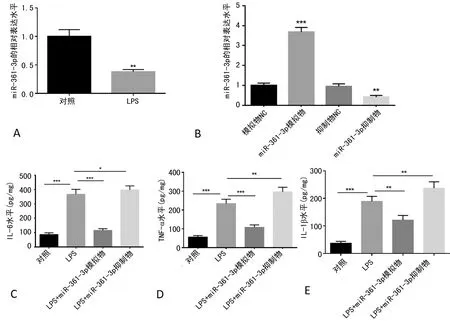
注:A表示LPS诱导的体外肺炎模型中miR-361-3p表达水平的变化;B表示转染miR-361-3p模拟物或抑制物对WI-38细胞miR-361-3p表达水平的影响;C~E分别表示转染miR-361-3p模拟物或抑制物对LPS诱导的体外肺炎模型细胞IL-6、TNF-α、IL-1β表达水平的影响;*表示P<0.05,**表示P<0 .01,***表示P<0.001。
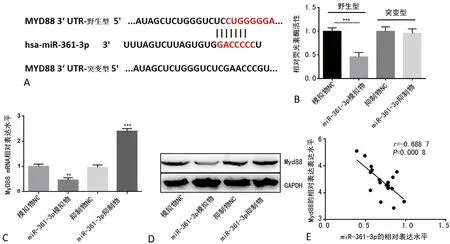
注:A表示miR-361-3p与MyD88的预测结合位点;B表示psiCHECK-2载体处理后,转染野生型或突变型miR-361-3p模拟物WI-38细胞的相对荧光素酶活性检测;C、D分别表示转染miR-361-3p模拟物或抑制物对LPS诱导的体外肺炎模型细胞MyD88的mRNA和蛋白表达水平的影响;E为肺炎患儿血清中miR-361-3p与MyD88表达的相关性(n=20);**表示P<0.01,***表示P<0.001。
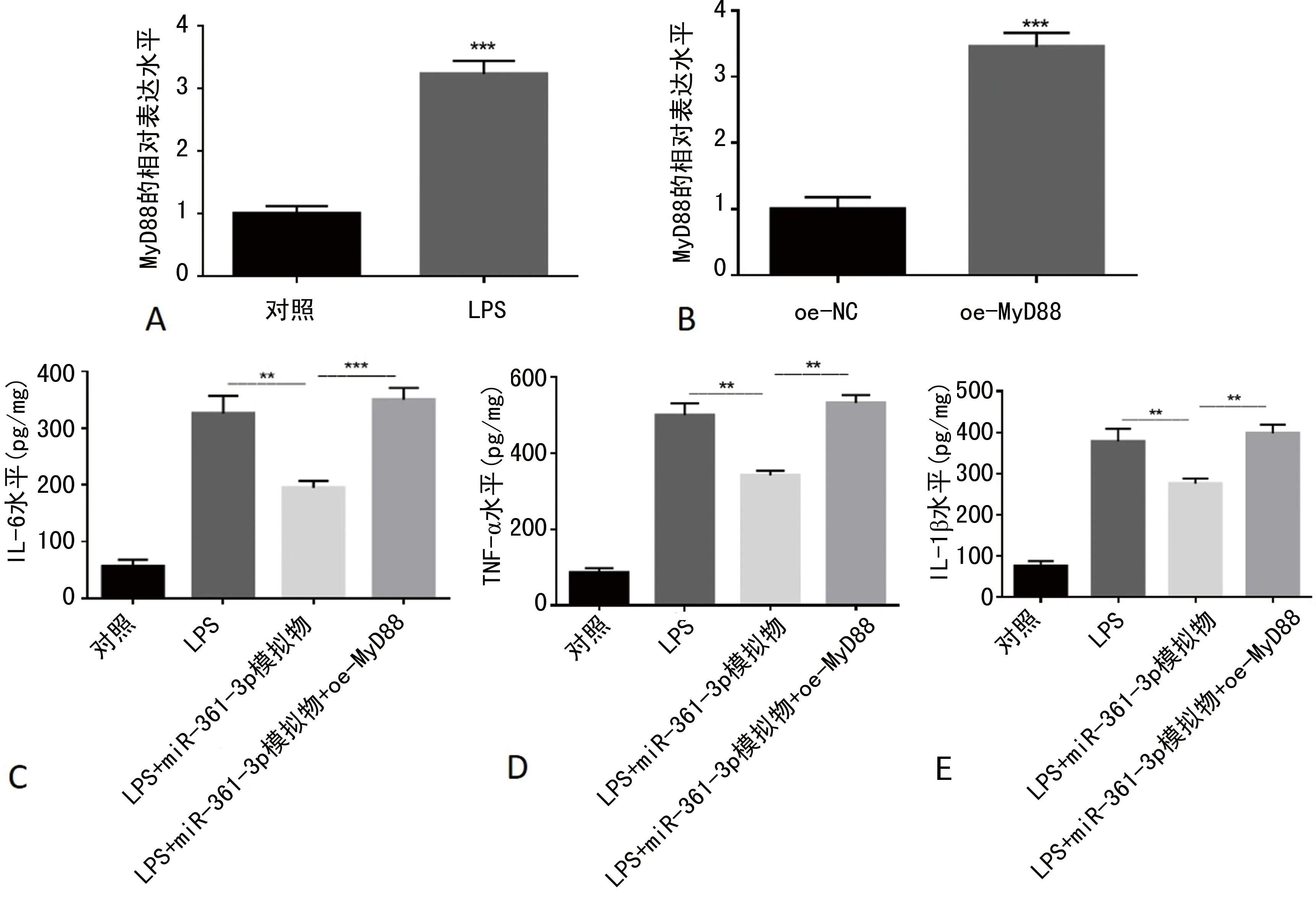
注:A表示LPS诱导的体外肺炎模型中MyD88相对表达水平的变化;B为WI-38细胞转染oe-MyD88后对MyD88相对表达水平的影响;C~E分别为miR-361-3p模拟物转染或联合oe-MyD88转染WI-38细胞对LPS诱导的体外肺炎模型中IL-6、TNF-α和IL-1β表达水平的影响;**表示P<0.01,***表示P<0.001。
3 讨 论
肺炎是指由微生物及理化因素等造成的终末气道、肺泡及肺间质的炎症。最常见的为革兰阴性条件致病菌导致的肺炎[9]。儿童肺炎的发病率较高,且可引起多种严重并发症,影响儿童的发育,甚至导致死亡[10]。促炎性因子如IL-6、IL-1β和TNF-α等的异常表达被认为是导致肺炎加重及发生并发症的主要因素,抑制促炎性因子的表达,可以减轻肺组织的损伤[11]。
有研究发现,miRNA在肺炎中发挥重要作用,miR-141在LPS诱导的WI-38成纤维细胞的炎性损伤中发挥保护作用[4]。此外,miR-1247通过靶向趋化因子CC配体抑制LPS诱导的A549细胞急性损伤[12]。而miR-194和miR-20a对儿童肺炎炎性损伤有促进作用。有研究报道,miR-361-3p是一种肿瘤调节因子,同时与多种其他疾病如强直性关节炎和麻风有关[8,13-15]。然而,miR-361-3p在肺部炎症中的表达情况尚不清楚,miR-361-3p在肺部炎症中的异常表达是否与炎性损伤相关尚鲜见报道。本研究发现肺炎儿童血清中miR-361-3p呈显著低表达,且miR-361-3p与促炎性因子IL-6、IL-1β和TNF-α表达水平呈负相关。为了进一步探究miR-361-3p与肺炎的关系,本课题组采用LPS刺激WI-38细胞建立体外肺炎模型,结果显示,经LPS刺激后,WI-38细胞中miR-361-3p表达水平降低。而在WI-38细胞中过表达miR-361-3p后,再采用LPS刺激,促炎性因子的表达水平明显下降,而降低miR-361-3p的表达,促炎性因子表达水平增加。这表明miR-361-3p在肺炎患儿中通过抑制促炎性因子的表达而发挥保护作用。
MyD88是Toll样受体(TLR)信号通路的关键连接分子,在疾病发生发展中发挥重要作用。MyD88被证实参与炎性肺损伤,包括肺炎。有学者发现MyD88促进了通气性肺损伤和炎症[16]。同时,SONEGO等[17]发现MyD88参与了铜绿假单胞菌诱导的肺部感染。本研究中,本课题组发现MyD88表达与miR-361-3p负相关,并参与了miR-361-3p介导的WI-38细胞炎性反应过程。此外,本课题组发现MyD88是miR-361-3p的直接靶点。在WI-38细胞中过表达MyD88可增加促炎性因子的表达。结果提示,miR-361-3p通过调控MyD88在WI-38细胞的炎性损伤中起保护作用。
综上所述,本研究发现增加miR-361-3p的表达在儿童肺炎的炎性损伤中具有保护作用。进一步探究miR-361-3p减轻LPS诱导的WI-38细胞炎性损伤的机制,可能为儿科肺炎的治疗提供新的治疗靶点。
