血管内皮损伤生物标志物联合载脂蛋白A1、NALP3检测对青年痛风的诊断价值
2021-09-16应长江
吕 秋,李 伟,应长江
1.徐州医科大学附属淮海医院内分泌科,江苏徐州 221002;2.徐州医科大学附属医院内分泌科,江苏徐州 221000
痛风为一种嘌呤代谢紊乱性疾病,多为尿酸排泄障碍引起,发病率为1%~3%,男女患者比例为15∶1[1]。随着饮食和生活方式的改变,痛风患者有年轻化的趋势[2]。早期积极干预及降低尿酸水平能够延缓疾病进展或阻止脏器损害。核苷酸结合寡聚化结构域(NOD)样受体蛋白3(NLRP3)为NOD样受体家族成员,能够识别多种病原微生物,在炎性联级反应、固有免疫等过程中有重要作用[3]。载脂蛋白A1(ApoA1)是高密度脂蛋白(HDL)的结构蛋白,有着逆向转运胆固醇、抗炎、抗氧化、抗动脉粥样硬化的作用[4]。内皮素1(ET-1)和细胞间黏附分子1(ICAM-1)为临床常见的血管内皮损伤生物标志物,与心血管内皮损伤关系密切[5]。既往报道显示,ET-1、ICAM-1、ApoA1、NALP3均与痛风有关,但目前国内关于其联合应用于青年痛风诊断的报道较少[6-8]。本研究分析了血管内皮损伤生物标志物ET-1、ICAM-1联合ApoA1、NALP3诊断青年痛风的价值,旨在为临床工作提供参考。
1 资料与方法
1.1一般资料 选取2017年8月至2020年8月徐州医科大学附属淮海医院收治的123例青年痛风患者作为病例组,病程(7.85±2.13)年,其中慢性痛风69例、急性痛风54例;另外,选取同期在徐州医科大学附属淮海医院体检的健康者60例作为对照组。两组一般资料[包括性别、年龄、体质量指数(BMI)等]比较,差异无统计学意义(P>0.05),见表1。纳入标准:(1)痛风的诊断参照《中国高尿酸血症与痛风诊疗指南(2019)》中的相关诊断标准[1];(2)青年人群(年龄16~44岁);(3)依从性好,可配合完成随访;(4)自愿签署知情同意书。排除标准:(1)继发性痛风;(2)合并代谢性疾病、自身免疫性疾病、血液系统疾病、传染性疾病、感染性疾病、恶性肿瘤、高血压、冠心病;(3)妊娠期或哺乳期妇女;(4)临床资料不齐全;(5)心、肝、肺、脑等重要脏器功能异常。本研究取得本院医学伦理委员会批准。
1.2方法 询问并记录受试者的吸烟史、饮酒史、高嘌呤饮食情况。于入院次日清晨采集肘静脉血5 mL,采用Optima MAX-XP台式超速离心机(贝克曼库尔特商贸有限公司),以3 000 r/min离心15 min,分离血清,采用酶联免疫吸附法(ELISA)检测血清ET-1、ICAM-1、NALP3水平,仪器为ELx808LBS酶标仪(北京泽平科技有限责任公司),检测试剂为原厂配套试剂;采用透射免疫浊度法检测血清ApoA1水平,仪器为PUZS-300全自动生化分析仪(上海帝博思生物科技有限公司),检测试剂为原厂配套试剂。
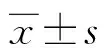
2 结 果
2.1两组一般资料及4项检测指标的比较 两组间吸烟史比较差异无统计学意义(P>0.05);病例组有饮酒史、高嘌呤饮食比例显著高于对照组(P<0.05);病例组血清ET-1、ICAM-1、NALP3水平显著高于对照组(P<0.05),病例组血清ApoA1水平显著低于对照组(P<0.05)。见表1。
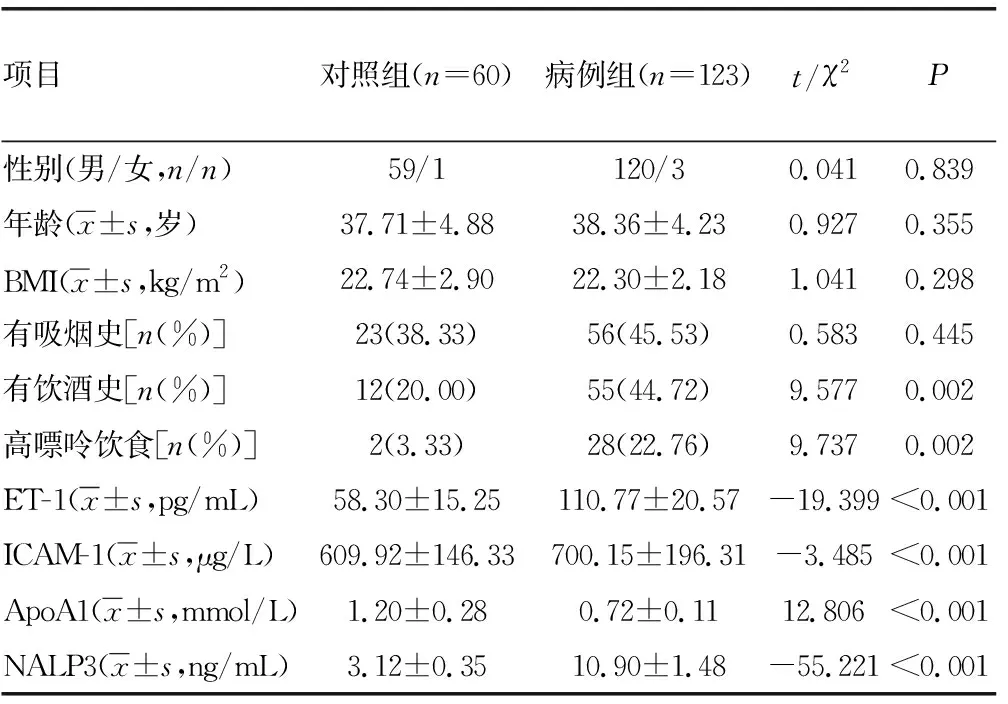
表1 两组间一般资料及4项检测指标的比较
2.2急、慢性痛风患者血清ET-1、ICAM-1、ApoA1、NALP3水平的比较 急性痛风患者血清ET-1、ICAM-1、NALP3水平显著高于慢性痛风患者(P<0.05);急性痛风患者血清ApoA1显著低于慢性痛风患者(P<0.05),见表2。
表2 急、慢性痛风患者血清ET-1、ICAM-1、ApoA1、NALP3水平的比较
2.3青年痛风的危险因素分析 性别、年龄、BMI和吸烟史都不具有统计学意义(P>0.05);饮酒史(OR=3.384,95%CI:1.797~7.143)、高嘌呤饮食(OR=4.011,95%CI:1.439~10.058)、血清ET-1高水平(OR=2.996,95%CI:1.622~6.602)、血清ICAM-1高水平(OR=2.626,95%CI:1.865~7.127)、血清NALP3高水平(OR=2.342,95%CI:1.741~5.806)、血清ApoA1低水平(OR=2.757,95%CI:1.630~6.984)是青年痛风的危险因素(P<0.05),见表3。

表3 青年痛风的危险因素分析
2.4血清ET-1、ICAM-1、ApoA1、NALP3水平与青年痛风的相关性 根据Spearman相关性分析,将不同类型的青年痛风分别赋值:慢性痛风=1;急性痛风=2。血清ET-1、ICAM-1、NALP3水平与急性痛风相关(r=0.813、0.657、0.663,P<0.05);血清ApoA1水平与慢性痛风相关(r=-0.356,P<0.05)。
2.5血清ET-1、ICAM-1、ApoA1、NALP3对青年痛风的诊断价值 4个指标对青年痛风的诊断均有一定的准确度,4项指标联合检测的AUC>0.5,准确度比单个指标更高。ET-1、ICAM-1、ApoA1、NALP3单独检测的AUC比较,差异无统计学意义(P>0.05);4项指标联合检测的AUC高于4项指标单独检测,差异有统计学意义(P<0.05),见表4、图1。

表4 血清ET-1、ICAM-1、ApoA1、NALP3对青年痛风的诊断价值
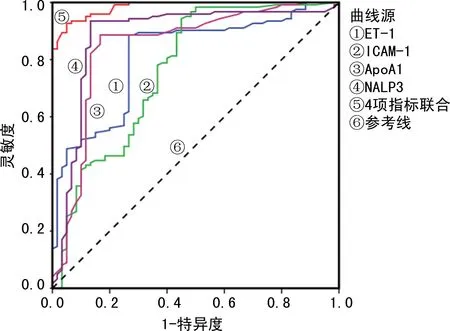
图1 血清ET-1、ICAM-1、ApoA1、NALP3诊断青年痛风的ROC曲线
3 讨 论
痛风的病理基础为高尿酸血症,而高尿酸血症是心血管疾病的危险因素[9]。痛风的主要诱发因素是饮酒及高嘌呤饮食。目前青年人群的生活、饮食方式发生了显著改变,高尿酸血症和痛风的发病年龄在逐渐年轻化。调查发现,高尿酸血症在男/女童中的发病率分别为8.8%、0.6%[10]。研究显示,北京某高校新生中男生与女生的高尿酸血症的患病率分别为34.47%和11.64%[11]。有研究监测了5 896例17~95岁普通人群的尿酸水平,发现25岁及以下男性的平均尿酸水平相对较高[12]。可见痛风不只是中老年人群的常见病,青年人群也受到了该疾病的影响。痛风若不及时诊治,可导致痛风性关节炎、肾脏疾病及心血管系统疾病,危害患者健康。因此,早发现、早诊断、早干预对于改善青年痛风患者临床症状、控制疾病发展、减少或预防并发症意义重大。
ApoA1是载脂蛋白A家族中的重要成员之一,主要在肝脏和小肠中合成,可参与脂蛋白代谢,还可影响脂代谢相关酶活性、炎性细胞之间的相互作用,降低炎性反应程度。ApoA1水平与高密度脂蛋白胆固醇(HDL-C)水平呈正相关。ApoA1低水平是心肌梗死的危险因素,而ApoA1高水平可能具有保护效应[13]。ApoA1在高尿酸血症患者血浆中呈低水平,其水平检测可为后期治疗提供参考[14]。本研究显示病例组血清ApoA1水平显著低于对照组,这与既往报道相符[15],提示ApoA1可能参与了青年痛风的发病过程;血清ApoA1低水平可提示青年痛风高风险,其原因可能为高尿酸水平引起血脂水平紊乱,导致血清ApoA1水平异常降低。NLRP3是炎性小体的组成部分,主要表达于单核细胞、巨噬细胞、T细胞等细胞的细胞质内,可调控促炎性细胞因子分泌,调节炎性反应和免疫细胞功能[16]。当炎性反应发生时NLRP3大量释放,其下游的促炎性细胞因子白细胞介素1β(IL-1β)水平会显著升高。NALP3与痛风的炎性反应密切相关[17],IL-1β受体拮抗剂可以改善慢性痛风患者的临床症状,预防降尿酸水平治疗过程中的痛风急性发作。本研究提示NALP3在青年痛风患者血清中呈高水平,NALP3高水平是青年痛风的危险因素,这与以往的研究一致[18]。分析其原因,单钠尿酸盐晶体作为一个“危险信号”被细胞内模式识别受体识别,导致NALP3炎性小体形成,促使IL-1β前体迅速转化为成熟的IL-1β,从而诱导青年痛风发生。
ET-1是一种强烈的缩血管肽,由血管内皮细胞(VEC)分泌,可促进细胞外基质合成及细胞增殖,参与缺血、缺氧等情况下VEC损伤过程。ICAM-1是介导人白细胞(WBC)与内皮细胞黏附的重要分子,能够稳定细胞之间的相互作用,促进内皮细胞的活化和迁移,促进炎症受损部位的组织粘连。ICAM-1在静息的VEC中呈低水平表达,而在受损的VEC中呈高水平表达,是血管内皮损伤的重要标志物,与VEC损伤关系密切。本研究显示,病例组血清ET-1、ICAM-1水平显著高于对照组,这与郭敏等[19]的研究结果一致,提示ET-1、ICAM-1与青年痛风的发生有关。进一步分析发现,血清ET-1、ICAM-1水平与青年痛风呈正相关,且血清ET-1、ICAM-1水平越高青年痛风发生风险越大。有研究报道,高尿酸血症是VEC受损的危险因素,当高尿酸血症发生时,机体局部氧化应激的发生可导致ET-1、ICAM-1水平升高,造成局部血管内皮的炎性损伤,引起NALP3水平上升,同时高尿酸水平引起血脂水平紊乱造成血清ApoA1水平下降[20],这可能解释了血清ET-1、ICAM-1、ApoA1、NALP3在青年痛风患者中水平异常的原因。进一步分析得出,血清ET-1、ICAM-1、ApoA1、NALP3联合用于青年痛风诊断的AUC为0.978,灵敏度为92.70%,特异度为95.00%,准确度为91.69%,提示血清ET-1、ICAM-1、ApoA1、NALP3联合用于青年痛风诊断具有较高的价值,若患者血清ET-1>77.82 pg/mL、血清ICAM-1>534.44 μg/L、血清ApoA1<0.87 mmol/L、血清NALP3>6.44 ng/mL,则提示青年痛风发生风险较大。此外,与痛风发生、发展有关的指标还有清蛋白、糖类抗原(CA)724、IL-1β、IL-6、IL-8等[21-23],这些指标参与青年痛风的具体机制有待进一步研究。
综上所述,血管内皮损伤生物标志物ET-1、ICAM-1联合ApoA1、NALP3诊断青年痛风的价值较高。
