血清sTREM-1、AGEs水平与连续肾脏替代疗法治疗脓毒症患者预后的相关性*
2021-09-16王日兴吕有凯
符 超,王日兴,吕有凯
海南医学院第二附属医院急诊科,海南海口 570311
连续肾脏替代疗法(CRRT)是增加脓毒症患者循环血量,改善缺血症状的主要手段,有效的CRRT可改善脓毒症休克患者的血流动力学指标,提高血液灌注量,降低血管内皮细胞损伤程度[1]。但研究表明,因脓毒症患者病情重,且伴炎性反应,可使毛细血管通透性增加,引发毛细血管渗漏,影响CRRT治疗效果[2]。既往研究证实,动脉血乳酸及氧合指数对经CRRT治疗患者的病情及预后均有较高的监测价值,但因患者基础状态不同,致使单纯监测某一时刻的乳酸及氧合指数并不能准确反映机体组织氧供、氧耗的动态变化[3]。此外,有研究发现,血清降钙素原(PCT)、白细胞介素-6(IL-6)、C反应蛋白(CRP)表达可用于预测脓毒症患者的病情及预后[4]。但需注意的是,该研究在分析时并未纳入其他关键性指标,因此血清PCT、IL-6、CRP对脓毒症患者经CRRT治疗后预后不佳的提示作用是否受其他因素影响还未知,其应用价值不明确。作为免疫球蛋白超家族中的一员,可溶性髓系细胞触发因子-1(sTREM-1)被证实对炎症反应的发生及发展具有重要作用[5]。此外,sTREM-1不仅能促进大量炎性因子释放,引发炎性反应,且对抗炎因子也有抑制作用,进而加剧炎性反应发展[6]。晚期糖基化终末产物(AGEs)属于大分子物质,主要由还原糖与蛋白质、脂质等多种物质反应生成,通常存在于组织、器官间的间隙中[7]。报道显示,AGEs可与修饰蛋白质结合后开启细胞内信号转导途径,进而引发组织、细胞间的氧化应激及炎性反应,进一步加剧组织、器官的受损程度,影响预后[8]。结合上述结论,推测血清sTREM-1、AGEs异常表达可能与脓毒症患者经CRRT治疗的预后有关,但尚未被证实,基于此,本研究主要分析血清sTREM-1、AGEs与经CRRT治疗的脓毒症患者预后的关系。
1 资料与方法
1.1一般资料 本次研究的实施获得本院伦理委员会审批通过。选取2018年1月至2020年1月本院重症监护室(ICU)接受CRRT治疗的69例脓毒症患者作为研究对象,男41例、女28例,年龄57.06(55.41,58.80)岁;原发病:呼吸系统疾病31例,消化系统疾病19例,神经系统疾病19例。患者及家属均知晓本研究内容并签署知情同意书。纳入标准:脓毒症符合《中国严重脓毒症/脓毒性休克治疗指南(2014)》[9]内相关诊断标准;(2)入住ICU时间≥24 h;(3)为首次入住ICU治疗;(4)符合CRRT治疗适应证;(5)接受CRRT治疗。排除标准:(1)治疗前合并心、肝、肾功能不全或衰竭的患者;(2)合并肿瘤、癌症的患者;(3)合并严重精神障碍影响研究配合度的患者;(4)合并其他严重感染性疾病的患者;(5)合并严重传染性疾病的患者;(6)合并免疫性疾病的患者。
1.2方法
1.2.1治疗方案 全部患者均接受CRRT治疗,依据患者的病情选择置管位置建立通路,输入稀释过的置换液,输入速度为4 L/h,血流250 mL/min,依据患者的身体情况调节超滤量,均治疗28 d。
1.2.2预后评估及分组 分别记录全部患者经CRRT治疗28 d后病死情况,将病死的患者纳入预后不良组,剩余患者纳入预后良好组。
1.2.3基线资料收集方法 采用自制基线资料调查量表调查两组的一般资料,Cronbach′s α系数为0.86,重测效度为0.88,包括性别、年龄、机械通气、原发病(呼吸系统疾病、消化系统疾病、神经系统疾病)、入住ICU时间、合并营养不良(以血清清蛋白<35 g/L为判断标准)、合并糖尿病(以空腹血糖≥7.0 mmol/L,和/或餐后2 h血糖≥11.1 mmol/L为判断标准)。
1.2.4实验室指标的检测 全部患者均于接受CRRT治疗当天早晨抽取空腹状态下5 mL外周肘静脉血,使用智能型高效离心机[贝克曼库尔特商贸(中国)有限公司,Avanti JXN-30/26型]离心,以3 000 r/min的速度离心10 min后取血清,存放于-80 ℃的环境中待检。(1)IL-6、CRP、基质金属蛋白酶-9(MMP-9)、sTREM-1、AGEs采用酶联免疫吸附试验(ELISA)检测,试剂盒由合肥莱尔生物科技有限公司提供;(2)PCT采用免疫比浊法检测,试剂盒由北京百普赛斯生物科技股份有限公司提供;(3)Toll样受体9(TLR9)采用放射免疫法测定,试剂盒由上海恒远生物科技有限公司提供。
2 结 果
2.1预后情况 全部69例脓毒症患者,经CRRT治疗28 d后,病死23例,病死率为33.33%(23/69)。
2.2预后不良组与预后良好组基线资料、实验室指标比较 两组年龄、性别、机械通气情况、原发病、入住ICU时间、合并营养不良、合并糖尿病及血清PCT、IL-6、CRP水平比较,差异无统计学意义(P>0.05);预后不良组血清TLR9、MMP-9、sTREM-1、AGEs水平高于预后良好组,差异均有统计学意义(P<0.05)。见表1。
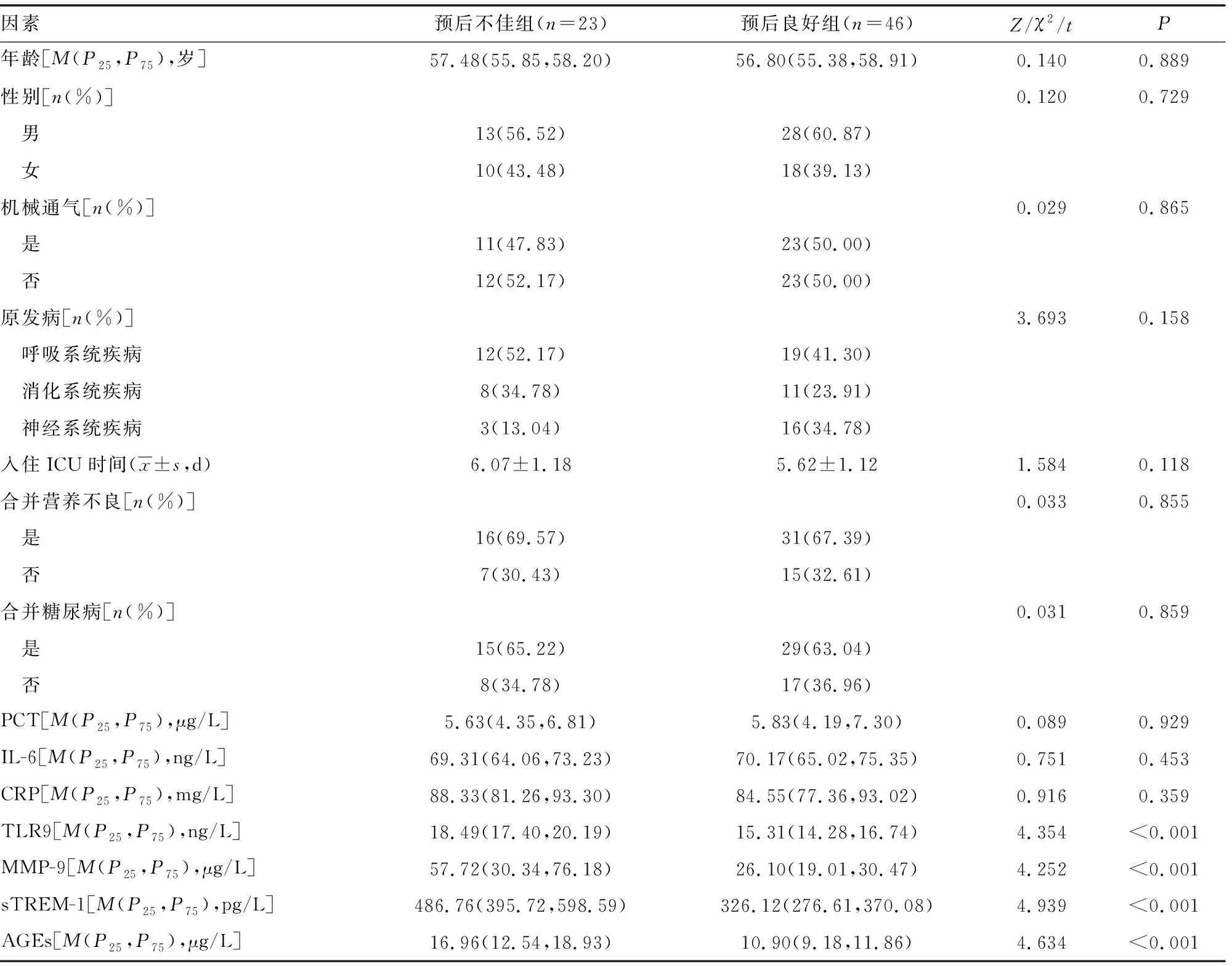
表1 预后不良组与预后良好组基线资料、实验室指标比较
2.3Logistic回归分析各指标与经CRRT治疗脓毒症患者预后的关系 将脓毒症患者治疗前血清TLR9、MMP-9、sTREM-1、AGEs水平分别作为协变量,预后情况作为因变量(1=预后不佳,0=预后良好),经二元回归分析后将2.2中全部资料纳入,建立多元Logistic回归模型,结果显示,治疗前血清TLR9、MMP-9、sTREM-1、AGEs与脓毒症患者经CRRT治疗后预后有关,各指标水平过高可能是脓毒症患者经CRRT治疗后预后不良的风险因子(OR>1,P<0.05)。见表2。
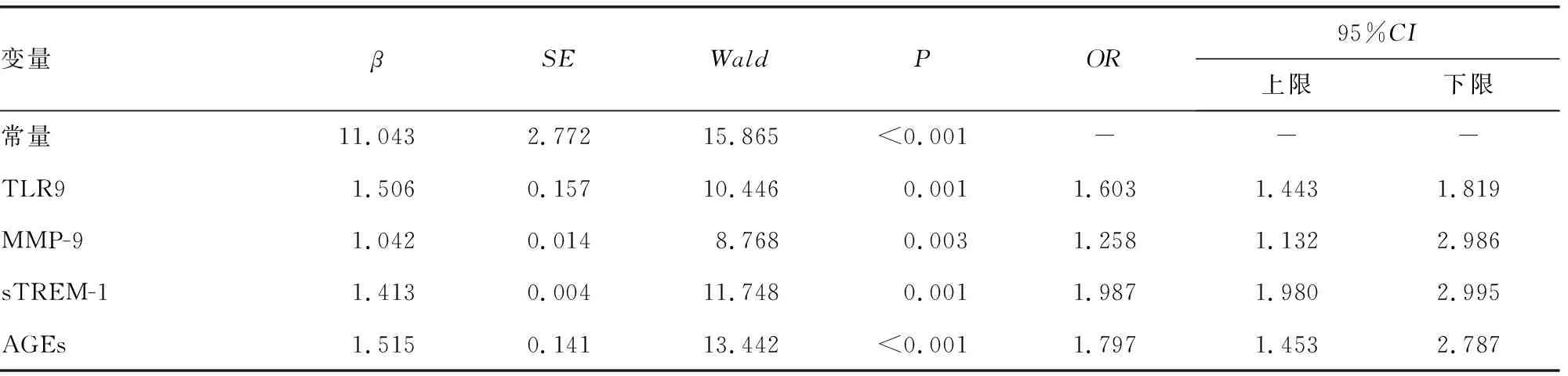
表2 Logistic回归分析各指标与经CRRT治疗的脓毒症患者预后不良的关系
2.4各指标预测脓毒症患者经CRRT治疗后预后不良风险的效能分析 将脓毒症患者治疗前血清TLR9、MMP-9、sTREM-1、AGEs水平分别作为检验变量,预后情况作为状态变量(1=预后不佳,0=预后良好),绘制ROC曲线,见图1。结果显示,治疗前血清TLR9、MMP-9、sTREM-1、AGEs分别预测脓毒症患者经CRRT治疗后预后不良风险的AUC均>0.80,预测价值均较理想。依据ROC曲线得出治疗前血清TLR9、MMP-9、sTREM-1、AGEs的cut-off值分别为17.262 ng/mL、31.030 μg/L、383.292 pg/mL、11.872 μg/L,在上述cut-off值条件下,计算特异度、灵敏度,见表3。
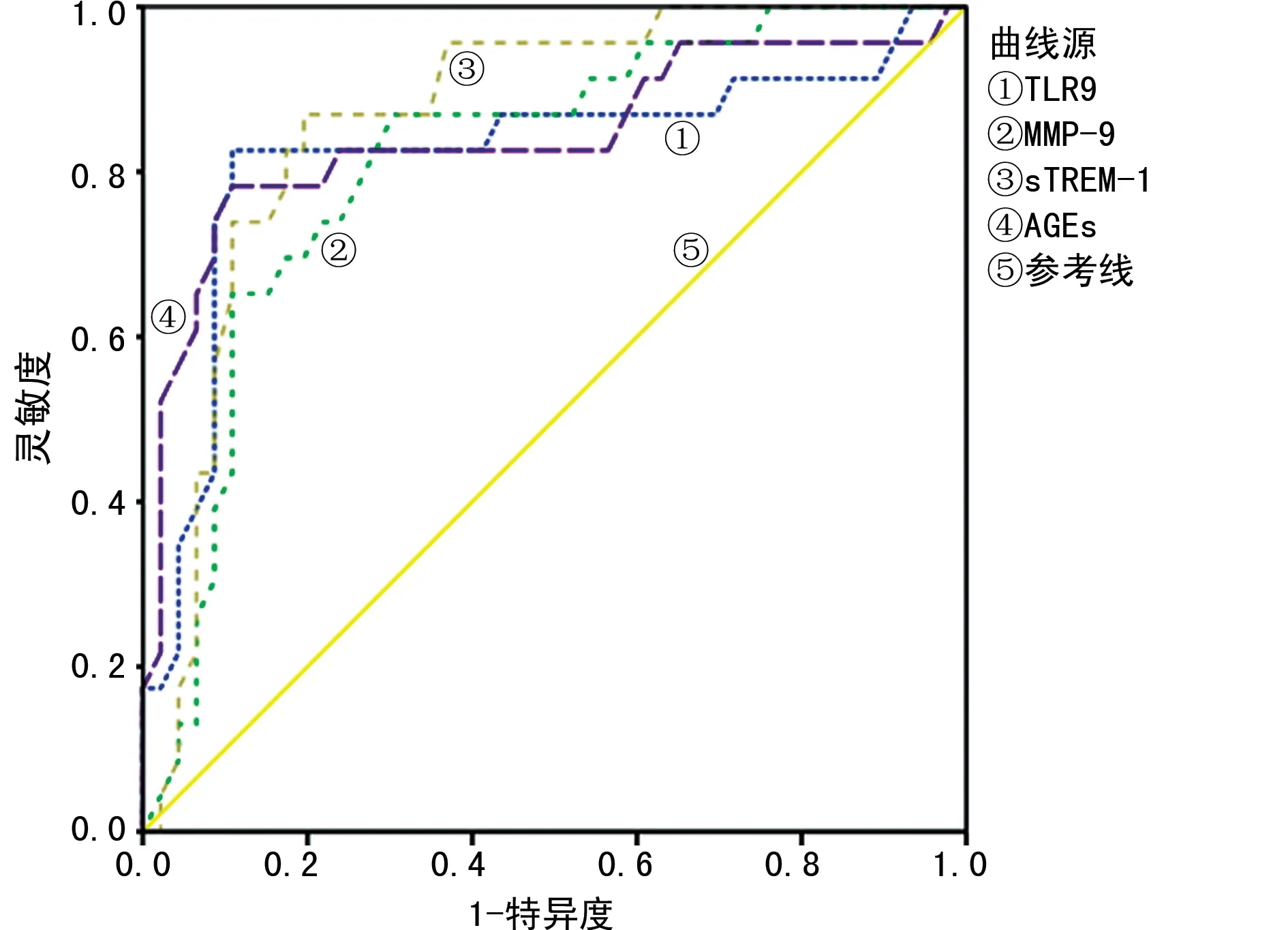
图1 各指标预测经CRRT治疗脓毒症患者预后不良的ROC曲线
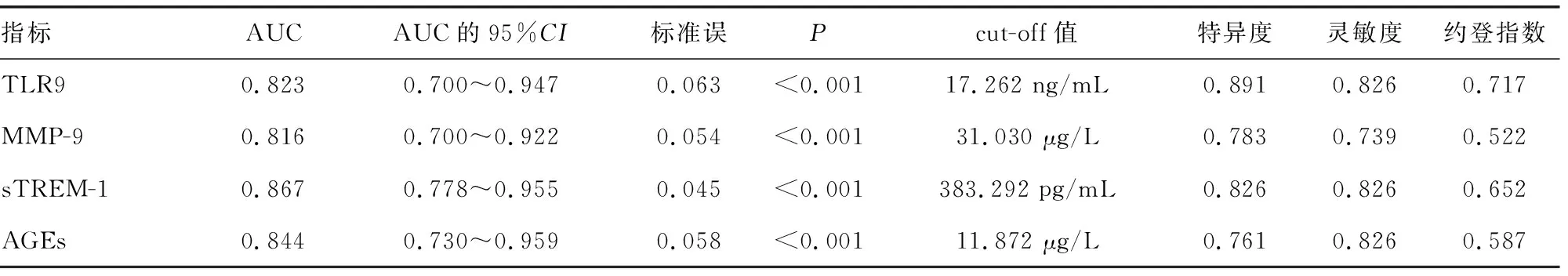
表3 各指标预测脓毒症患者经CRRT治疗后预后不良风险的效能分析结果
2.5脓毒症患者治疗前血清sTREM-1水平与AGEs水平的相关性分析 脓毒症患者治疗前血清sTREM-1水平与AGEs水平之间呈正相关(r=0.340,P=0.004),见图2。
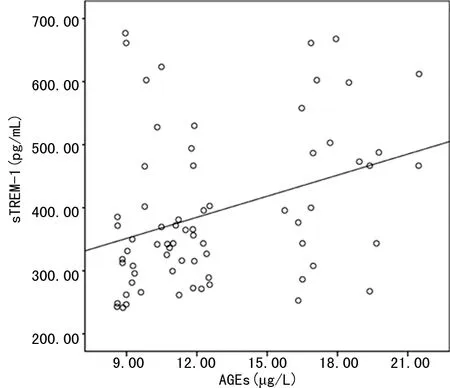
图2 脓毒症患者治疗前血清sTREM-1水平与AGEs水平相关性的散点图
3 讨 论
脓毒症患者因血液流入毛细血管导致交换功能受损,进而氧气供应及二氧化碳和废物的清除减少,极易引起一个或多个脏器衰竭,增加CRRT治疗后病死风险,是目前脓毒症患者治疗效果不佳的重要原因[10]。为提高脓毒症患者CRRT治疗的效果,需对患者治疗后预后不良风险进行早期预测,从而给出针对性建议,进行干预。
有研究报道,脓毒症患者经CRRT治疗后,有32.2%~54.1%的患者病死[11]。本研究的全部69例脓毒症患者中,经CRRT治疗28 d后,病死23例,病死率33.33%,在上述研究结果的范围内,表明经CRRT治疗的脓毒症患者有较高的预后不良风险。本研究着重分析了可能与脓毒症患者治疗后预后有关的因子。近年来,诸多研究指出,免疫受体、基质金属蛋白酶与多种生理、病理过程发生、发展有关,而TLR9、MMP-9分别是常见免疫受体、基质金属蛋白酶[12-13]。且二者在本研究中也被证实与脓毒症患者经CRRT治疗后预后有关。分析二者参与脓毒症患者经CRRT治疗后预后不良可能机制:TLR9激活后可使多种趋化因子及炎性物质的合成及释放,不仅加重了多种器官、组织的病变程度,且可导致多种生理活动发展异常,继而加重炎性反应程度,不利于预后[14]。MMP-9能对血管基底膜成分产生作用,与机体组织内膜屏障的损伤密切相关,一旦组织屏障功能受损,可使水、电解质外流的同时引发大量的蛋白质流失,进而导致水肿发生,从而导致白细胞被激活并通过受损的屏障进入组织、细胞,分泌多种炎性因子,进一步加重炎性反应,最终损坏大量器官功能,增加病死风险[15]。但需要注意的是,TLR9、MMP-9检测结果的准确性容易受到患者患病时间、炎性反应发生程度等多种因素影响,在应用价值方面有一定局限。此外,本研究还验证了血清PCT、IL-6、CRP水平与脓毒症患者经CRRT治疗后预后不良风险的关系,结果显示,血清PCT、IL-6、CRP水平与脓毒症患者经CRRT治疗后预后无关。这可能是由于血清sTREM-1、AGEs过表达加重机体内炎性反应程度,继而影响血清PCT、IL-6、CRP表达[16]。
sTREM-1主要由激活的吞噬细胞产生,常表达于中性粒细胞、巨噬细胞表面,已被研究证实能激发、加剧体内炎性反应程度[17]。AGEs作为细胞表面分子的免疫球蛋白家族中的一种,可与高迁移率族蛋白B结合后激活促炎信号通路,进一步加重体内炎性反应程度,不利于预后[18]。本研究结果显示,预后不良组血清sTREM-1、AGEs水平高于预后良好组,初步推测血清sTREM-1、AGEs异常表达可能参与了脓毒症患者经CRRT治疗后预后不良的发生。且以上推测均在进一步的回归分析中被证实。分析血清sTREM-1、AGEs异常表达参与患者预后不良的可能机制:sTREM-1与TLRs具有协同作用,促使肿瘤坏死因子-α、IL-1β等多种促炎因子释放,抑制抗炎因子IL-10生成,加剧体内炎性反应程度,增加各组织、器官的受损程度,进一步增加治疗难度,影响治疗效果,继而提高病死风险,增加预后不良风险[19]。同时,sTREM-1在加剧炎性反应的同时,又可上调体内髓系细胞表达触发受体-1(TREM-1)水平,产生正向反馈机制,进一步加剧炎性反应程度,继而增加预后风险[20]。AGEs可启动细胞内多种信号转导机制,进而引发多种生物学效应,增加细胞功能紊乱风险,诱发甚至加剧体内炎症、氧化应激等多种反应,影响预后[21]。不仅如此,AGEs能够激活细胞外信号调节激酶1/2(ERK1/2),进而使体内主动脉血管平滑肌细胞大量增殖,增加动脉粥样硬化发生风险,进一步加重患者病情,继而增加病死风险,导致不良预后发生[22]。
最后本研究对各指标预测脓毒症患者经CRRT治疗后预后风险绘制了ROC曲线,结果显示,治疗前血清sTREM-1、AGEs分别预测脓毒症患者经CRRT治疗后预后不良风险的AUC>0.80,且以治疗前血清sTREM-1、AGEs的cut-off值分别为383.292 pg/mL、11.872 μg/L时,预测价值最佳。上述结果证实,治疗前血清sTREM-1、AGEs不仅是脓毒症患者经CRRT治疗后预后不良的风险因子,且二者可作为患者治疗前预测预后不良风险的关键标志物。上述结果也表明,未来临床若早期监测脓毒症患者治疗前血清sTREM-1、AGEs表达异常,可在治疗原发病的同时实施合理干预,如指导患者低糖、低脂饮食,给予患者抗菌药物治疗等,以降低患者的血清sTREM-1、AGEs水平,可能对改善患者的预后有积极意义。此外,本研究还对脓毒症患者治疗前血清sTREM-1水平与AGEs水平间的相关性进行分析,结果显示,二者间呈正相关,说明脓毒症患者治疗前血清sTREM-1水平与AGEs水平之间可能存在一定联系,二者可能相互影响、相互作用,共同参与了脓毒症患者经CRRT治疗的预后,但尚不能根据该研究结果推断上述指标之在疾病中的具体关系,加之现有的相关研究也较少,仍需要在未来增加样本量、延长观察时间并查阅大量文献加以验证。
综上所述,血清sTREM-1、AGEs水平与脓毒症患者经CRRT治疗后预后有关,可能是患者预后不良的风险因子,对预测患者经CRRT治疗后预后风险有一定价值。
