miR-3648对胃癌细胞增殖和转移的影响及其临床意义*
2021-09-16刘益峰吴付兵吴佳伦陈国强
刘益峰,吴付兵,王 星△,吴佳伦,陈国强
1.中国人民解放军联勤保障部队第九〇〇医院莆田医疗区普外科,福建莆田 351100;2.南京医科大学附属逸夫医院肿瘤科,江苏南京 210000
胃癌是全世界最常见的恶性肿瘤之一,其发病率高,缺乏有效的治疗手段[1]。胃癌通常起源于胃壁,其早期症状不明显,往往被认为是常见的胃疾病,这对早期胃癌的诊断造成影响[2]。尽管近些年来在手术技术和分子靶向治疗等方面获得了不错的进展,但胃癌患者的总生存率仍不尽如人意[3]。因此,探讨胃癌发生、发展过程中的分子调控机制,寻找影响胃癌发生、发展的靶点,对提高胃癌的早期诊断率以及改善预后均有重要意义。大量研究证实微小RNAs(miRNAs)与肿瘤的发生和发展息息相关,被认为发挥了癌基因或抑癌基因的作用[4]。越来越多的人关注了miRNAs在胃癌中的作用,有研究表明miRNAs可能是胃癌诊断和治疗监测的潜在生物标志物[5-6]。miR-3648是人类特有的一种miRNA,在类人猿和其他哺乳动物中不存在同源体[7]。有研究表明miR-3648在前列腺癌[8]和膀胱癌[9]中对癌细胞的增殖、侵袭和转移发挥重要的调控作用。然而,miR-3648在胃癌中的表达和诊断价值,以及在胃癌细胞中的生物学功能有较多未知,本课题组对此进行了研究,旨在为胃癌临床诊断和治疗提供参考。
1 资料与方法
1.1一般资料 选取2018年6月至2020年3月在中国人民解放军联勤保障部队第九〇〇医院莆田医疗区就诊并经病理学确诊为原发性胃癌的患者100例,临床资料见表1。患者在施行胃癌切除术时,收集患者胃癌组织及癌旁正常组织标本。所有参与者无其他肿瘤以及肝肾功能不全,在行胃癌切除术前均未接受免疫治疗、放疗或化疗。记录患者的临床病理特征,包括年龄、性别、分化程度、肿瘤大小、淋巴结转移情况、TNM分期、血清癌胚抗原(CEA)水平、血清糖类抗原(CA)19-9水平、血清CA724水平。检查结果均经两位以上的病理医师或检验医师确认。所有参与研究者均知情同意,并签署知情同意书。手术切下后的组织标本在做好标记后立即置于液氮中保存,以备用于后续的RNA抽提。
1.2方法
1.2.1OncomiR在线工具分析胃癌中miR-3648的表达 应用microRNA在线工具OncomiR(http://www.oncomir.org)中的TCGA数据库分析miR-3648在胃癌患者和健康者中表达差异。
1.2.2实时荧光定量反转录PCR(qRT-PCR)检测miR-3648的表达 用Trizol试剂(Invitrogen公司)从组织或细胞中提取总的RNA,采用Mir-XTMmiRNA First-Stand Synthesis Kit(TaKaRa公司)将RNA反转录成cDNA。采用ABI 7500定量PCR仪和SYBR premix Ex TaqTMⅡ Kit(TaKaRa公司)进行PCR反应,定量检测组织或细胞中miR-3648的表达。以U6基因当作内部参照,miR-3648在组织或细胞中的相对表达水平采用2-ΔΔCt方法表示。
1.2.3细胞培养和转染 采用含有10%胎牛血清(FBS)、1%青-链霉素的DMEM培养液(Gibco)培养人胃癌细胞MGC-803和BGC-823以及人胃黏膜正常细胞株GES-1,细胞置于37 ℃、5%CO2细胞培养箱中培养。每隔3天更换1次培养液。取指数生长的细胞用于后续实验。miR-3648抑制物(inhibitor)和阴性对照(NC inhibitor)序列(广州锐博生物)转染MGC-803和BGC-823细胞的步骤和方法参照Lipofectamine 2000转染试剂(Invitrogen公司)说明书。细胞分为空白(Blank)组、转染NC inhibitor的NC inhibitor组和转染miR-3648 inhibitor的miR-3648 inhibitor组。细胞转染24 h后,采用qRT-PCR检测miR-3648的相对表达水平,从而验证转染的效率。
1.2.4CCK-8法检测胃癌细胞增殖 将转染后的各组细胞按4 000个细胞/孔(加入的细胞悬液为100 μL)接种于96孔细胞培养板中,将细胞置于常规条件中孵育48 h,随后每孔加 10 μL CCK-8试剂(上海碧云天)并轻轻混匀,37 ℃避光孵育2 h。用酶标读数仪(Bio-Rad)检测各孔细胞在450 nm处的吸光度值,计算各组细胞的增殖率。
1.2.5Transwell实验检测胃癌细胞迁移和侵袭 细胞迁移实验:将转染后各组细胞按每孔4 000个细胞(加入100 μL无血清培养基细胞悬液)接种于Transwell小室上室,小室下室加入800 μL含10% FBS的血清培养基。细胞置于37 ℃、5% CO2细胞培养箱中培养48 h后,将Tanswell上室取出,小室膜下面的细胞用4%多聚甲醛溶液进行固定,然后用0.1%结晶紫对细胞进行染色,上室内膜表面的细胞用湿棉签小心擦掉。显微镜(Olympus)下对染色细胞进行拍照并计数。检测细胞侵袭时,预先铺上一层Matrige基质胶(BD)在Transwell小室的内部膜上,其余同细胞迁移实验。Matrigel基质胶配制和处理参考说明书进行。
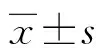
2 结 果
2.1miR-3648在胃癌中的表达分析 在线工具OncomiR分析显示:与健康人群(中位数为0.04)比较,胃癌患者的miR-3648相对表达水平(中位数为0.54)显著升高(P<0.05)。qRT-PCR检测收集的100例胃癌组织和癌旁组织标本显示:miR-3648在胃癌组织中的相对表达水平[4.94(2.68~7.15)]显著高于癌旁正常组织中的相对表达水平[1.66(1.09~2.31)],差异有统计学意义(P<0.05)。
2.2miR-3648的相对表达水平与胃癌患者临床病理特征的关系 不同年龄、性别和分化程度的胃癌患者间,胃癌组织中miR-3648的相对表达水平比较,差异无统计学意义(P>0.05);但不同肿瘤最大径、淋巴结转移情况、TNM分期、CEA水平、CA19-9水平和CA724水平的胃癌患者间miR-3648的相对表达水平比较,差异有统计学意义(P<0.05),见表1。
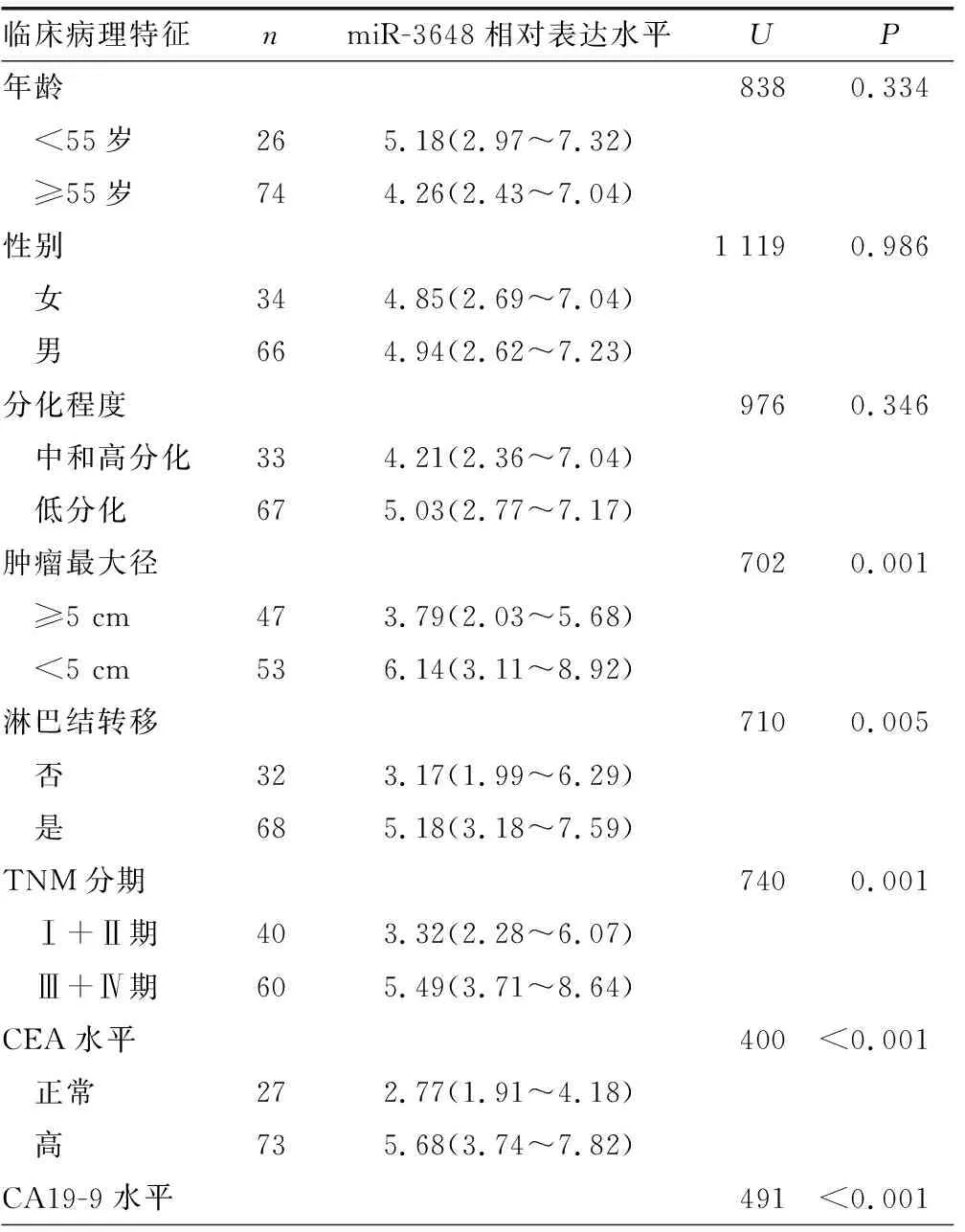
表1 miR-3648表达和胃癌患者临床病理特征的关系[ n=100,M(P25~P75)]

续表1 miR-3648表达和胃癌患者临床病理特征的关系[ n=100,M(P25~P75)]
2.3miR-3648相对表达水平对胃癌的诊断价值 以胃组织中miR-3648相对表达水平作为检测指标,绘制诊断胃癌的ROC曲线,见图1。曲线下面积为0.897(95%CI:0.853~0.940)。胃组织中miR-3648的相对表达水平诊断胃癌的最佳截断值为3.02,此时的灵敏度为70.0%,特异度为100.0%。
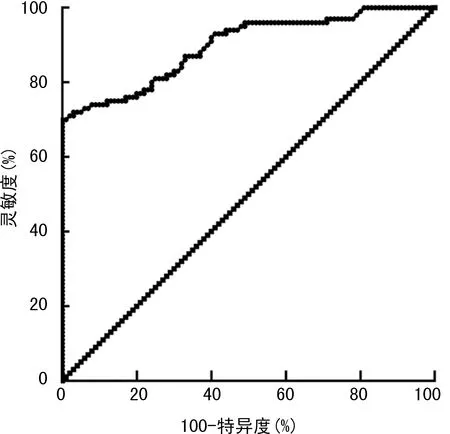
图1 ROC曲线分析miR-3648对胃癌的诊断价值
2.4miR-3648在胃癌细胞中表达 与GES-1细胞(1.000±0.035)比较,MGC-803和BGC-823细胞中的miR-3648相对表达水平(分别为3.300±0.146、4.430±0.163)均显著升高(t=26.50、35.65,P<0.05)。
2.5转染miR-3648 inhibitor对胃癌细胞中miR-3648表达的影响 MGC-803和BGC-823细胞转染24 h后,qRT-PCR检测显示:Blank组、NC inhibitor组和miR-3648 inhibitor组之间miR-3648相对表达水平比较,差异有统计学意义(P<0.05),见表2。与转染NC inhibitor比较,转染miR-3648 inhibitor后MGC-803和BGC-823细胞中miR-3648的相对表达水平均显著下调(P<0.05),见表2。
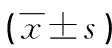
表2 转染miR-3648 inhibitor对胃癌细胞miR-3648相对表达水平的影响
2.6抑制miR-3648表达对胃癌细胞增殖的影响 MGC-803和BGC-823细胞经转染24 h后,CCK-8法检测显示:Blank组、NC inhibitor组和miR-3648 inhibitor组之间增殖率比较,差异有统计学意义(P<0.05),见表3。与转染NC inhibitor后的细胞增殖率比较,转染miR-3648 inhibitor后胃癌MGC-803和BGC-823细胞增殖率显著降低(均P<0.05),细胞生长明显受到抑制,见表3。
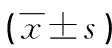
表3 转染miR-3648 inhibitor对胃癌细胞增殖率的影响
2.7抑制miR-3648表达对胃癌细胞迁移和侵袭的影响 MGC-803和BGC-823细胞经转染24 h后,Transwell实验显示:Blank组、NC inhibitor组和miR-3648 inhibitor组间迁移细胞数和侵袭细胞数比较,差异均有统计学意义(P<0.05),见图2、表4。与转染NC inhibitor的细胞比较,转染miR-3648 inhibitor的MGC-803和BGC-823细胞每视野的迁移细胞数和侵袭细胞数均显著减少(P<0.05),见表4。
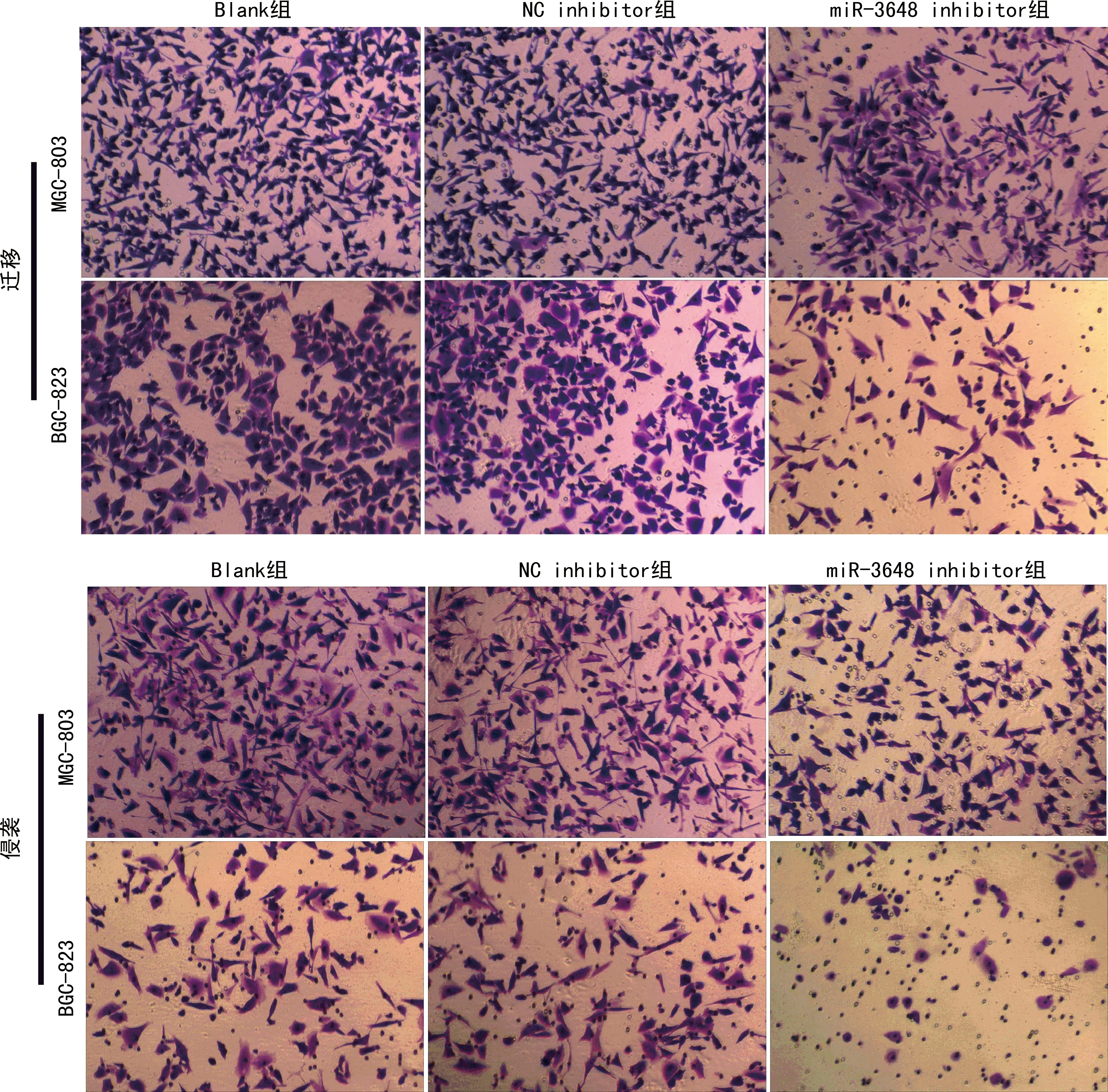
图2 miR-3648抑制对胃癌细胞迁移和侵袭的影响(结晶紫染色,×200)
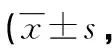
表4 miR-3648抑制对胃癌细胞迁移和侵袭的影响个/视野)
3 讨 论
胃癌是一种多因素疾病,幽门螺杆菌感染、遗传以及饮酒、吸烟等均可能导致胃癌的发生[10-11]。有研究证实miRNAs在细胞生长、分化、转移等过程中扮演着重要的角色[12]。异常表达的miRNAs影响肿瘤的增殖和侵袭[13]。因此,识别参与肿瘤发生和转移的特异性miRNAs可以为肿瘤的诊断和治疗提供线索。miR-3648在多种肿瘤中异常表达并发挥重要的调控作用。如SUN等[9]研究发现miR-3648在人膀胱癌组织中的表达水平明显高于癌旁非肿瘤组织。XING等[8]研究发现miR-3648在前列腺癌组织中高表达。本研究发现,miR-3648在胃癌组织和胃癌细胞中的表达水平显著上调,提示miR-3648在胃癌中可能发挥了癌基因的功能。本研究随后发现胃癌患者的癌组织标本中miR-3648的相对表达水平与肿瘤最大径、淋巴结转移、TNM分期、CEA水平、CA19-9水平和CA724水平有关,表明miR-3648的异常表达与胃癌的发展以及胃癌现有的标志物水平有关。此外,当胃组织中miR-3648的相对表达水平为3.02时,其诊断的灵敏度为70.0%,特异度为100.0%,提示miR-3648的相对表达水平对胃癌诊断具有一定的价值。
异常表达的miR-3648在细胞增殖和转移中发挥重要的调控作用。RASHID等[14]研究发现过表达miR-3648能下调抑癌基因APC2表达从而促进细胞增殖。MIN等[15]研究发现miR-3648的过表达对骨髓间充质干细胞的成骨分化起促进作用。在人膀胱癌中,抑制miR-3648的表达能够抑制癌细胞的迁移和侵袭[9]。过表达miR-3648促进前列腺癌细胞增殖[8]。本研究表明抑制miR-3648表达能够显著抑制胃癌细胞增殖、迁移和侵袭,这与其在膀胱癌和前列腺癌中的作用相似,证实了miR-3648在胃癌细胞中发挥癌基因的作用。
然而,本研究具有一定局限性。首先,miR-3648在胃癌中调控的靶基因仍需进一步探讨;其次,miR-3648在体内对肿瘤增殖和转移的影响还不清楚;最后,胃组织中miR-3648的相对表达水平用于胃癌诊断的灵敏度为70.0%,特异度为100.0%,灵敏度较低,因此需要进一步研究miR-3648在胃癌患者血液中的表达以及其在胃癌中的诊断价值,或联合现有胃癌标志物构建联合诊断模型来提高诊断灵敏度。
综上所述,当胃组织中miR-3648相对表达水平为3.02时,其诊断的灵敏度为70.0%,特异度为100.0%。抑制miR-3648表达能够抑制胃癌细胞增殖、迁移和侵袭,因此miR-3648有望成为胃癌诊断和治疗监测的分子标志物。
