3种百香果果实糖含量与糖代谢相关基因表达的分析
2021-09-16王宇王红林方晓彤穆波曾帆马玉华周俊良
王宇,王红林,方晓彤,穆波,曾帆,马玉华,周俊良
(贵州省农业科学院果树科学研究所,贵州 贵阳 550005)
百香果(Passiflora edulia Sims),学名西番莲,别名鸡蛋果、巴西果[1],多数栽培种为紫果、黄果以及紫果与黄果杂交种。因其具有多种水果香气,风味浓郁且果实多汁,又被称为“果汁之王”[2]。贵州省地区自然气候条件优越,在南北盘江、红水河、都柳江流域等低热河谷地区,适合百香果产业发展。百香果自2016年引入贵州种植后[3],种植面积已经从最初的零星种植快速发展至15万亩,为吸引消费者、满足产业发展需求、提升市场竞争力,选育风味足、口感佳的百香果品种将是今后百香果育种的重要方向。
消费者普遍认为甜度和香味是水果最重要的品质[4]。水果中存在多种物质可以对果实风味及品质产生影响,已经报道的有糖、酸、类胡萝卜素及芳香类物质等[5-8]。在柑橘、番石榴、荔枝等水果中,糖种类及含量差异直接影响果实甜度及风味[9-11]。糖类物质可占植物干重的85%~90%,糖含量分析是研究植物糖代谢的基础[12]。作为贵州大力发展的热带水果,目前关于百香果糖组分及含量虽有部分研究,但不够全面;特别是贵州地区主要栽培的3个百香果品种,尚未针对其开展系统的糖组分及含量与糖代谢相关基因表达差异研究。
本研究以贵州地区3个不同品种百香果为试材,通过气相色谱-质谱分析(gas chromatography-mass spectrometry,GC-MS)对成熟期果实糖种类及含量进行检测,结合转录组测序技术挖掘影响百香果果实糖含量变化的关键调控基因,并对其进行表达量分析。从生理指标和分子水平探讨影响百香果糖含量变化的机制,以期为糖组分差异对果实品质及风味影响提供理论依据。
1 材料与方法
1.1 材料与试剂
试验材料取自贵州省果树科学研究所镇宁热带亚热带果树科研示范基地(以下简称基地),以基地栽培种植的紫香百香果、黄金百香果、满天星百香果为试验材料,每个品种分别选取3株进行采样,果汁分别混匀后液氮冻存备用。
RNAiso Plus RNA提取试剂盒、Fruit-mate for RNA purification RNA多糖去除剂、5×Reversse Transcriptase M-MLV-Buffe、M-MLV Reversse Transcriptase M-MLV Rnase、Reconbinent RNase Inhibitor、dNTP Mixture:宝生物工程(大连)有限公司;SYBR Green PCR Master Mix核酸染色剂、冰醋酸、琼脂糖(均为分析纯):北京索莱宝科技有限公司;异丙醇(分析纯)、75%乙醇(分析纯)、双(三甲基硅基)三氟乙酰胺[bis(trimethylsilyl)trifluoroacetamide,BSTFA](色谱纯):天津市科密欧化学试剂有限公司;氯仿(分析纯):天津市外环化工有限公司。
1.2 仪器与设备
SynergyH酶标仪:美国BioTeK公司;H1-16KR型高速冷冻离心机:湖南可成仪器设备有限公司;HH-6电热恒温水浴锅:金坛区西城新瑞仪器厂;ST3100 pH计:北京中创先锋科技有限公司;Eppendorf移液枪:德国Eppendorf公司;FA2004精密天平:天津天马衡基仪器有限公司;DW-HL398S超低温冷冻储存冰箱:上海始恒仪器设备有限公司;Mill-Q超纯水制备仪:美国Millipore公司;DGL-75B高压灭菌锅:江苏登冠医疗器械有限公司;8401-1高温烘箱:上海喆肽机械制造有限公司;GZX-9146MBE鼓风干燥箱:上海博迅医疗生物仪器股份有限公司;IMS-70碎冰机:河南天驰仪器设备有限公司;SW-CJ-1D超净工作台:苏州天启动净化科技有限公司;CR21GII型超高速冷冻离心机:日本Hitachi公司;ASP-3700微量核酸检测分光光度计:美国ACTGene公司;荧光定量PCR仪:美国Bio-Rad公司;iCycler质谱仪、NanoLC-1DTM液相色谱仪:美国AB SCIEX公司;ClarityTM Western ECL Substrate电泳凝胶成像系统:美国Bio-Rad公司。
1.3 方法
1.3.1 糖组分及含量测定
利用气相色谱串联质谱(GC-MS)法对3个品种百香果的糖组分及含量进行测定。称取20 mg经真空冷冻干燥的样品粉末,加入500 μL甲醇∶异丙醇∶水(3∶3∶2,体积比)提取液,涡旋 3 min,冰水中超声30 min;4℃、14 000 r/min离心 3 min,吸取 50 μL 上清液,加入20 μL核糖醇内标,氮吹并冻干机冻干;加入100 μL 甲氧铵盐吡啶(15 mg/mL),37℃孵育 2 h,随后加入BSTFA 100 μL,37℃孵育30 min,得到衍生化溶液,正己烷稀释,保存于棕色进样瓶中,用于GC-MS分析。
色谱质谱采集条件:进样量 3 μL;分流比 3∶1;载气为He气;色谱柱为DB-5MS(30 m×0.25 mm×0.25 μm);柱流速为1 mL/min;柱箱升温程序为170℃保持2 min,10℃/min升至240℃,5℃/min升至280℃,25℃/min升至310℃,310℃保持4 min;传输线温度240℃;离子源温度230℃;四极杆温度150℃;电离电压70 eV;扫描模式,选择性离子检测(selected ion monitor,SIM);溶剂延迟 3.5 min。
1.3.2 基因表达分析
利用RNAiso Plus RNA提取试剂盒对果实总核糖核酸(ribonucleic acid,RNA)进行提取,通过琼脂糖凝胶电泳验证聚合酶链式反应(polymerase chain reaction,PCR)产物,并纯化回收,使用Illumina Hiseq 2000基因测序仪进行转录组测序。
1.3.3 实时荧光定量多聚核苷酸链式反应技术(realtime quantitative polymerase chain reaction,RT-qPCR)检测
根据转录组测序结果,筛选出与百香果糖代谢相关的基因:磷酸果糖激酶(phospho fructose kinase,PFK)、磷酸烯醇丙酮酸羧化激酶(phosphoenolpyruvate carboxylation kinase,PEPCK)、丙酮酸脱羧酶(pyruvate decarboxylase,PDC),以翻译起始因子为内参基因,利用Primer Express 5.0软件设计用于基因表达定量分析的引物(生工生物工程(上海)股份有限公司合成),引物信息见表1。

表1 RT-qPCR引物序列Table 1 Primer sequences used in RT-qPCR
以试验得到的百香果互补脱氧核糖核酸(complementary DNA,cDNA)为模板,采用荧光定量PCR仪对百香果糖代谢基因进行实时定量分析,同时做3个生物学重复。最后建立扩增动力学曲线和熔解曲线分析,反应体系见表2。反应设置程序:95℃预变性3 min;95℃变性 15 s,60℃退火 30 s,72℃延伸 15 s,35个循环。重复测定3次。

表2 RT-qPCR反应体系Table 2 RT-qPCR reaction system
PCR结束后自动分析熔解曲线,最后根据熔解曲线获得的循环阈值(cyle threshold,CT),通过 2-ΔΔCT的方法计算各基因的相对表达量。
1.4 糖含量计算
利用Agilent MassHunter软件进行数据处理并完成糖含量定性定量分析。按下列公式计算实际样本中糖含量。
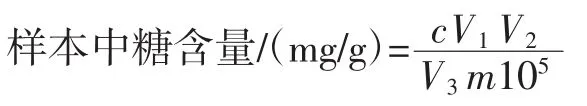
式中:c为样本中积分峰面积比值代入标准曲线得到的浓度值,μg/mL;V1为定容所用溶液的体积,μL;V2为样品提取过程中加入样本提取液的体积,μL;V3为样品提取过程中收集上清液的体积,μL;m为称取的样本质量,g。
1.5 数据处理
采用Microsoft Office Excel 2010进行数据整理与分析。
2 结果与分析
2.1 定性定量分析
采用Agilent MassHunter软件进行定性定量分析,结果显示13种糖质谱信息均获得采集。
2.2 质量控制分析
通过对同一质量控制(quality control,QC)样本进行分析,根据保留时间和峰强度确定此项目检测期间仪器稳定,结果真实可信。
2.3 标准曲线分析
线性方程见表3。

表3 线性方程Table 3 Linear equation
2.4 糖含量分析
将各个糖积分峰面积代入表3中的标准曲线方程计算,进一步带入1.4中糖含量公式计算后,得到3个不同品种百香果果实糖绝对含量数据见表4。

表4 百香果果实糖含量Table 4 Sugar content of passion fruit mg/g
如表4所示,3个不同品种百香果糖含量最高的是葡萄糖,其次是D-果糖,蔗糖含量居第3位,其余糖组分含量较低,且木糖醇含量在检测限下。
2.5 关键基因表达量分析
磷酸果糖激酶的活性可以兼备快速调节与迟缓调节,催化物质及能量代谢过程中酶的活性,协调、调控糖酵解代谢途径[13];丙酮酸脱羧酶可作用于丙酮酸形成CO2和乙醛;磷酸烯醇丙酮酸羧化激酶在三羧酸循环中催化逆反应,以回补草酰乙酸。选取测序得到的翻译起始因子作为内参基因,对紫香、黄金、满天星中3个糖代谢相关基因(PFK、PEPCK、PDC)进行表达分析,其表达情况见图1~图3。

图1 紫香与满天星糖代谢相关基因表达分析Fig.1 Analysis of gene expression related to glucose metabolism of sugar level in Purple and Mantianxing

图2 黄金与满天星糖代谢相关基因表达分析Fig.2 Analysis of gene expression related to glucose metabolism of sugar level in Gold and Mantianxing

图3 紫香与黄金糖代谢相关基因表达分析Fig.3 Analysis of gene expression related to glucose metabolism of sugar level in Purple and Gold
图1结果显示,与满天星相比,紫香的磷酸果糖激酶(PFK)和丙酮酸脱羧酶(PDC)基因表达量差异不显著,而磷酸烯醇丙酮酸羧化激酶(PEPCK)基因表达量差异显著,为上调表达。于丽等[14]研究表明,磷酸烯醇丙酮酸羧化激酶可催化由磷酸烯醇式丙酮酸到草酰乙酸的反应,且催化反应伴有腺嘌呤核苷三磷酸的生成,其更有利于有机体生长和产酸。因此,紫香的产酸能力大于满天星,这也是紫香口感偏酸的原因。
图2结果显示,与满天星相比,黄金的磷酸果糖激酶(PFK)表达量差异不显著;丙酮酸脱羧酶(PDC)基因表达量差异极显著,为下调表达,而磷酸烯酶丙酮酸羟化激酶(PEPCK)基因表达量差异显著,为上调表达。丙酮酸脱羧酶在代谢中对乙醇的含量有抑制作用,从而增加糖含量[16]。因此黄金的糖含量大于满天星。
图3结果显示,与黄金相比,紫香的磷酸果糖激酶(PFK)和磷酸烯醇丙酮酸羟化激酶(PEPCK)两个基因表达量差异不显著,而丙酮酸脱羧酶(PDC)基因表达量差异显著,为上调表达。李盼盼[17]研究表明,丙酮酸脱羧酶的表达与“布鲁诺猕猴桃”贮藏期的乙醇含量有关,从而影响猕猴桃糖含量的积累,故紫香糖含量小于黄金。
3 讨论与结论
可溶性糖不仅对果实的甜味品质起到决定作用[18],还可作为生命活动的能源物质与调控代谢的信号物质[19-20]。作为生命体的基本组成部分和重要能量来源,糖还参与了细胞识别、代谢调节、形态发育、免疫保护、衰老癌变等众多的生命活动,糖分析是研究其在生命体转化和生理作用的前提和重要手段。
检测结果表明,在常见的13种可溶性糖中,以葡萄糖含量最高,果糖次之,蔗糖居第3位。由于不同品种间,糖代谢的调控机制存在显著差异,因此决定了果实风味的糖含量也存在明显差异[13]。经检测,黄金百香果在葡萄糖、D-果糖、蔗糖的含量均明显高于紫香和满天星,而紫香的蔗糖含量明显高于满天星,但在葡萄糖与D-果糖含量上略显不足。
通过色谱串联质谱法测定3个品种百香果的糖含量,D-果糖与葡萄糖含量由高到低依次为黄金、满天星、紫香。通过RT-qPCR分析发现,编码磷酸烯醇丙酮酸羧化激酶与丙酮酸脱羧酶的两个基因在不同品种间表达量存在显著差异,且与GC-MS法测定3个品种百香果的糖含量变化趋势一致,因此推测这两个基因在百香果糖代谢中起重要作用。
