TRIM28在食管鳞状细胞癌中的表达及放疗抵抗初探
2021-09-16盛蕾童铸廷
盛蕾,童铸廷
(安徽医科大学第一附属医院肿瘤放疗科,安徽 合肥 230032)
0 引言
食管癌的发病率在全球恶性肿瘤中排名第八,尤其以发展中国家常见。其死亡率在全球恶性肿瘤中排名第六,2018年约有500000人死于食管癌[1]。我国的食管癌5年总生存率约为20%左右[2]。在我国,食管癌的主要病理类型为鳞状细胞癌,约占食管癌患者总数的90%[3]。大多数食管癌患者在就诊时已进展为中晚期,目前已明确的同步放化疗是治疗中晚期食管癌的标准疗法[4],但仍有部分患者会发生局部复发和转移,其中放疗抵抗被认为是治疗失败的重要原因之一[5]。因此,寻找有关食管癌放疗抵抗的新型标志物,对预测食管癌的预后和提供新的治疗方向具有深远的意义。
三结构域蛋白28(tripartite motif-containing 28,TRIM28)是含人三方基序(tripartite motif-containing protein,TRIM)蛋白质家族的重要成员,也被称为KRAB相关蛋白1((Krüppel-Associated Box-Associated Protein)1,KAP1)或转录中间因子1β(transcription intermediary factor 1 beta,TIF1-β)[6]。TRIM28不仅是正常发育和分化的关键调节因子,同时也在肿瘤的发生发展中发挥重要作用[7]。且在大部分肿瘤中,TRIM28蛋白表达水平增高,患者的生存率显著降低[6]。
本文旨在探讨TRIM28在放疗的食管癌患者中的表达、预后及与食管癌放疗抵抗的关系。
1 材料与方法
1.1 试剂
人食管鳞癌细胞株Kyse30购自上海普诺赛生命科技有限公司;TIF1-β(TRIM28)(C42G12,兔单克隆抗体)购自Cell Signaling Technology;Alpha tubulin(No. 66031-1-Ig,鼠单克隆抗体)购自ProteinTech;蛋白裂解液和 BCA 蛋白浓度测定试剂盒购于碧云天生物公司;0.25% 胰蛋白酶(0.25% Trypsin-EDTA)、RPMI 1640 培养基、胎牛血清(FBS)均来源于美国GIBCO公司;免疫组化使用通用型SP9000试剂及DAB显色剂均来源于北京中杉金桥公司。根据试剂使用说明书推荐实验步骤进行操作。
1.2 方法
1.2.1 材料
收集安徽医科大学第一附属医院2014年1月至2015年8月就诊的72例食管鳞癌患者的临床资料及食管癌活检标本。另收集35例正常食管黏膜组织标本作为正常对照。根据美国肿瘤联合委员会(AJCC,2017)的TNM分类第8版[8]对患者进行相关组织学分型和临床病理分期。所有患者均为首发食管癌,且均只行同步放化疗。
1.2.2 免疫组化
选取的食管癌活检组织和食管正常粘膜组织均经10% 中性福尔马林溶液固定,石蜡包埋,4μm厚度连续切片,脱蜡后染色,具体操作步骤按照SP900试剂盒说明书进行。同时以PBS缓冲液代替一抗作为阴性对照。免疫组化结果由两位病理科副主任医师采用独立双盲原则进行判定,计数高倍视野(400x)内阳性细胞占比,取平均值计算阅片结果。TRIM28阳性主要定位于细胞核,阳性阈值定义为阳性细胞数>10%,且无论细胞核染色强度。TRIM28阳性表达高低标准为:阳性细胞数<10% 为0分,10%~49% 为1分;50%~74% 为2分;≥ 75% 为3。染色强度则依据染色的深度为标准:无着色为0分;淡黄色为1分;棕黄色为2分;棕褐色为3分。将两项得分结果相乘:<3分为低表达,≥ 3分为高表达。
1.2.3 细胞培养
人食管鳞癌细胞株Kyse30用含有10% 胎牛血清的RPMI Medium-1640培养基培养,放置于37 ℃,100% 湿度,含有5% CO2的培养箱中培养。1-2 d后观察细胞的状态和密度,适时更换培养基,定期进行细胞传代。
1.2.4 放射线处理细胞株
取在对数生长期的Kyse30细胞株,用0.25%胰酶将细胞团块消化,制备成单细胞悬液,均匀地铺在6cm培养皿中,常规培养。待细胞呈指数生长时传代,以1:2的比例稳定传代两次后,随机分为对照组和照射组。80%面积被照射组细胞长满时,将细胞暴露在6Gy的能量辐射中。然后将细胞常规培养两周后提取蛋白。对照组在相同环境中培养,但不经射线处理。源皮距(SSD)为100cm,照射面积为20cm×20 cm。
1.2.5 免疫蛋白印迹
收集待检测Kyse30细胞,使用1◊PBS缓冲液将细胞清洗两次,在细胞中加入适量蛋白裂解液来提取细胞蛋白,采用BCA法测定所提取的蛋白浓度。使用8% 聚丙烯酰胺凝胶电泳,在350mA恒流,转膜90min的条件下转至PVDF膜上,将膜置于5% 脱脂牛奶中室温封闭1h,一抗4℃孵育过夜。第二天使用TBST洗膜3次,二抗室温孵育1h,再使用TBST洗膜3次。漂洗结束后加入显影液避光显影并采集图像。
1.2.6 放疗后近期疗效评估
放疗后4周,利用X线食管造影和CT有效评估放疗对食管癌原发病灶的治疗效果[9]。具体评估标准见表1。

表1 放疗后近期疗效评估
1.2.7 统计学分析
收集UALCAN数据库(http://ualcan.path.uab.edu/index.html)中RNA-seq和食管癌类型的临床数据,统计分析TRIM28 mRNA在人食管正常组织和食管鳞癌组织中的表达,并作图。
应用SPSS 25.0和GraphPad Prism 8.4.0软件进行统计学分析。对TRIM28在食管癌组织中的表达情况及与临床病理特征的关系采用χ2检验,对食管癌放疗抵抗影响因素采用Logistic回归分析,生存分析采用GraphPad Prism 8.4.0软件进行K-M分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 TRIM28在食管癌及食管正常粘膜组织中的表达
在UALCAN数据库中,TRIM28在11例正常食管黏膜组织中的检测情况和在95例食管鳞癌组织中检测情况被比较发现,TRIM28被癌组织和正常组织表达明显差异(P<0.05),结果见图1。为了验证这一结果,我们对72例食管鳞癌组织和35例正常食管粘膜组织进行免疫组化染色,结果见图2、表2。根据前文给出的染色评分标准,TRIM28在59例(81.94%)食管鳞癌组织中呈现阳性染色,且TRIM28主要在细胞核中内检测到,同时可见细胞核出现异型性。相反,仅12例(34.28%)食管正常粘膜组织染色被检测到阳性,代表两种组织间的表达差异的P值<0.05。
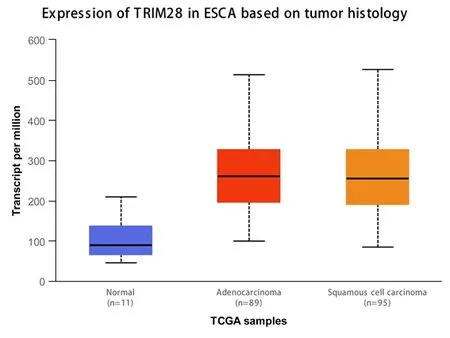
图1 TRIM28 在正常食管组织及食管癌组织中的表达(与正常食管组织比较,P<0.05)

图2 TRIM28在食管癌组织及正常粘膜组织中的表达情况
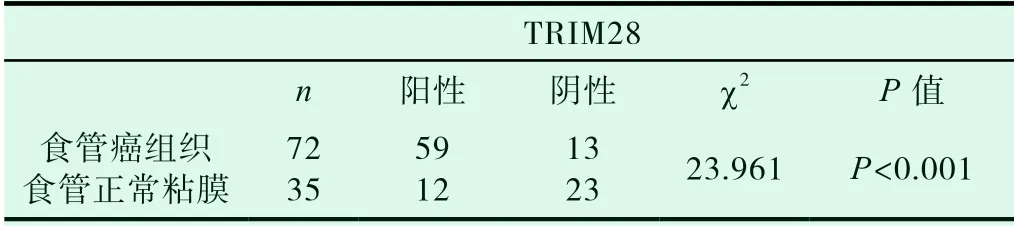
表2 TRIM28在ESCC和食管正常粘膜组织中的表达情况
2.2 TRIM28与食管癌临床病理特征的关系
在72例TRIM28表达阳性食管癌组织中,高表达33例(45.83%),低表达39例(54.17%),TRIM28表达状态与患者性别(P=0.310)、年龄(P=0.057)、组织学分级(P=0.190)无明显相关,差异不具有统计学意义,与食管癌T分期(P=0.004)、N分期(P=0.016)、M分期(P=0.014)、肿瘤大小(P=0.034)、CRT反应(P=0.001)、局部转移(P=0.029)、远处转移(P<0.001)相关,差异具有统计学意义(表3)。
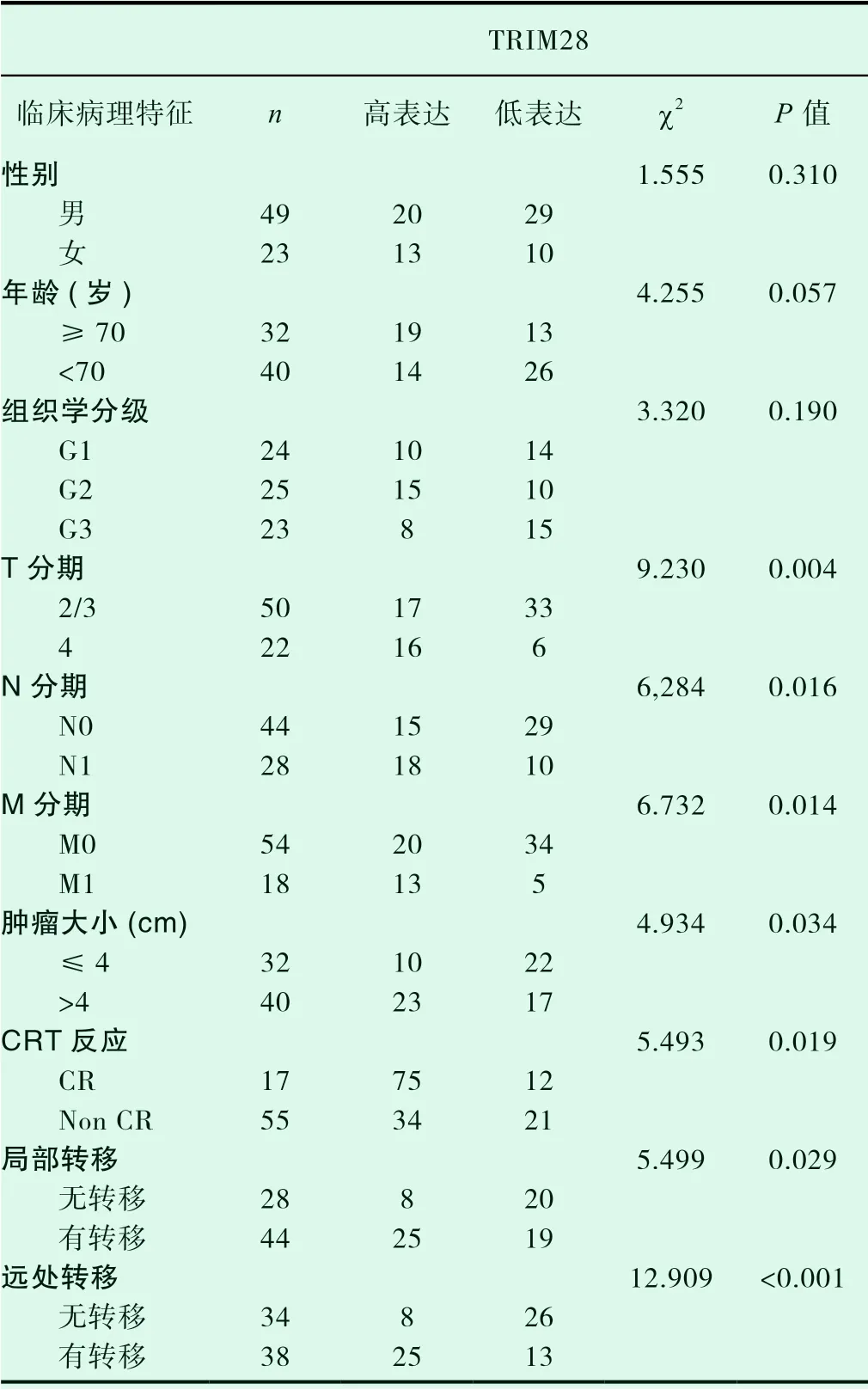
表3 食管癌组织中TRIM28表达与临床病理特征的关系
2.3 TRIM28表达状态与患者预后的关系
为了研究TRIM28表达高低是否与食管癌放疗患者预后相关,本研究使用GraphPad prism 8.4.0进行了生存分析。如图3所示,高表达TRIM28的食管癌患者较低表达TRIM28的食管癌患者预后差,总体生存率低,且差异具有统计学意义(HR=1.944,95% CI=1.034~3.652,P=0.013)。

图3 使用GraphPad Prism 8.4.0 预测TRIM28蛋白表达高低与患者预后关系的相关性,TRIM28高表达组较低表达组预后差,总体生存率低,P=0.013。
2.4 TRIM28与食管癌放疗敏感性的关系
由前得知,TRIM28与放疗食管癌患者预后相关,且TRIM28表达越高患者预后越差,所以本研究组假设TRIM28通过影响食管癌放疗敏感性从而影响患者预后。本研究组对两组细胞密度相同的Ksye30细胞株分别行0Gy、6Gy照光,Western Blot结果显示,照光后实验组Kyse30细胞株表达TRIM28蛋白明显增多,提示TRIM28的表达与电离辐射相关(图4)。进一步分析与放疗抵抗的相关因素,Logistic回归分析显示,TRIM28表达高低、N分期、M分期均是引起食管癌放疗抵抗的独立危险因素(表4)。

表4 影响食管癌患者放疗敏感性的因素

图4 分别对两组Kys30细胞照光,照光后TRIM28蛋白表达较前明显增多。
3 讨论
现如今,同步放化疗已经成为治疗食管癌的重要方式之一[10],而放疗抵抗则是导致食管癌复发率升高或5年生存率下降的重要原因[11]。肿瘤放疗抵抗的获得是一个复杂的过程,主要包括DNA修复蛋白的过表达,抵抗相关信号通路的异常激活,肿瘤血管生成,肿瘤干细胞和自噬等[12]。尽管对于食管癌放疗抵抗的机制已有一定研究,但与TRIM28相关的研究目前仍处于未知阶段。本文首次提出并证明了TRIM28表达与食管癌的放疗抵抗相关。
TRIM28,是一种大型的多结构域蛋白,分子量约为110kDa,属于TRIM家族。TRIM28的氨基(N)末端包含四个保守的结构域,其中包含RING指结构域,两个B-box结构域和一个亮氨酸拉链卷曲螺旋区域(CC),这些区域统称为RBCC或TRIM域[5]。TRIM28的羧基(C)端串联PHD结构域和溴结构域(亦称为PB结构域),主要发挥转录抑制功能[7]。当前的研究表明,TRIM28在细胞分化,DNA损伤反应(DDR),病毒复制,免疫反应和肿瘤发生发展等多种方面均发挥重要作用[5,13]。近年来针对TRIM28与肿瘤的关系的研究越来越多。Yu等的研究结果发现在胰腺癌细胞株内过表达TRIM28,可增加波形蛋白表达,同时降低E-钙蛋白的表达,从而促进胰腺癌细胞的转移和侵袭[14]。Joseph B.团队的研究也表明乳腺癌细胞株中过表达TRIM28与乳腺癌细胞增殖和转移相关[15]。除此之外,另一个研究揭示了TRIM28促进乳腺癌发生发展的机制通路,即通过与EZH2和SWI / SNF复合物结合促进肿瘤干细胞的富集和维持,进而引起乳腺癌转移侵袭[16]。本研究通过免疫组化和免疫蛋白印迹方法,得出TRIM28与食管癌放疗患者预后及放疗抵抗相关。研究证明,TRIM28与电离辐射引起的双链DNA损伤修复相关,而放疗抵抗的原因之一就是双链DNA损伤修复。电离辐射后,细胞内ATM信号被激活,下游TRIM28被磷酸化(pTRIM28)并且浓聚在染色体损伤位点,舒张染色体,进而促进染色体修复[17]。与此同时,pTRIM28增多后,PP4C / R3b复合物激活介导pTRIM28去磷酸化,从而调节并稳定TRIM28在DDR中的作用[18]。目前在本研究中,仅提出了TRIM28与放疗抵抗相关,未进一步实验证明TRIM28调节DDR通路,相关放疗抵抗通路仍待后续进一步研究。
本文的研究结果显示,TRIM28蛋白在食管癌组织中表达显著高于正常食管粘膜组织,与刘博等的研究结果一致[19]。其次本研究组发现,TRIM28的表达与患者的性别、年龄、肿瘤分化程度均无明显相关,与食管癌肿瘤的大小及TNM分期均有显著相关,提示TRIM28在食管癌的进展和转移上发挥作用,与TRIM28在其他肿瘤中的作用基本相似[15,20]。随后研究发现TRIM28在复发转移的患者中的表达水平显著高于无复发转移者,并且低表达患者显示出更好的预后,说明TRIM28与放疗后食管癌的复发转移及预后相关。此外,对放疗反应较差的患者的TRIM28表达显著高于反应较好的患者,且差异具有统计学意义。该结果提示,在食管癌患者中检测TRIM28表达不仅有望成为预测同步放化疗食管癌患者预后的新型标志物,同时也有望成为预测食管癌放疗抵抗的新指标。
综上所述,TRIM28影响着放疗后食管癌患者的转移复发及预后,且与食管癌的放疗抵抗相关,也能够为食管癌患者的临床治疗提供新的研究方向。
