错配修复蛋白缺失相关子宫内膜癌的病理特征及其临床意义
2021-09-16邓茜雷琼李璐高尤亮俞文英严俊龙郭亚男郑时玉李海莉蒙伶俐卢立霞李征夏朝霞
邓茜 雷琼 李璐 高尤亮 俞文英 严俊龙 郭亚男 郑时玉 李海莉 蒙伶俐 卢立霞 李征 夏朝霞
Lynch综合征即遗传性非息肉性结直肠癌(hereditary non-polyposis colorec-tal cancer,HNPCC)属于常染色体显性遗传病。人体碱基错配修复(mismatch repair,MMR)基因胚系突变后可导致遗传不稳定性,引起广泛的肿瘤易感性。其中女性Lynch综合征患者最常发生的是卵巢癌和子宫内膜癌(endometrial cancer,EC)[1],一部分女性Lynch综合征患者以EC为首发肿瘤,因此在EC患者中筛查Lynch综合征是可行且必要的。Lynch综合征确诊需依靠费用昂贵的二代测序(next generation sequencing,NGS)检测MMR基因胚系突变,无法进行大规模普筛工作,而日常工作中使用的免疫组化检测MMR蛋白的方法经济快捷,是初步筛查Lynch综合征的有效手段[2]。目前国内有关MMR蛋白缺陷相关子宫内膜癌(MMR protein deletion-related endometrial carcinoma,dMMR-EC)的研究较少,因此本研究旨在探讨dMMR-EC患者的临床病理特征及其临床意义,以便指导临床工作中初步筛查Lynch综合征患者,进而指导下一步的治疗方法和疾病管理。
1 对象和方法
1.1 对象 选取2014年6月至2017年6月宁波市临床病理诊断中心诊断的EC患者294例,年龄28~86(56.4±9.4)岁。纳入的EC组织学类型有:子宫内膜样癌、浆液性癌、透明细胞癌、混合性腺癌、子宫癌肉瘤、未分化癌和去分化癌。组织学类型不包括中肾腺癌、中肾样腺癌、鳞状细胞癌、胃肠型黏液腺癌、转移性癌以及宫颈腺癌累及宫体等。本研究经本中心医学伦理委员会批准,所有患者均知情同意。
1.2 病理检查 复阅所有患者经HE染色后的组织切片,观察肿瘤组织形态学特征、组织学类型、肌层浸润情况、淋巴结转移情况、组织学分级分期[按国际妇产科协会(Federation International of Gynecology and Obstetrics,FIGO)标准执行]等临床病理学特征。
1.3 免疫组化检测及其抗体信息 所有标本均经10%中性甲醛溶液固定、脱水、包埋、4 μm切片。免疫组化采用Ventana Benchmark XT自动免疫组化仪(美国Ventana公司)染色。一抗:鼠抗人单克隆抗体MLHl(克隆号:ES05)和兔抗人单克隆抗体MSH2(克隆号:RED2)均购自福州迈新生物技术开发有限公司,兔抗人单克隆抗体MSH6(克隆号:EP49)购自北京中杉金桥生物技术开发有限公司,兔抗人单克隆抗体PMS2(克隆号:EP51)购自河南赛诺特生物技术开发有限公司。以每张切片中淋巴细胞、纤维间质细胞或癌旁子宫内膜腺体的胞核阳性为阳性内对照,阴性内对照使用PBS代替一抗。
1.4 二代测序及其主要试剂盒、仪器 每例需进行二代测序的患者均挑取一个含癌组织的蜡块,切成蜡卷,采用QIAamp DNA FFPE Tissue提取试剂盒(德国QIAGEN公司)提取组织内DNA后使用二代测序仪(型号:Hiseq 4000,美国Illumina公司)进行MMR基因的二代测序检测,DNA capture probes购自南京世和基因生物技术有限公司。
1.5 结果判读 MMR蛋白(包括MLH1、PMS2、MSH2和MSH6)在任何肿瘤细胞核明确着色即判定为阳性(如图 1、2、4、5,插页)[3];所有肿瘤细胞核均不着色时即为阴性(如图3、6,插页)。间质淋巴细胞、纤维组织细胞及癌旁子宫内膜腺体均可作为阳性内对照,有助于分辨假阳性或假阴性。
图1 子宫内膜样癌病理切片所见(HE染色,×100)

图2 子宫内膜样癌中MLH1阳性表达(周围纤维间质细胞或淋巴细胞阳性表达,阳性内对照;免疫组化染色,×100)

图3 子宫内膜样癌中MSH6阴性表达(周围纤维间质细胞或淋巴细胞阳性表达,阳性内对照;免疫组化染色,×100)

图4 子宫内膜透明细胞癌病理切片所见(HE染色,×100)

图5 透明细胞癌中MSH2阳性表达(周围癌旁子宫内膜腺体阳性表达,阳性内对照;免疫组化染色,×100)

图6 透明细胞癌中PMS2阴性表达(周围癌旁子宫内膜腺体阳性表达,阳性内对照;免疫组化染色,×100)
1.6 统计学处理 采用SPSS 20.0统计软件。计数资料用率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料 294例EC石蜡包埋标本中,诊断学刮宫(以下简称诊刮)标本22例,其余272例中有57例未清扫盆腔淋巴结,另外215例为EC根治标本。患者年龄<50岁者72例,≥50岁者222例。组织学类型如下:子宫内膜样癌242例,平均年龄54.7岁;Ⅱ型EC有43例,其中透明细胞癌12例(平均年龄70.7岁),浆液性癌23例(平均年龄64.7岁),癌肉瘤8例(平均年龄59.6岁);Ⅰ型和Ⅱ型混合性腺癌2例(平均年龄56.5岁);去分化癌5例(平均年龄57.4岁);未分化癌2例(平均年龄55.5岁)。242例子宫内膜样癌中不同FIGO分级占比分别为:Ⅰ级144例(59.5%),平均年龄52.5岁;Ⅱ级76例(31.4%),平均年龄57.1岁;Ⅲ级22例(9.1%),平均年龄61.0岁。FIGO分期:175例Ⅰ型子宫内膜样癌根治标本中Ⅰ期137例(78.3%),Ⅱ期25例(14.3%),Ⅲ期13例(7.4%),Ⅳ期0例(0.0%)。23例浆液性癌中18例为根治标本,FIGO分期分别为Ⅰ期10例,Ⅱ期2例,Ⅲ期6例,Ⅳ期0例。12例透明细胞癌中10例为根治标本,FIGO分期为Ⅰ期5例,Ⅱ期3例,Ⅲ期2例,Ⅳ期0例。8例癌肉瘤中6例为根治标本,FIGO分期Ⅰ期4例,Ⅱ期0例,Ⅲ期2例,Ⅳ期0例。5例去分化EC中,4例非诊刮标本FIGO分期Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期者分别各占1例。2例未分化癌均为根治标本,FIGO分期分别为Ⅰ期和Ⅱ期。混合型癌2例其中1例为根治标本,FIGO分期为Ⅰ期。
2.2 MMR蛋白表达情况 294例EC患者中,62例出现MMR蛋白的阴性表达,即为dMMR-EC患者,其余232例MMR蛋白阳性表达。多种组织学类型的EC均可出现MMR蛋白阴性表达(MMR阴性例数/总例数):子宫内膜样癌(53/242)、透明细胞癌(1/12)、浆液性癌(2/23)、混合性腺癌(1/2)、癌肉瘤(2/8)、未分化癌(1/2)及去分化癌(2/5)。62例MMR蛋白阴性表达的EC患者可以出现特定组合内的单个MMR蛋白阴性表达,也可以出现特定组合内的2个MMR蛋白共同阴性表达,但未出现两个特定组合内的蛋白均阴性表达或交叉阴性表达的现象。本组研究62例dMMR-EC(阴性率21.1%)中,MLH1和(或)PMS2阴性表达40例(阴性率13.6%),MSH2和(或)MSH6阴性表达22例(阴性率7.5%)。
2.3 MMR基因二代测序结果 由于经费限制,本研究从62例dMMR-EC患者中按分层随机的方法挑选出21例进行二代测序检测MMR基因表达频谱,进行免疫组化结果的验证,结果21例dMMR-EC患者中有18例肿瘤组织内检测出MMR基因突变,其中10例MSH2和(或)MSH6蛋白阴性组织均出现MMR基因突变,11例MLH1和(或)PMS2蛋白阴性组织中有6例出现MMR基因突变,如图7(插页)。
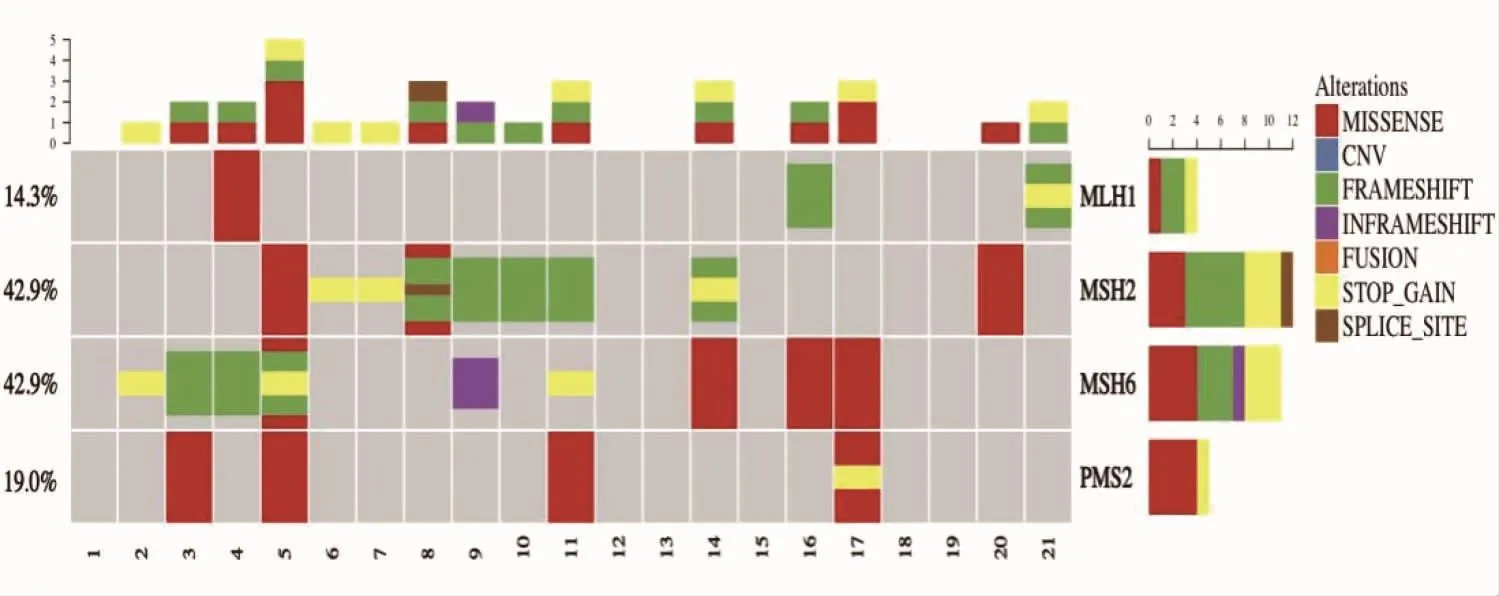
图7 21例dMMR-EC二代测序MMR基因表达频谱(dMMR-EC为错配修复蛋白缺失相关子宫内膜癌;MMR为错配修复)
2.4 MMR蛋白阴性率与患者临床病理特征的关系MMR蛋白阴性率与年龄、组织学类型、非诊刮标本肌层浸润深度、根治标本淋巴结转移情况、FIGO分级和分期均无相关性(均P>0.05)。而非Ⅱ型高级别EC患者MMR蛋白阴性率明显高于Ⅱ型高级别EC患者MMR蛋白阴性率,差异有统计学意义(P<0.05)。见表1。

表1 MMR蛋白阴性率与EC患者临床病理特征的关系[例(%)]
2.5 随访结果 62例dMMR-EC患者均进行电话随访,随访时间25~62个月,有效随访52例,其中无病生存49例,远处转移2例(随访时间分别为40和34个月),病死1例(随访时间为60个月);失访10例。
3 讨论
人类MMR基因可以识别和修复DNA复制和重组过程中发生的错误性碱基插入、缺失和一部分DNA损伤,保证DNA高保真复制,维持染色体的稳定性[4]。MMR基因缺陷细胞的碱基突变率是正常碱基10到1 000倍[5]。目前研究较多的MMR基因类型主要是MLH1、PMS2、MSH2 和 MSH6[6]。
MMR基因缺陷有两种情况,一种是可遗传的种系或胚系突变,常常导致Lynch综合征;另一种就是不可遗传的体细胞或肿瘤细胞突变。筛查dMMR-EC对识别高复发风险[7-8]或遗传性EC患者(如Lynch综合征)有帮助[8-9]。
Lynch综合征是MMR基因发生种系或胚系突变所致的一种常染色体显性遗传性疾病,表现为多系统多器官肿瘤易感性(多种组织癌变概率大大增加,如胃、女性生殖道、胆道、尿道、小肠、大脑和胰腺等)。女性Lynch征患者最常发生的肿瘤是卵巢癌和EC[1],一部分Lynch综合征患者以EC为首发肿瘤。因此,在EC患者中开展Lynch综合征筛查是可行而必要的,便于及时发现和预防患者Lynch综合征相关的其他肿瘤的发生。此外,Lynch综合征亲属也可以尽早进行遗传咨询及基因检测,预防发生Lynch综合征相关肿瘤。
免疫组化检测MMR蛋白的表达是筛查Lynch综合征相关肿瘤的有效方法,已经普遍应用于筛查Lynch综合征相关结直肠癌患者的工作流程[2],近年来Lynch综合征相关EC(Lynch syndrome-related endometrial cancer,Lynch-EC)备受关注,Scnter等和 Frolova 等[10-11]的研究显示与MMR基因检测结果比较,免疫组化法检测MMR蛋白的灵敏度、特异度分别为0.91、0.88,因此推荐将免疫组化检测MMR蛋白作为Lynch-EC的初筛手段。近年来,就Lynch-EC的具体筛查方案、临床病理学特征、治疗及预后等是研究热点[12-15]。因此,本研究通过免疫组化检测MMR蛋白的表达初步筛查Lynch-EC展开相关研究。
本组研究中294例EC患者的MMR蛋白阴性率为21.1%(62/294),其中 MLH1和(或)PMS2蛋白阴性率13.6%(40/294),MSH2和(或)MSH6蛋白阴性率 7.5%(22/294),MMR蛋白阴性率在大多数国内外研究报道的范围内,但略低于某些国外报道的45%[16],有可能是筛查种群及地域不一样所致。此外,本研究结果表明多种组织学类型的EC,包括子宫内膜样癌、透明细胞癌、浆液性癌、混合性腺癌、癌肉瘤、未分化癌及去分化癌等均可出现MMR蛋白阴性表达。除此以外,不论患者年龄是否<50岁、肿瘤浸润肌层是否>1/2、是否具有淋巴结转移以及FIGO分级分期程度,MMR蛋白阴性率均无统计学差异。此结果支持推荐所有初次确诊的EC均进行MMR蛋白检测以达到Lynch-EC初筛的目的。这一结论与国内外主流观点基本一致[17],但Ruiz等[18]的研究表明MMR蛋白阴性病例更常见于浸润深度<1/2肌层的病例,而Long等[19]的研究报道MMR蛋白阴性病例具有更深的肌层浸润,可能是研究对象地域不同所致,也可能数据量有限,这需要大数量级数据进一步研究。此外,Pina等[20]研究报道显示,组织学类型为去分化EC更容易出现出现MMR蛋白阴性,而本研究入组的去分化EC患者例数较少,难以进行统计学分析,因此,有待收集更多的病例进一步研究。
国内外多项研究均进行了低级别EC和高级别EC中MMR阴性率的比较,结果它们的阴性率比较差异均无统计学意义,本研究结果跟上述结果一致,但本研究进一步把高级别EC分成Ⅱ型癌和非Ⅱ型癌两组,统计学分析后发现非Ⅱ型高级别EC患者MMR蛋白阴性率(35.5%,11/31)高于Ⅱ型高级别EC患者的(11.6%,5/43),也就是说,组织学类型为非Ⅱ型高级别的EC时应作为Lynch-EC的重点筛查对象,应特别注意是否有MMR蛋白阴性,并进一步明确是否为Lynch-EC。
2013年,美国癌症基因组图谱提出将EC区分为DNA聚合酶ε(POLE)突变型、微卫星不稳定(microsatellite Instability,MSI)高突变型、高拷贝数型和低拷贝数型4种分子亚型[21]。2015年Talhouk等[22]使用免疫组化替代基因分型的方案,证明基于免疫组化检测MMR蛋白筛选MSI高突变型EC是可行的。2020年,EC的分子分型以及基于免疫组化的分子分型方案被正式写入第5版《WHO女性生殖肿瘤分类》中并且指出这4种分子分型中POLE突变型和MSI高突变型预后最好,其次为低拷贝数型,而高拷贝数型预后最差。本研究筛选的62例dMMR-EC基本可等同于MSI高突变型EC,预后相对较好,随访资料与此相符。对部分dMMR-EC(21例)进行的基因水平的验证,结果21例dMMR-EC中16例出现对应MMR基因突变(16/21,76.2%),其中10例MSH2和/或MSH6蛋白阴性的病例NGS结果均出现对应的基因突变(10/10,100.0%),11例 MLH1和/或 PMS2蛋白阴性的病例6例NGS结果出现对应的基因突变(6/11,54.5%),说明MSH2和/或MSH6的免疫组化与NGS基因检测结果的一致性优于MLH1和(或)PMS2的。
众多研究表明MMR缺失的多种肿瘤(包括dMMREC)受益于程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)单抗的治疗。2015 年,Le 等[23]的研 究 显示PD-1单抗pembrolizumab对MMR缺陷型肿瘤的治疗作用明显高于MMR正常表达的肿瘤。2017年,Le等[24]研究发现12种MMR缺陷型肿瘤的86例晚期患者使用pembrolizumab治疗后,57%的患者出现影像学层面的病情缓解,21%的患者获得完全缓解。2017年6月,美国临床肿瘤协会推荐PD-1单抗治疗EC尤其是dMMR-EC患者[25]。因此,临床工作中筛查出dMMR-EC患者对其进一步的治疗具有一定的指导意义,这一点在一些需要术后辅助治疗的高级别EC中显得尤其重要。这也是本研究的意义之一:把高级别EC里的dMMR-EC用免疫组化筛选出,可以个体化制定有效的治疗方案。
综上所述,本研究通过免疫组化检测EC中MMR蛋白的表达,分析EC组织中MMR蛋白阴性率与其临床病理特征的相关性,指出推荐所有初次确诊的EC患者进行免疫组化检测MMR蛋白的表达,进行Lynch-EC初筛,其中非Ⅱ型高级别EC是重点筛查对象。本研究进一步讨论了在实际临床工作中使用免疫组化检测EC组织中 MMR蛋白的表达意义:(1)有助于开展Lynch-EC的初筛工作,对预防Lynch-EC患者本人再次发生或家族其他成员发生Lynch综合征相关的肿瘤有一定意义;(2)有助于将预后不同的高级别EC进行分组,并指导相应的药物治疗(如可受益于PD-1单抗治疗),利于高级别EC的疾病管理。
