紫杉醇耐药乳腺癌细胞外泌体来源的miR-5585-5p诱导乳腺癌细胞产生耐药表型研究
2021-09-16魏欣宇刘佳欣王文锐杨清玲陈昌杰
魏欣宇,高 鹏,刘佳欣,王文锐,杨清玲,陈昌杰
据CA最新统计[1],全球乳腺癌新发病例高达226万,成为世界第一大癌症,严重威胁了女性健康。乳腺癌的诊断和治疗正在向个性化、精准化发展,如化疗、内分泌治疗和靶向药物[2]。但目前面临的重要问题是,乳腺癌耐药性的产生和转移常导致治疗失败和肿瘤复发[3]。因此,阐明乳腺癌细胞产生耐药性的详细机制对于寻找潜在治疗靶点和乳腺癌早期诊断的生物标志物至关重要。外泌体作为一种运输载体,大小在40~160 nm,在基质和癌细胞之间传递核酸和蛋白质,介导细胞间的通讯,从而影响癌细胞的生物活性。由于富含各种生物分子,外泌体为生物液体检测提供了一种多组分诊断指标[4-6]。其中,microRNAs是内源性的小非编码RNA,具有调节转录后基因表达的功能。生理过程和病理,包括癌症、心血管和代谢性疾病都高度依赖miRNA。癌细胞释放的外泌体miRNA可以介导肿瘤微环境中细胞的表型改变,促进肿瘤生长和耐药。本研究主要探讨外泌体源性miR-5585-5p的表达情况和其介导的耐药机制。
1 材料与方法
1.1 细胞和试剂 人乳腺癌细胞株SKBR-3购自中国科学院上海细胞研究所得,课题组前期成功构建紫杉醇耐药细胞株SKBR-3/PR;胎牛血清、DMEM高糖培养基购自Hyclone公司;β-actin、P-GP、MRP 抗体购自Affnity;细胞凋亡试剂盒、BCA试剂盒购自碧云天公司;外泌体提取试剂盒购自贝贝生物科技有限公司;外泌体染料PKH26、PKH67购自上海宇玫博公司。
1.2 方法
1.2.1 细胞培养 细胞培养在含有10%胎牛血清的DMEM培养基中进行,置于5%CO2、37 ℃细胞培养箱中。待细胞融合度达到90%,胰酶消化离心进行传代。
1.2.2 外泌体的提取 细胞融合度至50%,PBS清洗细胞,换无外泌体血清培养基继续培养。收集细胞培养上清,利用超速离心法提取外泌体,根据外泌体提取试剂盒说明书进行操作。
1.2.3 外泌体摄取实验 以PKH26标记外泌体,根据说明书配制荧光染料,与提取的外泌体共孵育10 min,再与SKBR-3细胞共培养8 h,荧光显微镜观察并拍摄。
1.2.4 转染miR-5585-5p抑制剂 将乳腺癌耐药细胞接种至六孔板中,放入 5% CO2、37 ℃培养箱中培养 24 h,当细胞融合度达到 50%~70%,弃掉旧培养基,PBS清洗后实验组每孔分别加入1.5 mL 无血清培养基和500 μL配制的转染试剂(A液:250 μL Opti-MEM+5 μL Lipofectamine2000;B液:250 μL Opti-MEM+5 μL inhibitor;静置5 min后,B液加入A液,室温孵育20 min)。
1.2.5 qRT-PCR检测核酸表达量 从细胞和外泌体中提取总RNA(Trozal法),逆转录获得cDNA后进行PCR扩增。GAPDH作为内参,所用的引物序列见表1。qRT-PCR反应参数为 95 ℃预变性10 min,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 34 s,55个循环。获得的数据运用2-ΔΔCt计算表达量。
1.2.6 Western blotting检测目的蛋白表达量 收集细胞,洗涤后加入裂解液冰上裂解30 min,离心后获得总蛋白。BCA法测定总蛋白浓度。配制10%SDS-PAGE进行电泳,70 V电泳至浓缩胶和分离胶交界处,调整电压100 V电泳至溴酚蓝条带到达分离胶底部,停止电泳;转膜时将PVDF膜预先放入甲醇中激活,200 mA转膜2 h;随后将PVDF 膜放入封闭液中摇床孵育2 h,洗膜(每次10 min,3次),一抗4 ℃孵育过夜,洗膜,第2天孵二抗(37 ℃,2 h),洗膜后曝光。
1.2.7 Transwell检测细胞迁移能力 待细胞处于对数生长期,胰酶消化后,用无血清培养基重悬细胞并计数。按照实验分组,各组上室加入含有相同细胞数(4×104/孔)的细胞悬液,并用无血清培养基补至200 μL;下室加入 600 μL含10% 胎牛血清的培养基,5% CO2、37 ℃培养箱中培养24 h。取出Transwell小室,用棉签小心擦去上室的培养基以及膜上部未穿过的细胞,4%多聚甲醇固定20 min,结晶紫染色20 min,PBS清洗3次,自然晾干后,倒置显微镜随机计数5个高倍镜视野下细胞数目并拍照记录。
1.2.8 细胞凋亡实验 将细胞接种在6孔板中,5% CO2、37 ℃的培养箱中孵育。细胞密度达到80%时按照实验分组处理,继续孵育24 h。用不含EDTA 的胰酶将细胞消化后离心(1 000 r/min)5 min,预冷的PBS洗涤细胞 2 次。200 μL Binding Buffer重悬细胞,先加入5 μL FITC,再加入10 μL PI,染色后室温避光孵育30 min,300目尼龙网过滤细胞悬液,上机检测细胞的凋亡情况。
1.3 统计学方法 采用t检验。
2 结果
2.1 耐药细胞源性外泌体被乳腺癌细胞摄取 外泌体摄取实验表明PKH26标记的红色外泌体能够被乳腺癌细胞摄取至胞内(见图1)。

2.2 耐药细胞源性外泌体促进乳腺癌细胞产生耐药表型 将从耐药细胞上清液中提取的外泌体与乳腺癌亲本细胞共培养。qRT-PCR结果显示,相对于乳腺癌亲本细胞,耐药细胞外泌体共培养组的耐药标志物表达均升高(P<0.01)(见表2)。Transwell 和细胞凋亡实验结果表明,与乳腺癌亲本细胞组相比,耐药细胞外泌体共培养组的乳腺癌细胞迁移能力增强(P<0.01),癌细胞凋亡率下降(P<0.01)(见图2~3、表3)。
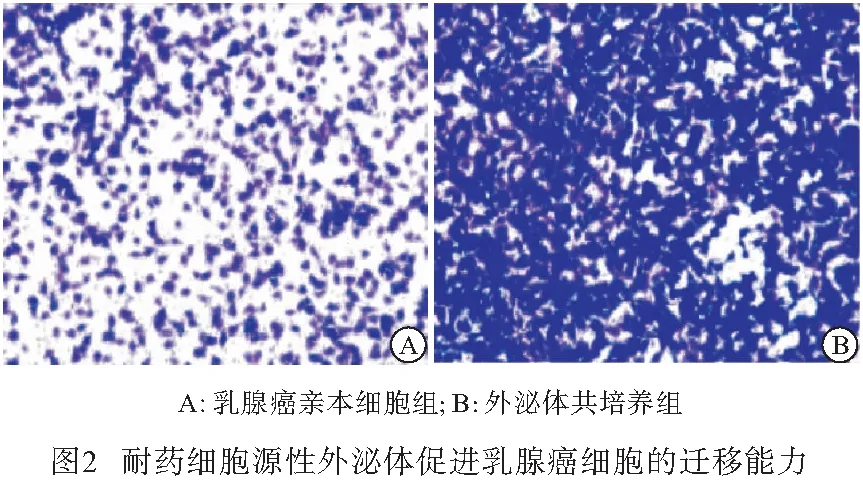


表2 在外泌体共培养组中耐药相关基因表达水平升高

表3 耐药细胞源性外泌体对乳腺癌细胞迁移能力和凋亡的影响
2.3 miR-5585-5p在耐药细胞株及其外泌体中高表达 与乳腺癌细胞表达量(1.00±0.00)相比,miR-5585-5p在耐药细胞中表达(2.08±0.35)明显升高(t=5.35,P<0.01);同时,分别从SKBR-3和SKBR-3/PR细胞中提取外泌体,经qRT-PCR验证,紫杉醇耐药的乳腺癌细胞外泌体中miR-5585-5p的表达量升高[(1.00±0.00)vs(3.03±0.49)](t=3.56,P<0.05)。
2.4 miR-5585-5p抑制剂逆转乳腺癌耐药细胞的耐药性 在耐药细胞中,与未转染抑制剂的control组相比,miR-5585-5p inhibitor组耐药性降低(P<0.01),耐药相关蛋白PGP和MRP表达下调(P<0.01),抑制剂组迁移能力减弱(P<0.01),细胞凋亡增多(P<0.01)(见图4~6、表4)。




表4 miR-5585-5p抑制剂抑制乳腺癌耐药细胞耐药指标的比较
2.5 miR-5585-5p通过外泌体进入到乳腺癌细胞中 外泌体示踪实验证实,与对照组相比,实验组CY3标记的miR-5585-5p通过外泌体进入到乳腺癌细胞内(见图7)。

2.6 外泌体差异表达miR-5585-5p生物学活性分析 相对于未转染抑制剂的外泌体共培养组,抑制剂外泌体组亲本细胞的耐药相关基因PGP、BCRP和MRP的表达量降低(P<0.01),迁移能力降低(P<0.01)并诱导细胞凋亡(P<0.01)(见图8~9、表5)。

表5 外泌体差异表达miR-5585-5p生物学活性指标的比较


3 讨论
尽管乳腺癌的筛查、诊断和治疗取得了进展,但乳腺癌的转移和复发仍然存在并困扰着人们。在芳香化酶抑制剂抗性细胞中,Ⅱ型角蛋白拓扑关联域经过表观遗传重编程,导致角蛋白-80上调,进而增加黏附,促进癌细胞侵袭[7]。耐药通常伴随着癌症的复发和转移而出现。乳腺癌细胞来源的外泌体能够促进乳腺癌骨转移,与通过转移miR-21到破骨细胞形成转移前生态位有关[8]。microRNAs可以调节蛋白表达,在生长和化疗耐药性中发挥作用。此外,外泌体通过与目标细胞膜的融合启动细胞与细胞之间的通信,传递包括miRNAs和蛋白质在内的功能分子。PAN等[9]证实,miR-221-3p在ADR耐药MCF-7细胞衍生外泌体中过表达可通过PI3K/AKT信号通路促进ADR敏感MCF-7(MCF-7/S)细胞的ADR耐药。CHEN等[10]证实吉非替尼敏感细胞中miR-7的表达明显高于吉非替尼耐药细胞。外泌体从敏感细胞向吉非替尼耐药细胞传递高表达的miR-7,逆转吉非替尼耐药。而且,miR-7的高表达与肺癌病人对吉非替尼治疗的强响应和较长的生存时间有关。SANTOS等[11]对miR-155的功能测定与耐药细胞的外泌体转移到受体敏感细胞中相对应说明外泌体可能部分通过miR-155的外泌体转移介导了对敏感细胞的抗性和迁移能力。
本研究首先从紫杉醇耐药乳腺癌细胞中提取外泌体,并将其与乳腺癌亲本细胞共培养,结果发现耐药细胞分泌的外泌体能够促进亲本细胞产生耐药表型。通过外泌体miRNAs测序分析发现其中miR-5585-5p在耐药细胞株和其外泌体中表达均升高。因此,在后续实验中,以耐药细胞SKBR-3/PR为研究对象,抑制miR-5585-5p的表达发现miR-5585-5p抑制剂能逆转耐药细胞的耐药性,抑制耐药细胞迁移并诱导其凋亡。随后,对miR-5585-5p进行标记后发现其通过外泌体进入到亲本细胞内,提取转染抑制剂组的外泌体,与未转染抑制剂组相比,抑制剂组乳腺癌细胞的耐药性降低,迁移能力降低,而细胞凋亡增多。
综上,耐药细胞可能通过外泌体递送其产生的大量miR-5585-5p至亲本细胞,并诱导亲本细胞产生耐药表型。但其中具体的机制和外泌体miR-5585-5p作为临床乳腺癌肿瘤标志的可行性还需进一步研究。
