基于德尔菲法的《突发传染病相关临床研究伦理审查及管理的特殊规范要求》研究*
2021-09-15杜严勇杨红荣陈海萍奚益群
周 萍,李 欣,杜严勇,杨红荣,唐 燕,陈海萍,奚益群**
(1 复旦大学公共卫生学院,上海 200032,zhouping@fudan.edu.cn;2 上海交通大学马克思主义学院,上海 200240;3 上海交通大学附属儿童医院/上海市儿童医院伦理委员会,上海 200062)
2014年西非暴发了埃博拉疫情,疫情中的伦理问题引起了世界卫生组织的关注,由此,2016年世界卫生组织发布了《传染病暴发伦理问题管理指南》[1](以下简称《指南》)。《指南》提出了传染病暴发期间的研究要解决的问题,包括“传染病暴发的情况如何影响研究方案的伦理审查”,要求研究注意“解决当地研究伦理审查和科学能力方面的局限性”“在时效性很强的情况下提供伦理审查”等。国际医学科学组织委员会(committee for the organization of medical sciences,CIOMS)与世界卫生组织(WHO)联合制定了《涉及人的健康相关研究国际伦理准则》(2016年版),其中第20条“在灾难与疫情暴发下的研究”指出“卫生官员与研究伦理委员会应当建立为保证适当、便捷与弹性机制的程序,以及伦理审查与监管的程序”,第23条“建立研究伦理委员会及伦理审查规范的要求”强调研究伦理委员会必须根据准则中规定的原则审查研究方案。2020年1月28日英国纳菲尔德生命伦理委员会发布了《全球卫生突发事件相关研究的伦理问题》[2],提出受突发卫生事件影响的国家和相关的其他国家研究项目要进行独立的伦理审查。在突发事件中,“审查的标准也不应有任何形式的妥协,但审查的程序则可以且应该根据实际情况进行调整”。周吉银等[3]起草了《突发传染病临床研究伦理审查专家共识》(2020年),基于新冠肺炎疫情,首次明确了关于突发传染病临床研究伦理审查的范围和要点。2020年,国家药监局药审中心发布了《新冠肺炎疫情期间药物临床试验管理指导原则(试行)》[4],规定了新冠肺炎药物的临床试验管理以及其他在研药物的临床试验管理。
回顾国内外近年来医学相关伦理准则、指南等,尚无完备的符合突发传染病相关临床研究伦理审查及管控的特殊伦理规范。课题组通过对2020年1月23日至4月20日间在中国临床试验注册中心和clinicaltrials.gov上注册的新冠肺炎相关临床研究的回顾整理发现,我国关于突发传染病相关临床研究的伦理审查,尚未针对有限临床研究资源的分配及使用、临时性医疗救治点或尚未备案的医疗机构参与临床研究的管理、多中心临床研究的质量控制、适应突发传染病事件期间临床研究管理要求的特殊伦理审查机制的建立、突发传染病相关临床研究的特殊伦理审查要点等。本文运用德尔菲专家咨询法,提出突发传染病相关临床研究伦理审查及管理的特殊规范要求,为推进疫情防治药物研发的规范性提供决策参考。
1 资料来源与方法
1.1 专家的选择
课题组邀请了来自上海市和其他省市医学伦理专家、药物临床试验管理专家、科研管理专家及公共卫生专家等30名。
1.2 专家咨询表的研制
基于文献评阅、前期关键知情人深入访谈、专家咨询,课题组研制了突发传染病相关临床研究伦理审查及管理的特殊规范要求专家咨询表初稿。主要内容有3个部分:①指导语:包括研究目的、研究内容、问卷填写要求、问卷回收方式及课题组信息等;②个人基本情况:包括年龄、性别、学历、专业背景、职称、熟悉程度、判断依据等;③问卷主体部分:由政府层面可采取措施、伦理审查关注要点、伦理委员会管理共3个一级指标、22个二级指标以及43个三级指标组成。
1.3 指标评价及筛选方法
专家对相关问题的判断和熟悉或关注程度对于专家意见的可靠性有相当大的影响,对这两个指标进行量化,量化值见表1、表2。

表1 判断依据及其影响程度量化表
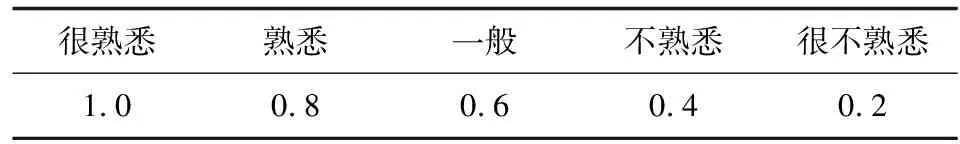
表2 专家对问题熟悉程度情况
采用指标重要性评分均值、变异系数结合专家意见进行指标的筛选、修改和确定,即指标筛选参考专家建议并以同时满足适合度赋值均数≥4且变异系数<0.25(指标的评分为四分位间距)两项指标为纳入标准。每个条目采用Likert 5 级计分法,邀请专家根据条目重要性进行评分(各项指标按照重要度分为非常重要、重要、一般、不重要、非常不重要,依次赋予5、4、3、2、1的分值),并在每个条目后留有一行意见栏,用于专家填写具体建议,为指标的筛选提供参考。
1.4 统计学方法
采用 Excel 2016录入并分析数据,计算专家积极系数、权威系数、协调系数的卡方检验、变异系数、集中程度算术平均数等。以P<0.05 为差异有统计学意义。
2 结果
2.1 专家基本情况
本研究邀请了30名来自不同地区和不同领域的专家,最终有29名专家参加本次专家咨询工作。专家的基本情况见表3。

表3 专家基本情况表
2.2 专家积极系数及权威程度
本研究开展了两轮专家咨询,第一轮、第二轮专家咨询问卷有效回收率分别为96.7%、100%,说明绝大多数专家关心本研究,参与的积极程度高。专家权威程度由判断系数(Ca)和熟悉程度系数(Cs)共同决定的,权威系数(Cr)为判断系数与熟悉程度系数的算术平均值,本研究专家权威程度的平均值为0.84(见表4)。专家权威系数>0.7,说明专家对研究内容的权威程度较高,可认为咨询结果较可靠。

表4 专家权威程度
2.3 专家意见的集中程度和协调程度
专家意见的集中程度用各指标重要度赋值的算术平均数表示,第一轮和第二轮专家咨询各指标的算术均数都大于4,说明指标的可行性很大。
专家意见的协调程度用协调系数和变异系数来反映。本研究第一轮和第二轮专家咨询的专家协调系数分别为0.101和0.279,说明两轮专家意见尽管有差异,但是均有一致性的趋向,P<0.001,说明两轮专家咨询意见一致性的趋向具有显著意义(见表5)。因此,本研究的两轮专家意见协调性好,结果可取。第一轮专家咨询各指标的变异系数均小于0.25,第二轮专家咨询各指标的变异系数均小于0.26,说明专家对各指标的协调度较高。

表5 两轮德尔菲专家意见协调系数比较表
2.4 构建《突发传染病相关临床研究伦理审查及管理的特殊规范要求》
通过文献评阅和专家咨询多次论证确立了《突发传染病相关临床研究伦理审查及管理的特殊规范要求》(以下简称《特殊规范》)的指标体系,包含3个一级指标、21个二级指标以及36个三级指标(见表6)。

表6 《突发传染病相关临床研究伦理审查及管理的特殊规范要求》

续表
3 讨论
3.1 《特殊规范》的构建具有重要的现实意义与迫切需求
突发传染病事件一般涉及范围广、影响程度大。突发传染病相关临床研究必须以科学、严谨、可靠的数据和结论作为研究依据。钟南山院士提出“临床研究可以加快绿色通道,但必须走程序,临床研究开展前要通过伦理审查。”但是,目前我国还没有完备的突发传染病相关临床研究伦理审查及管控相关伦理规范,不利于突发传染病相关临床研究的有效开展,因此,构建该类研究伦理审查特殊规范要求的重要性、紧迫性毋庸置疑。
3.2 本次专家咨询结果的权威性与可靠性均较高
本次研究两轮问卷回收率分别为96.7%、100%,说明专家对本研究的积极性很高。本次研究专家权威系数为 0.84,说明专家评价的权威程度较高,咨询结果可信。第一轮和第二轮专家咨询的专家协调系数分别为0.101和0.279,P<0.001,说明两轮专家咨询意见一致性的趋向具有显著意义,故本研究两轮专家意见协调性好,结果可取。最终纳入的指标重要性评分均值较高且专家意见集中度高(X>4.0,CV<0.25),说明指标的可行性很大,本研究结果权威性和可靠性均较高。
3.3 《特殊规范》整体框架与核心内容概览
本文基于德尔菲法,从政府层面可采取措施、伦理审查关注要点、伦理委员会管理三个维度构建突发传染病相关临床研究伦理审查及管理的特殊规范要求的指标体系。
政府层面可采取措施维度从修订法规、建立相关工作指南或特别规范两个方面阐述政府应加强突发传染病相关临床研究伦理审查及管理的法规和制度建设。伦理审查关注要点维度从临床研究开展先决条件、临床研究资质要求、科学合理的研究方案、数据与安全监察委员会、风险与受益的合理权衡、坚持生命伦理、弱势群体、确保充分知情同意、保护受试者个人隐私、生物样本的合理储存10个方面阐述针对突发传染病相关临床研究的伦理审查特殊关注要点,为伦理委员会在审查该类研究时有据可依,更具操作性。伦理委员会管理维度从提高伦理委员会审查能力、制定伦理审查SOP、加快审查机制的建立、伦理审查模式、独立顾问、远程会议审查、跟踪审查、临床研究项目注册与备案8个方面阐述针对突发传染病相关临床研究的伦理委员会的特殊管理要求。
3.4 《特殊规范》的作用展望
突发传染病相关临床研究伦理审查及管理的特殊规范要求是对我国已经出台的伦理审查、临床试验管理,特别是新冠肺炎疫情期间临床试验管理相关法规规范及指导原则的有效补充。该《特殊规范》将在突发传染病事件期间,为政府相关主管部门、伦理委员会、研究者等相关人员提供具有实际可操作性的伦理支持,为进一步促进突发传染病事件期间临床研究的规范开展提供决策依据。
