超声造影在体表复杂动静脉畸形射频消融中的价值研究
2021-09-15周洪珍邰茂众于德新通讯作者
周洪珍,邰茂众,于德新(通讯作者)
(1山东大学临床医学院 山东 济南 250000)(2临沂市肿瘤医院超声医学科 山东 临沂 276000)(3临沂市肿瘤医院省级血管瘤脉管畸形专科 山东 临沂 276000)(4山东大学齐鲁医院放射科 山东 济南 250000)
动静脉畸形(arteriovenous malformations, AVMs)是由发育异常的动、静脉直接吻合而形成,二者之间存在着不同程度的异常交通,常常缺乏毛细血管[1]。该病多发于颌面颈部,其次是四肢和躯干,并随个体发育而逐渐增长,可因外伤、体内激素变化或不恰当治疗而在短期内迅速生长[2-3]。目前其治疗较为棘手,常用的方法有手术、栓塞、硬化剂注射等,弥漫性复杂病例效果更差[4]。近年来,射频消融术被广泛应用于良、恶性实体肿瘤的微创治疗,取得显著的效果[5-7],并逐渐应用于脉管性疾病的临床治疗[8]。
超声由于操作方便、可实时监测而成为射频消融的主要引导手段之一;但常规超声对病变的定位诊断、消融后病灶的疗效评估和残留的鉴别方面存在一定的局限性[9-10];往往要依靠增强CT/MRI进行评估。在肝癌射频消融治疗中,超声造影(contrast enhanced ultrasound, CEUS)已被证实能弥补常规超声的不足,提高了超声在射频治疗各阶段的应用价值,为治疗方案的制定和疗效的评估提供了影像学依据[10]。基于上述原因,我们将超声造影运用于体表复杂动静脉畸形射频消融前后的评估中,探讨该技术在病变的定位及疗效评估中的价值。
1 资料与方法
1.1 一般资料
选取2015年12月—2020年12月在临沂市肿瘤医院治疗的38例体表复杂动静脉畸形患者的临床资料进行回顾性分析,本研究选取的病例按照其患病史、症状和体征、实验室与影像学的检查手段被确诊为动静脉畸形,符合国际脉管性疾病研究学会(ISSVA)所规定的动静脉畸形的诊断标准。其中男24例,女14例,年龄5~45岁,中位年龄21岁。病变的位置包括:颌面颈部22例,躯干部8例,四肢8例。病变范围均为弥漫性,从皮肤到黏膜呈贯通性受累,病变面积(10 cm×4 cm×2 cm)~(28 cm×20 cm×5 cm)。采用常规超声(高频超声+多普勒超声)进行监测的20例患者作为常规组,采用常规超声联合超声造影技术监测的18例患者作为联合组。两组患者一般情况及瘤体大小差异均无统计学意义(P>0.05),具有可比性。13例患者之前均接受反复栓塞、硬化或手术等多次治疗,效果不佳或无效,病变持续进展;合并口腔、鼻腔内病变出血者5例,溃疡不愈合者3例。本研究治疗方案、技术获医院伦理委员会论证、批准(批号:KY201905);患者或其监护人签署书面治疗知情同意书和超声造影知情同意书。
1.2 方法
1.2.1 仪器设备
采用CC-1-220型射频消融系统(Valleylab公司,美国),配套专用冷循环泵,Cool-tip射频消融针(电极),针尖裸露2 cm,配套专用皮肤电极。实时监测采用LOGIQ E8彩色超声诊断仪(GE公司,美国),配有超声造影功能,使用3~12L和9L线阵高频探头,频率3~15 MHz。造影剂采用上海博莱科信谊药业有限责任公司SonoVue(声诺维),配置时以5 mL 0.9%氯化钠溶液溶解并振荡摇匀,形成白色的SF6微泡混悬液。
1.2.2 治疗方法
(1)所有病变术前均采用高频超声及彩色多普勒超声检查:对病变及其周围组织进行多切面扫查,观察病灶的二维及彩色多普勒超声特点,观察时注意双侧对比、探头加压对比。并记录病变的部位、边界、形态、内部回声、血流情况等。
(2)联合组病变超声造影检查:选定某一治疗区域行CEUS,尽量保持观察切面不变,快速推入配制好的造影剂混悬液1.0~2.4 mL,继而推注5 mL 0.9%氯化钠溶液,同时启动计时器,实时观察病灶的动态灌注情况,射频治疗前后进行对比。
(3)射频消融治疗:常规组采用高频超声及彩色多普勒超声检查结果定位,制定消融布针方案;联合组在回顾超声造影特征之后,评估病变的体积和解剖边界,以确定经皮穿刺的最佳穿刺点,制定消融布针方案。术中使用全身麻醉,在彩超引导下将射频消融针(电极)经皮斜行穿刺至瘤体后缘最远端,采用阻抗自动调节模式,在深部病变中心区域消融功率设定在80~120 W,较浅表或相对边缘病变消融功率设定在70~90 W。彩超实时监视下消融治疗,病变逐渐汽化至直径1.5~2.0 cm的梭形区域之后,边退针边继续消融,再回撤射频针向病变浅层呈放射状调整,与前次消融区域边缘相距1cm,继续消融,治疗结束消融针道后退针,压迫止血,换不同位置按上述方法进行消融;每次消融治疗时间50~70 min,平均60 min。联合组术后半小时CEUS评估消融效果,发现残留者,补充消融,再次造影确认无残留后结束治疗。对于病变范围较大的病例,进行选择性分期治疗,间隔时间为3个月。
1.3 疗效评价
最终疗效评价采用客观影像学指标,以末次治疗结束后3个月行增强CT或CTA,评估病变的体积缩小情况,参照Achauer[11]等提出的4级分级标准:Ⅰ级(差):瘤体缩小0~25%;Ⅱ级(中):瘤体缩小26%~50%;Ⅲ级(好):瘤体缩小51%~75%;Ⅳ级(优):瘤体缩小76%~100%。Ⅲ、Ⅳ级评定为治疗有效,Ⅰ、Ⅱ级为治疗无效,有效率=(Ⅲ级+Ⅳ级)例数/总例数×100%。
1.4 统计学方法
应用SPSS 19.0统计学软件对本研究出现的数据进行统计分析。计量资料采用(±s)的形式表示。两组间比较采用独立样本t检验,分类参数采用卡方检验,以率(%)表示,P<0.05表示差异具有统计学意义。
2 结果
2.1 联合组射频术前、术后半小时、术后3个月超声造影特点
AVM病变动脉期早于周围组织强化,呈快速均匀性或不均匀性高增强,静脉期快速退出,在时间上表现为“快进快出”的现象。射频治疗术后病变消融完全造影表现为:主瘤体中心未见造影剂充填,或仅见点条状造影剂与周围正常组织同步进入、退出。射频治疗术后病变残留造影表现为:部分区域呈团片状高增强,并快速退出,呈“快进快出”。
射频术前AVM病变造影剂开始灌注时间快于周围组织,达峰时间早于周围组织,峰值强度高于周围组织,能分辨病变与周围组织,术前定位准确,达94.4%(17/18),优于常规组65.0%(13/20),差异显著;射频术后半小时畸形病变的达峰时间不同程度延长,峰值强度显著降低,与术前相比差异显著;射频术后3个月畸形病变的达峰时间基本保持稳定,峰值强度略有下降,与术后半小时相比没有明显改变。
2.2 两组治疗次数和临床疗效比较
通过超声造影发现联合组8例患者共16次射频治疗后半小时评估时有残留病灶,再次行消融治疗。联合组患者治疗总次数显著少于常规组(P<0.05);联合组有效率显著优于常规组(P<0.05);常规组超声评估有效率85.0%(17/20),与增强CT或CTA评估有效率70.0%(14/20)有较大差异,但未达到显著水平(P>0.05),联合组超声评估有效率94.4%(17/18),与增强CT或CTA评估没有显著差异(P>0.05)。
表1 两组患者治疗次数和治疗后临床疗效评价(±s)[%(n/m)]
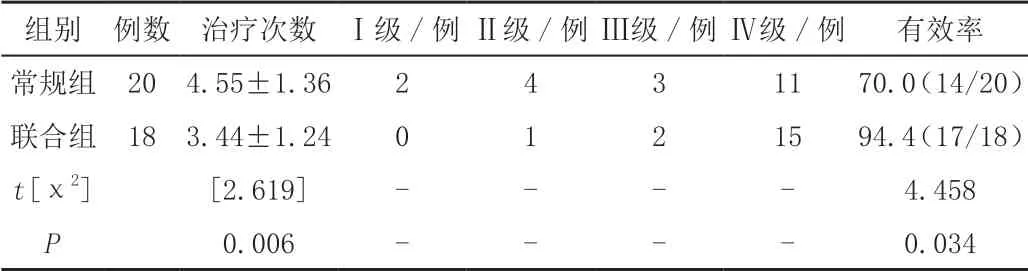
表1 两组患者治疗次数和治疗后临床疗效评价(±s)[%(n/m)]
组别 例数 治疗次数 Ⅰ级/例Ⅱ级/例Ⅲ级/例Ⅳ级/例 有效率常规组 204.55±1.362431170.0(14/20)联合组 183.44±1.240121594.4(17/18)t[χ2][2.619]- - - - 4.458 P 0.006 - - - - 0.034
2.3 两组不良反应和并发症比较
在整个治疗过程中,所有患者均未发现有过敏反应;常规组11例患者共19次射频治疗后出现发热,均经对症处理后恢复;8例患者共16次射频治疗后出现一过性血红蛋白尿,3d后消失;4例患者5次治疗后出现术后麻木,无活动障碍,营养神经对症处理后1个月恢复;1例患者第1次射频治疗后出现瘤体原破溃区组织坏死,出现颊部洞穿性缺损,后行带蒂斜方肌肌皮瓣修复后愈合。联合组8例患者共12次射频治疗后出现发热,对症处理后恢复;5例患者共9次射频治疗后出现一过性血红蛋白尿;2例患者第二次射频治疗后出现肢体麻木,无活动障碍,营养神经对症处理及功能训练后1个月恢复;两组间比较,没有显著差异。
3 讨论
动静脉畸形是一种先天性高流速血管畸形,临床治疗方法种类颇多,主要包括手术、介入栓塞、硬化治疗、射频消融等[4,12]。手术完整切除仅适用于相对局限的病变;对于弥漫性病变,不恰当的部分外科切除存在出血多、难度大、创伤大、溃疡及易复发等缺点;单纯栓塞或硬化治疗,病变暂时缓解后容易反弹,很难控制病变的进展。文献报道弹簧圈栓塞只能针对较大的动静脉分流,治疗后残余的大量动静脉瘘会加速进展[13]。本组有13例先前均在多家医院行多次栓塞、硬化或手术治疗,效果不佳或无效,病变持续进展,合并口腔、鼻腔内病变出血5例。经皮射频消融术(radio-frequency ablation, RFA)是近年来兴起的一种物理治疗手段,射频消融治疗体表脉管性疾病安全性高,疗效确切,我院在彩超监测下经皮消融治疗复杂静脉畸形和动静脉畸形,取得了良好的临床效果[14-15]。
动静脉畸形的治疗方法种类繁多,如何监测及客观评估疗效是动静脉畸形治疗中的一个重要课题。现阶段临床上常用的有超声、CT、MRI等,增强CT和增强MRI的评估价值得到了广泛认可,但其费用昂贵,无法实时监测,临床应用受限;超声由于操作方便、无辐射、可反复多次动态观察而成为射频消融的首选引导手段[16],RFA后治疗区雾状高回声与消融后凝固坏死灶大小具有一定的相关性,并不能代表被消融坏死的区域,常规超声对消融区只能进行粗略的估计,不能作为术中疗效评估的有效方法。
超声造影(CEUS)现已成为最先进的超声诊断技术,相较于传统的CT与MRI,超声造影能够动态显示造影剂灌注的整个过程,能够有效地反映病变的血供特点及灌注特点,明确畸形病变的位置和范围,准确定位[17]。超声造影在RFA治疗肝肿瘤后疗效评价中取得了与增强CT相同的效果。本研究联合组AVM病变造影剂开始灌注时间快于周围组织,峰值强度高于周围组织,表明动静脉畸形病理学基础与周围组织明显不同。从增强时间来看,AVM动脉期早于周围组织强化,呈快速均匀性或不均匀性高增强,静脉期快速退出,表现为“快进快出”的现象,主要原因为存在大量的微动静脉瘘导致的相对低阻力有关,这与恶性肿瘤的“快进快出”现象相符合;不同部位、不同形态的AVM增强方式相同。CEUS技术在AVM的定位和定性诊断中起着关键作用,有利于临床诊断和治疗方式的选择。
本组研究发现,复杂动静脉畸形均采用分期消融治疗(间隔3个月左右),其优点是既能保留少量血供维持正常的生理功能,防止肢体缺血或溃疡,又能有效闭塞瘤体中心部位供血,使病变逐渐缩小,而局部的形态、功能基本不受影响。所有患者射频治疗中,超声动态监视下病变组织产热气化、空化、凝固,肉眼可见病变局部皱缩、塌陷,呈“橘皮样”改变,局部触摸变硬,结束治疗;联合组RFA后半小时行超声造影:18例患者46次RFA后畸形病变的达峰时间不同程度延长,峰值强度显著降低,这意味着治疗区的血流灌注明显减少,这也与文献中射频消融能有效损毁病变的瘤体和血管相吻合[6-8];8例患者共16次RFA后病变边缘仍有残留病变,进行了补充消融,再次造影后病变消融完全,结束治疗;联合组RFA后3个月行超声造影:18例畸形病变的达峰时间基本保持稳定,峰值强度略有下降,与术后半小时相比没有明显改变。联合组有效率94.4%显著优于常规组的70.0%。常规组常规超声与增强CT或CTA在评估疗效时有较大差异,但未达到显著水平,联合组常规超声联合超声造影与增强CT或CTA在评估疗效时没有明显差异。
总之,CEUS技术应用于体表复杂动静脉畸形射频消融中,术前指导定位、术中靶向治疗、术后即时评估,发现残留病变,及时补充消融,有效减少了治疗次数,最大限度地避免损伤周围重要的血管、神经及正常组织,提高了消融疗效。继增强CT、增强MRI之后,CEUS技术成为射频治疗后近期及远期疗效评估的另一种有效手段。
