乳腺腺样囊性癌7 例临床病理特征分析
2021-09-14许勇刚王文娟蔡子浩
许勇刚,唐 峰,邵 杰,王文娟,蔡子浩
乳腺腺样囊性癌(Adenoid cystic carcinoma of the Breast,ACCB)是一种罕见的乳腺癌,发病率约占所有乳腺恶性肿瘤的0.1%[1]。 ACCB 临床主要表现为乳房局限性肿块,影像学特征不典型,腋窝淋巴结转移比例不足5%,局部复发及远处转移较罕见,预后佳[2]。 ACCB 形态学主要有 3 种构型:筛状、梁-管状和实体型,但常存在异质性,同一病例中不同的形态学多混合存在,固常规病理诊断有难度,易与其他类型的乳腺癌混淆。 据美国Connecticut 肿瘤登记处报道,约50%的乳腺腺样囊性癌均被误诊[3]。 虽然ACCB 分子分型主要是三阴性,但预后良好,与非特殊类型的三阴性乳腺癌区别很大[4]。国外ACCB 治疗方法包括肿块局部切除、单纯乳腺切除术后辅以放射治疗,而国内对其诊治不尽相同[5]。基于ACCB 病理形态的复杂性、分子分型的特征性,诊疗意见的不确定性,本研究总结了复旦大学附属华山医院收治的7 例乳腺原发性ACCB 患者的病例资料, 并结合相关文献对其临床病理学特征、治疗及预后情况进行分析,旨在加强对ACCB 的认识,为临床ACCB 诊疗提供参考。
1 对象与方法
1.1 对象 收集复旦大学附属华山医院2007 年1 月 ~2019 年12 月收治的 7 例 ACCB 患者,临床诊断根据 2019 年世界卫生组织(WHO)发布的乳腺肿瘤分类和诊断标准[6]。
1.2 方法 术中标本经4%中性甲醛固定, 按常规取材、石蜡包埋、切片及HE 染色,挑选典型组织块行Envision 两步法免疫组织化学染色, 一抗包括 ER、PR、CerbB2、Ki-67、CK、p63、CD117,均购自北京中杉金桥生物技术有限公司。并复习每个病例的详细临床及病理资料。 患者随访日期自手术之日开始计算,截止至2019 年12 月31 日。
2 结果
2.1 临床资料 7 例ACCB 女性患者,年龄 49 ~ 86 岁,平均64 岁。 所有患者均因发现乳腺肿块就诊,其中2 例伴有乳房胀痛,6 例(85.7%)患者肿瘤位于左侧乳腺,1 例(14.3%)患者位于右侧;4 例患者行乳腺癌改良根治术,未发现腋窝淋巴结转移病例,1 例患者行乳腺癌保乳根治+前哨淋巴结活检术,2 例患者行肿块局部切除术,3 例患者给予术后辅助化疗。7 例患者均门诊定期复查,随访时间49 ~ 147 个月,中位随访时间65 个月。1 例仅行肿块局部切除术患者,术后49 个月时发现同侧乳腺肿块,影像学检查未发现转移证据,后失访。另1 例局部切除患者随访至术后50 个月时因心脑血管疾病去世,未发现肿瘤复发及转移证据。 其余5 例患者术后无局部复发和远处转移,随访期内无死亡,见表1。

表1 7 例ACCB 患者临床及随访数据
2.2 病理特征 大体检查:7 例患者肿瘤均呈结节状, 直径1.5 ~ 5 cm,平均2.4 cm,与周围乳腺组织分界相对清晰,未见明显包膜;切面均呈灰白色或灰黄色,质地中等或偏硬。
光镜检查:3 例ACCB 表现为混合型生长(图1A),肿瘤细胞呈筛状、梁-管状及实性排列;肿瘤细胞具有多种形态,表现为腺上皮、肌上皮和基底样细胞,大部分区域肿瘤性上皮条索及腺管内层为腺上皮,外层为肌上皮或基底样细胞。2例ACCB 表现为筛状型(图1B),筛孔形状大小各异,假腺腔内可见黏液样变间质;腺腔周围见胞质少、核圆形及具有核小仁的基底样细胞覆盖。 2 例ACCB 表现为实体型(图1C),肿瘤细胞绝大部分呈实性分布,肿瘤细胞异型性丰富,核分裂常见。
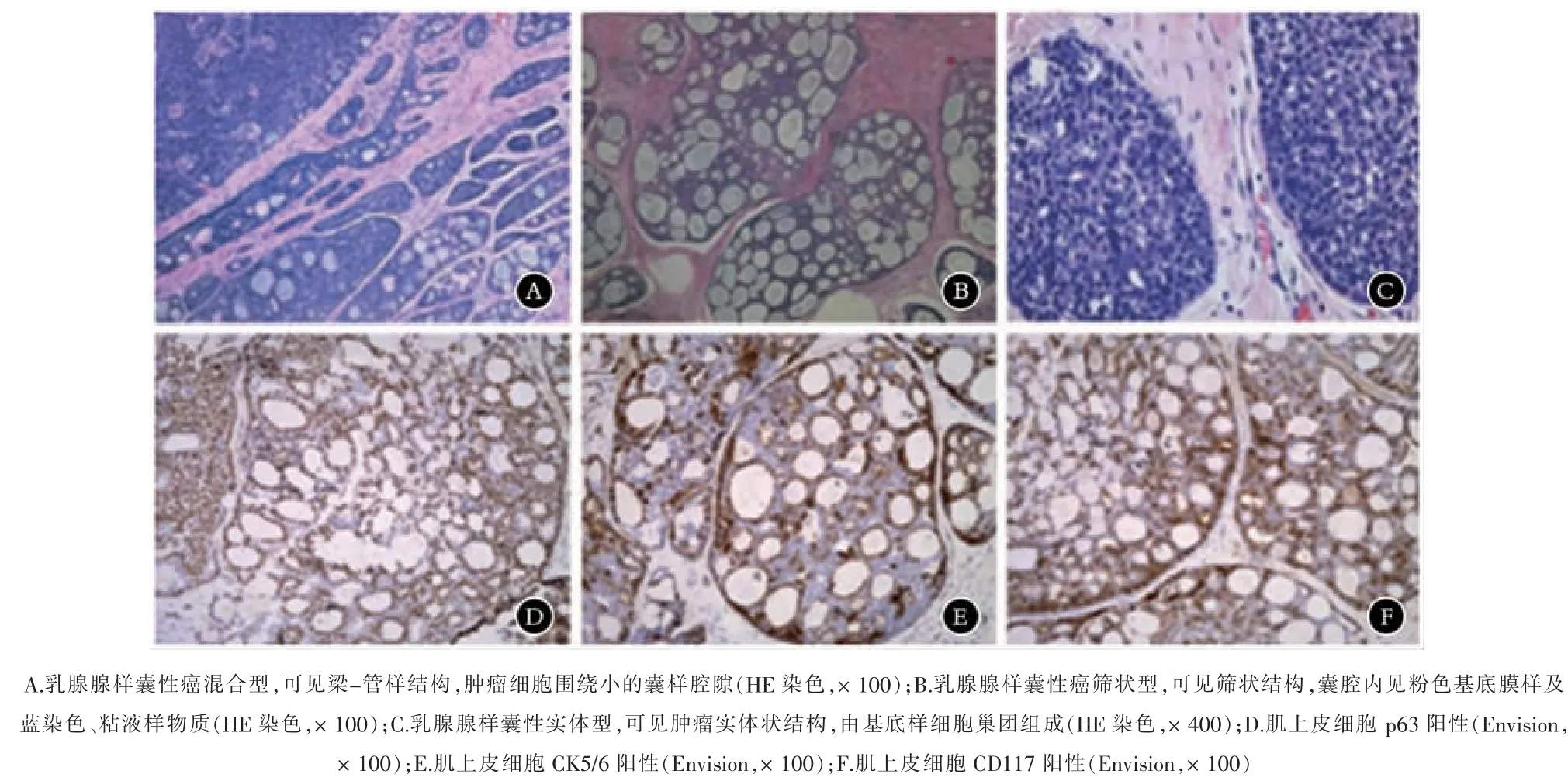
图1 乳腺腺样囊性癌HE 及免疫组化图像
免疫组织化学法:7 例 ACCB 肿瘤细胞均行 ER、PR、CerbB-2、Ki-67 检测显示, 肿瘤细胞 ER+者 3 例、PR+者 1例、CerbB-2+者 5 例, 其中 Luminal-A 型 1 例,Luminal-B 型2 例,三阴性型 4 例。 肿瘤细胞 Ki-67 不低于 30%者 3 例,不超过10%者4 例。肿瘤肌上皮细胞p63 阳性(图1D),肿瘤肌上皮细胞CK5/6 阳性(图1E),肿瘤肌上皮细胞CDll7 阳性(图 1F)。 见表 2。

表2 7 例ACCB 患者免疫组织化学染色结果
3 讨论
ACCB 通常表现为局限性疾病,在钼靶检查表现为边缘模糊或呈毛刺状的不规则或分叶状肿物;乳腺超声检查多表现为低回声实性、囊性或非均质低回声肿块;乳腺磁共振检查中,大肿块在T2WI 上表现为广泛长信号,内部常有低信号分隔,动态增强后肿物快速廓清。 而小的肿块在T2WI 上表现为等信号,且内部分隔并未见明显强化[2,7]。
ACCB 好发于右乳,然而本研究中7 例患者仅有1 例为右侧 ACCB。 本病腋窝淋巴结受累少见[8];与经典的 ACCB 相比,实体型且具有基底细胞特征的ACCB 腋窝淋巴结转移发生率较高[9]。 本组中4 例患者行乳腺癌改良根治术,均未发现腋窝淋巴结转移。
ACCB 的组织学类似于唾液腺样囊腺癌, 肿瘤常见有3种构型:筛状、梁-管状和实体型,这些结构常混合存在呈囊腺样改变,也可呈实性片状排列。 根据肿瘤实体成分所占比例的不同组织学可将其分为三级:筛状型或管状型不伴有实体成分者为I 级,伴有实体成分但实体成分比例< 30%者为Ⅱ级,有实体成分且实体成分≥30%者为III 级[10]。
既往认为 ACCB 属于 Basal-like 型, 通常不表达 ER、PR、CerbB-2,然而有文献报道显示其ER 阳性率为46%,PR阳性率 35%[4,11]。 本研究 7 例患者中肿瘤细胞 ER+者 3 例、PR+者 1 例、CerbB-2+者 5 例, 其中 Luminal-A 型 1 例,Luminal-B 型 2 例, 三阴性型 4 例, 这与既往文献报道显示ACCB 多为三阴性型相符合。
ACCB 具有复杂的结构模式,故诊断存在一定难度,应注意与以下乳腺疾病加以鉴别,(1)筛状型导管内癌:低级别筛状型导管内癌可形成与筛状型ACCB 类似的筛孔结构,一般需加做免疫组化检测,筛状型导管内癌属于导管内病变, 故导管外肌上皮标记一般为阳性,ER、PR 多为阳性表达。 (2)乳腺胶原小体病:镜下可见多灶分布的筛孔状结构,受累腺腔呈不同程度扩张。 特殊染色后筛孔中的小体AB-PAS 呈阳性, 而 ACCB 的小体结构仅显示PAS 阳性。(3)浸润性筛状癌:有典型的筛孔结构,由单一腺上皮组成,缺乏肿瘤性的肌上皮细胞及嗜酸性基膜样物质及透明小体。免疫组织化学检测 CD117、p63 和 SMA(-),ER 和 PR(+),可与ACCB 相鉴别。
基于ACCB 的低淋巴结转移率与良好的预后,国外治疗ACCB 多采用单纯手术(局部切除或单纯乳腺切除术),或手术联合放射治疗,多数医师不主张行腋窝淋巴结清扫术[5,12]。最近一项研究证实ACCB 保乳术后加行全乳放疗能够使患者总生存时间获益,然而值得注意的是该研究中保乳术后切缘阳性患者比率偏高,故术后联合放疗仍需谨慎选择[12]。 目前辅助化疗在ACCB 术后的作用仍然存在争议,通常仅在具有高危因素(肿瘤直径 > 3 cm、高级别、伴有淋巴结转移)或已发生远处转移的患者中采用[8,13]。 本组有 3 例患者术后接受辅助化疗,随访无1 例发生局部复发或远处转移。
有研究显示,ACCB 患者 10 年生存率超过 90%[11]。 本组7 例患者中,1 例仅行肿块局部切除术患者, 术后49 个月时发现同侧乳腺肿块,影像学检查未发现转移证据。 另有1 例行肿瘤局部切除患者随访至术后50 个月时因心脑血管疾病去世,但影像学检查未发现肿瘤复发及转移证据。 其余5 例患者术后无局部复发和远处转移,随访期内无死亡。 研究显示,ACCB 患者局部复发及远处转移不常见, 主要累及肺,其次是肝、脑、肾,皮肤和脊椎转移罕见,故在患者随访过程中,应注意胸部CT 检查的意义[8]。 值得注意的是即使患者术后出现局部复发或远处转移,其临床进程亦十分缓慢,且有继发其他类型恶性肿瘤的风险,与非特殊型浸润性乳腺癌转移模式存在很大差异。 因此明确ACCB 的术前与术中诊断非常重要,应努力避免误诊、漏诊,因其将直接影响术者手术方式的选择,同时与患者术后生存质量密切相关。
综上所述,ACCB 是临床罕见但预后相对较好的一类乳腺恶性肿瘤。 因其至今仍未获得最佳治疗共识,故临床医师应结合患者实际情况,选择最佳诊疗策略。 建议延长术后随访时间,并注意可能发生的远处转移及继发肿瘤的风险。
