电视胸腔镜结合加速康复外科理念用于肺癌根治术患者的价值
2021-09-14邢爱珠骆美镜陆裕富田维新
邢爱珠,骆美镜,陆裕富,田维新
随着电视胸腔镜技术的不断发展和完善,目前大部分开胸手术都能在胸腔镜的指导下完成,这一技术可将患者的胸腔清晰地显示在电子屏幕上, 因此术中具有清晰的术野,与传统开胸手术相比,电视胸胸腔镜手术还具有微创、痛苦较小、切口较美观等优势[1]。 但也有研究显示,术后不良反应和和并发症的发生情况仍比较多[2]。 因此,改善患者预后,加快患者恢复是目前临床研究的重点之一。 加速康复外科理念(enhanced recovery after surgery,ERAS)是指在患者围术期通过一系列优化处理措施,减轻患者的痛苦、改善手术效果和加强患者营养,达到加速患者康复的目地[3]。 本研究将120 例行电视胸腔镜肺癌根治术的患者作为研究对象, 观察ERAS用于肺癌根治术患者康复治疗的价值。
1 对象与方法
1.1 对象 选取文昌市人民医院2018 年1 月~2020 年1 月收治的120 例行电视胸腔镜肺癌根治术的患者为研究对象开展前瞻性研究, 以随机数表法将所有患者分为观察组(60例)和对照组(60 例)。 两组患者性别、年龄、体质量指数(BMI)、病程、病变部位和肿瘤分期等一般资料相比,差异无统计学意义(P >0.05),具有可比性。本研究已获得本院伦理委员会批准。 纳入标准(1)年龄≥18 岁;(2)根据 1996 年UICC 和 AJCC 肺癌病理分期标准为肺癌Ⅰ~Ⅱ期[4];(3)所有患者和其家属均对本研究知情,均已签订知情同意书。 排除标准(1)过往有肺部手术史;(2)有心肺功能不全或不能耐受单肺部通气麻醉等胸腔镜手术的禁忌证;(3) 有严重精神或心理疾病难以配合研究;(4)妊娠及哺乳期患者。
1.2 方法 观察组在ERAS 指导下进行治疗, 具体采取以下方法:患者住院后进行呼吸功能训练,有吸烟习惯的禁烟。帮患者制定呼吸功能训练计划,引导患者使用呼吸训练器锻炼呼吸功能,使用黏液溶解剂、支气管扩张剂或糖皮质激素等药物,使用雾化吸入方法进行气道管理。 术前对患者科普ERAS 方案的相关措施,提高患者的依从性,将麻醉和手术方式告知患者,减轻患者的恐惧和焦虑并公布出院标准,鼓励患者积极配合治疗。 术前6 h 禁食,术前2 h 禁水并口服250 ml 的碳水化合物饮料。 患者麻醉成功后留置尿管,并于麻醉效果减退、患者苏醒后移除。术前0.5 h 对患者使用抗生素,若手术时间超过3 h,再次使用抗生素。 选择半衰期短的麻醉药对患者进行全身麻醉,行电视辅助胸腔镜手术,进行淋巴结清扫,对患者进行保暖处理。 行中下叶切除术并留置16 号引流管延伸出观察孔,行上叶切除并留置8F 引流管延伸出操作孔。 术中进行限制性补液,采取血管活性药物升高患者血压。 控制术中补充的液体总量在1 L 以下。 术后为患者镇痛,以多种药物、多种麻醉方式联合的方式进行给药,对切口行局部浸润麻醉,使用非甾体抗炎药物和自控镇痛泵缓解患者疼痛。 术后早期(术后6 h)患者可进水或流食,术后1 d 早晨即可恢复正常饮食, 控制静脉补液在800 ml 以下。手术后24 h 后,可在医护人员指导下进行下床活动,每次可活动8~10 min,术后2 d 可以逐渐延长下床活动的时间。 为防止胸管被堵塞,可指导患者家属多次挤捏胸管。 若24 h 内胸腔引流量在200 ml 以下即可拔除胸管; 老年男性患者72 h 内拔除尿管,非老年的男性患者24 h 内即可拔除。
对照组按照传统管理模式进行治疗, 具体采取以下方法,患者入院后有吸烟习惯的戒烟,并进行常规呼吸功能锻炼,主治医师与其谈话,将手术方式、手术风险、和术后并发症等相关事项告知患者。术前12 h 禁食,术前6 h 禁水。术前留置尿管,并于术后24 h 后移除。 术前0.5 h 对患者使用抗生素,术后继续使用2 ~3 d。 术中对患者行全身麻醉后进行电视胸腔镜手术。 术中采用28 号引流管,无补液限制。 术后进行常规镇痛, 必要时可考虑使用阿片药物进行肌肉注射。术后24 h 患者可进食、进水,无补液限制,每天静脉补液2 000 ~ 2 500 ml, 持续 2 ~ 3 d。 术后鼓励患者尽早下床活动,但按照患者意愿进行。 术后24 h 内胸腔引流量在100 ml以下即可拔除胸管;3 ~5 d 后可拔除尿管。
1.3 观察标准 (1)两组围术期指标:记录两组患者手术时间、麻醉时间、胸管留置时间、尿管留置时间、术后下床时间、住院时间以及住院费用。 (2)两组治疗前肺功能和6 min 步行距离(6-min walking test,6MWD):分别于手术前 1 天和出院前评估患者用力肺活量(forced vital capacity,FVC)和第1秒用力呼气容积 (forced expiratory volume in one second,FEV1),并进行6 min 步行试验,记录患者 6 min 步行距离。(3)两组治疗前后不同时点炎症因子水平:采取患者清晨空腹静脉血4 ml,以离心半径15 cm、3 000 r/min 离心5 min,取上层清液并置于低温环境保存待检, 提前20 min 取出使其复温。采用酶联免疫吸附法检测白介素6(IL-6)、肿瘤坏死因子-α(TNF-α)、C 反应蛋白(C-reactive protein,CRP)的表达水平。 分别于手术前1 天、手术后3 天及手术后5 天进行检测。 (4)观察并记录两组患者手术后并发症的发生情况。
1.4 统计学处理 采用SPSS 22.0 统计学软件对数据进行处理,计量资料采用Shapiro-Wilk 法检验正态性,符合正态分布的以()表示,组间比较行t 检验;不符合正态分布的采用中位数(Min—Max)表示,组间差异比较采用秩和检验,计数资料以率或百分比(%)表示,组间比较行χ2检验,理论频数 <5 取校正卡方值。 以P < 0.05 为差异具有统计学意义。
2 结果
2.1 两组围术期指标比较 两组手术时间、 麻醉时间差异无统计学意义(P >0.05);与对照组相比,观察组胸管留置时间、尿管留置时间、术后下床时间、住院时间均更短,住院费用更低,差异均有统计学意义(P < 0.05)。 见表 2。
表2 两组肺癌患者围术期指标比较()
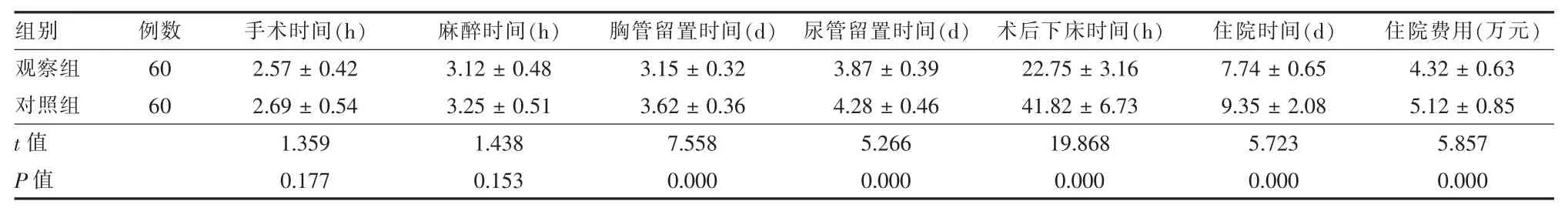
表2 两组肺癌患者围术期指标比较()
组别观察组对照组t 值P 值例数60 60手术时间(h) 麻醉时间(h) 胸管留置时间(d) 尿管留置时间(d) 术后下床时间(h)2.57 ± 0.42 3.12 ± 0.48 3.15 ± 0.32 3.87 ± 0.39 22.75 ± 3.16 2.69 ± 0.54 3.25 ± 0.51 3.62 ± 0.36 4.28 ± 0.46 41.82 ± 6.73 1.359 1.438 7.558 5.266 19.868 0.177 0.153 0.000 0.000 0.000住院时间(d)7.74 ± 0.65 9.35 ± 2.08 5.723 0.000住院费用(万元)4.32 ± 0.63 5.12 ± 0.85 5.857 0.000
2.2 两组治疗前后肺功能和6MWD 比较 两组治疗前FVC、FEV1、6MWD 水平差异无统计学意义(P > 0.05);与治疗前相比,两组治疗后,FVC、FEV1、6MWD 水平均有所降低,差异均有统计学意义 (P < 0.05); 与对照组相比, 观察组FVC、FEV1、6MWD 水平显著更高,差异均有统计学意义(P <0.05)。 见表 3。
表3 两组肺癌患者治疗前后肺功能和6MWD 比较()
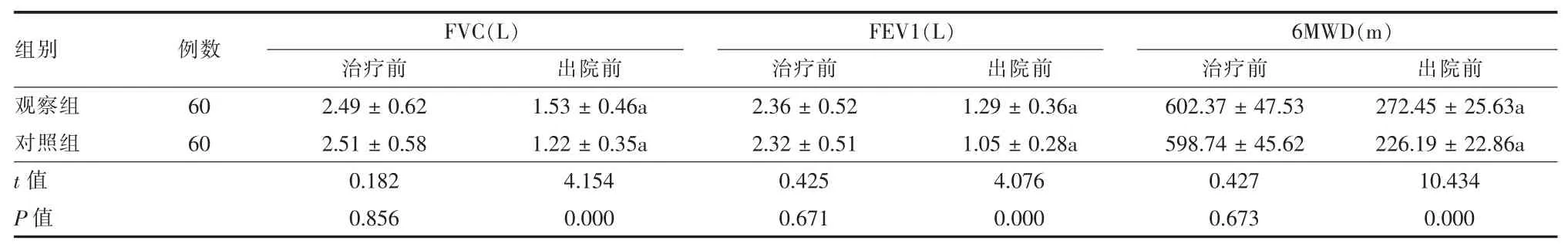
表3 两组肺癌患者治疗前后肺功能和6MWD 比较()
注:与同项目治疗前相比,aP <0.05
组别观察组对照组t 值P 值例数60 60 FVC(L) FEV1(L) 6MWD(m)治疗前 出院前 治疗前 出院前 治疗前 出院前2.49 ± 0.62 1.53 ± 0.46a 2.36 ± 0.52 1.29 ± 0.36a 602.37 ± 47.53 272.45 ± 25.63a 2.51 ± 0.58 1.22 ± 0.35a 2.32 ± 0.51 1.05 ± 0.28a 598.74 ± 45.62 226.19 ± 22.86a 0.182 4.154 0.425 4.076 0.427 10.434 0.856 0.000 0.671 0.000 0.673 0.000
2.3 两组治疗前后不同时点炎症因子水平比较 治疗前,两组 IL-6、TNF-α、CRP 水平差异无统计学意义(P > 0.05);与治疗前相比,两组治疗后 3 d IL-6、TNF-α、CRP 水平均有所上升,与治疗前和治疗后3 d 相比,治疗后5 d IL-6、TNF-α、CRP 均有所下降,差异均有统计学意义(P < 0.05);且与对照组相比,治疗后 5 d 观察组 IL-6、TNF-α、CRP 水平均低于对照组,差异均有统计学意义(P <0.05)。 见表4。
表4 两组肺癌患者治疗前后不同时点炎症因子水平比较(pg/ml,)
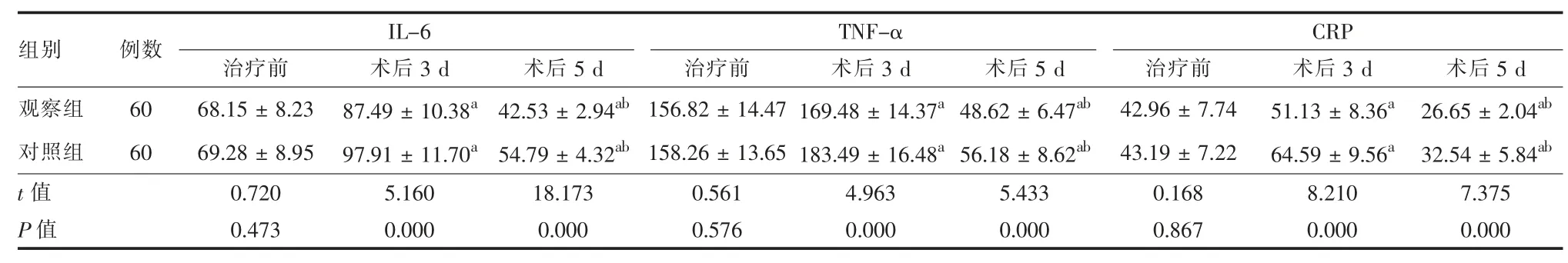
表4 两组肺癌患者治疗前后不同时点炎症因子水平比较(pg/ml,)
注:与治疗前相比,aP < 0.05;与治疗后 3 d 相比,bP < 0.05
组别 例数 IL-6治疗前 术后3 d 术后5 d观察组 60 68.15 ± 8.23 87.49 ± 10.38a 42.53 ± 2.94ab对照组 60 69.28 ± 8.95 97.91 ± 11.70a 54.79 ± 4.32ab t 值 0.720 5.160 18.173 P 值 0.473 0.000 0.000 TNF-α治疗前156.82 ± 14.47 158.26 ± 13.65 0.561 0.576 CRP术后3 d 术后5 d 治疗前 术后5 d 169.48 ± 14.37a 48.62 ± 6.47ab 42.96 ± 7.74 26.65 ± 2.04ab 183.49 ± 16.48a 56.18 ± 8.62ab 43.19 ± 7.22 32.54 ± 5.84ab 4.963 5.433 0.168 7.375 0.000 0.000 0.867 0.000术后3 d 51.13 ± 8.36a 64.59 ± 9.56a 8.210 0.000
2.4 两组治疗后并发症发生情况比较 治疗后,观察组并发症总发生率明显低于对照组,差异有统计学意义(P <0.05)。见表5。

表5 两组肺癌患者治疗后并发症发生情况比较[例(%)]
3 讨论
电视辅助胸腔镜手术对患者造成的创伤较小、患者疼痛较轻,因此恢复较快[5]。ERAS 的核心是采取多种措施降低患者的生理和心理应激反应,达到快速康复的目标,因此许多研究将二者结合,在胸腔镜手术中应用ERAS,加速患者恢复[6]。 本研究在此基础上采取了术前戒烟、引导患者进行系统性呼吸功能锻炼等方式改善患者的肺功能,并通过控制患者的补液量、使用多种方式联合镇痛、术后帮助患者下床活动等措施加速患者康复[7]。 过去许多研究的重点是ERAS 用于胸腔镜手术对患者围术期指标、 炎症反应和并发症的影响,本研究将在此基础上进一步观察ERAS 对患者术后肺功能和行动能力的影响。
本研究显示,与对照组相比,观察组胸管留置时间、尿管留置时间、术后下床时间、住院时间均显著更短,且住院费用显著更低,提示ERAS 用于胸腔镜手术可以缩短患者的康复时间、 降低患者的住院成本。 同时, 治疗后观察组 FVC、FEV1、6 MWD 水平均显著高于对照组,提示ERAS 在改善患者肺功能和行动能力方面的效果更好。术后当天观察组患者即在医护人员的陪同下开始下床活动,并在之后逐渐增加活动时间,这有利于改善患者的运动能力,并且随着时间的延长,患者的运动能力将会进一步提升,因此当病情恢复可以出院时,观察组在6 min 步行实验中行走的距离更远[8]。
本研究显示,与对照组相比,治疗后观察组IL-6、TNF-α、CRP 水平均显著低于对照组,提示ERAS 用于胸腔镜手术可以减轻患者的炎症反应。手术创伤、术后疼痛、术后感染等因素都可能使患者的炎症反应加强, 因此术后加速患者恢复、缓解患者疼痛、降低患者感染风险等措施都能够改善患者的炎症因子水平。 研究显示,手术后长期卧床会对下肢静脉回流造成影响,可能形成深静脉血栓,并且会增加肺部感染、肺不张的风险[9]。本研究中,在 ERAS 指导下,观察组患者术后当天即在医护人员的陪同下开始下床活动,之后逐渐延长活动时间,这样可以降低相关并发症的发生率和感染的风险,也有利于患者加速康复[10]。 根据ERAS,本研究使用镇痛泵、非甾体抗炎药物、局部浸润麻醉等多种方式联合镇痛,缓解患者疼痛,减轻炎症反应。
本研究显示,观察组的术后并发症总发生率(6.67%)明显低于对照组(20.00%),考虑可能与ERAS 指导下采取的一系列措施有关,手术创伤会在术后麻醉药效衰退时给患者造成强烈的痛感,加重患者的应激反应,许多患者因创口疼痛不愿下床活动或下床困难,部分患者因强烈的疼痛甚至难以用力咳嗽排出痰液,这会增加患者肺部感染的风险,因此缓解术后患者的疼痛是影响患者术后康复的重要原因之一[11]。此外,在ERAS 指导下,术中针对患者自身情况对其进行限制性补液,既能稳定机体循环、保障重要组织器官的有效灌注,也不易导致液体超负荷而引发肺水肿[12]。
综上,ERAS 用于肺癌根治术患者可降低并发症发生率、加速患者恢复、降低患者住院成本,具有推广价值。
