脂多糖对鲤肠上皮细胞转录组模式的调控分析
2021-09-14陈建军赵怡迪曹香林
陈建军 赵怡迪 曹香林
(1. 河南师范大学生命科学学院,新乡 453007;2. 河南师范大学水产学院,新乡 453007)
鲤是中国最重要的淡水鱼之一,营养丰富,肉质鲜美[1]。在水质恶化、饲料变质等情况下,以鲤为代表的吃食性鱼类易引发细菌性肠道疾病,从而阻碍了水产养殖业的可持续发展[2-3]。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁外膜结构的重要组成成分,因其是革兰氏阴性细菌的主要毒力因子,常用于致病机制的研究[4]。肠上皮细胞(intestinal epithelial cells,IEC)是肠道内外环境的媒介,又是机体免疫屏障的重要组成部分[5]。在开展环境细菌对鱼类肠道毒理学机理研究中,采用活体暴露方式,往往由于实验动物的个体差异,造成误差和不确切的结果[6]。因此,采用鲤肠上皮细胞培养方法,利用离体细胞开展机理研究更为 理想[7]。
转录组测序(RNA-seq)技术作为一种高效、快捷的转录组研究方法[8],能够反映细胞在某一特定环境和时间的基因表达情况,通过差异基因的表达分析和功能富集分析,挖掘功能基因[9]。吕钧惠等通过RNA-seq技术分析研究中国青鳉原代肝细胞中雌激素响应基因,并筛选出了105个显著差异基因(37个上调,68个下调)[10]。岳影星等[11]采用RNA-seq技术对脂多糖处理大鼠心脏微血管内皮细胞进行了转录组学分析,GO和KEGG富集的结果表明,上调基因与内皮细胞对炎性免疫细胞的趋化作用和黏附作用密切相关;而下调基因则是与钙离子信号和G蛋白相关通路以及内皮通透性增加有关。
本研究以鲤肠上皮细胞为实验对象,经脂多糖暴露24 h后,利用RNA-seq技术获得转录本后,通过差异基因的表达分析和功能富集分析,揭示脂多糖调控鲤肠上皮细胞差异基因的功能和通路。并利用实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)方法,验证转录组差异表达基因结果的可靠性。此研究有助于全面深入了解细菌对鲤肠道疾病发生发展的分子机制,为开展环境细菌的鱼类毒理学研究提供了重要的理论基础。
1 材料与方法
1.1 材料
鲤肠上皮细胞系IECs购自中国科学院上海细胞库;LPS L7770购自美国Sigma公司;MEM培养基和胎牛血清购自美国Gibco公司;0.25%含EDTA胰酶消化液和PBS缓冲液购自美国HyClone公司;青链霉素混合液、二甲基亚砜购自北京索莱宝公司;RNAiso Plus、cDNA 反转录试剂盒购自日本TaKaRa公司;UltraSYBR Mixture购自北京康为世纪公司。
CO2细胞培养箱(美国Thermo公司,型号:HERAcell 240 i);蒸汽灭菌锅(TOMY公司,型号:KG-SX-500);超微量分光光度计(Thermo公司,型号:NANODROP 2000);超净工作台(北京亚太克隆仪器技术有限公司,型号:BCL-定制型);超速低温离心机(德国SiGMA公司,型号:3K30);荧光定量PCR仪(罗氏生物科技公司,型号:LightCycler®96)。
1.2 方法
1.2.1 细胞传代与培养 鲤肠上皮细胞使用MEM培养基+10%胎牛血清+1%青链霉素混合液的完全培养基培养,待细胞生长至对数期时进行1∶2传代培养。取生长状态良好的鲤肠上皮细胞进行细胞计数,调整细胞数以5×106个/孔接种于6孔板中,待细胞贴壁后,对照组加入PBS缓冲液;脂多糖组加入LPS溶液使其终浓度为100 μg/mL(LPS溶液由PBS缓冲液配制);每组设置3个生物学重复,于28℃、5% CO2细胞培养箱中培养24 h采样。
1.2.2 RNA提取与文库构建 使用RNAiso Plus试剂对不同处理组的细胞进行总RNA提取,使用超微量分光光度计和安捷伦2100生物分析仪对总RNA的浓度、质量和完整性进行检测;检测合格的RNA样品构建测序文库,在上海欧易高通量测序平台Illumina Hiseq进行测序,获得Clean Reads数据。
1.2.3 基因注释与数据分析 利用hisat2将样本数据(Clean Reads)与鲤的参考基因组进行序列比对,用基因组注释文件对所获得的序列进行基因注释[12]。利用FPKM法计算基因表达量,设定参数(|log2fold change|>1且q-value<0.05)筛 选 差异表达基因[13-14]。采用Gene Ontology(GO)数据库和KEGG数据库对差异表达基因分别进行GO和Pathway富集分析[15-16]。
1.2.4 qRT-PCR验证差异基因 随机选取10个DEG,利用Oligo 7.0设计引物进行qRT-PCR以验证转录组数据的准确性(引物列表见表1)。具体的方法首先用RNAiso Plus提取细胞总RNA,将RNA按照反转录试剂盒说明书进行反转录,以获得cDNA为模板、β-actin为内参基因,采用LightCycler®96荧光定量PCR仪器进行qRT-PCR扩增,反应程序:95℃预变性10 min;95℃变性15 s,60℃退火60 s,45个循环;溶解曲线条件为:95℃ 15 s,65℃ 60 s,97℃ 1 s;冷却:37℃ 30 s。每个样品设置 3 次重复,采用2-△△CT计算各实验组差异基因的表达量及变化倍数(FoldChange),并对FoldChange值进行log2转化。

表1 qRT-PCR引物Table 1 Primers for qRT-PCR
1.2.5 统计学方法 使用SPSS16.0 软件通过单因素方差分析(one-way ANOVA)分析对照组和脂多糖组之间的差异。与对照相比,P<0.05被认为具有统计学显著性差异。
2 结果
2.1 转录组测序数据质量分析
转录组分析共计6个样本,包括对照组样本:CON_1、CON_2、CON_3;和脂多糖组样本:LPS_1、LPS_2、LPS_3。对照组和脂多糖组样品得到原始测序序列(Raw reads)均高于50.14M条,进一步对含有接头及低质量的Reads过滤得到Clean reads用于后续分析,共得到44.77G的Clean Data,GC含量46.50%-46.91%,Q30大于93.88%,其中,近81.83%的序列能够比对到参考基因组(表2)。此结果说明本次测序数据质量良好,可用于后续进一步生物信息学分析。
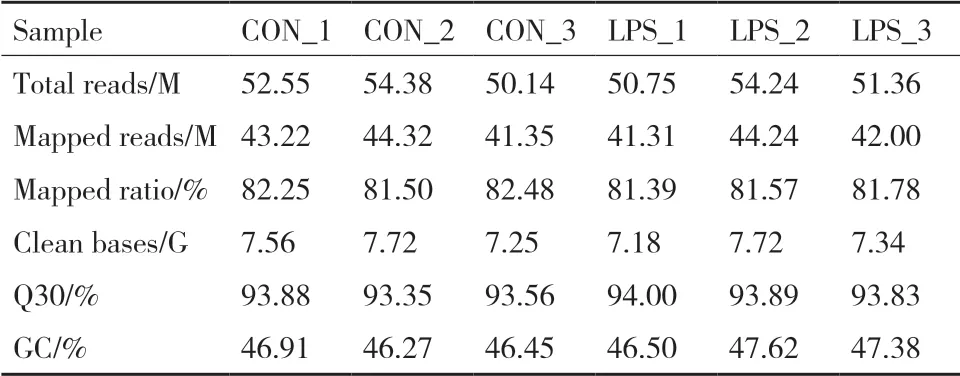
表2 转录组数据质量分析Table 2 Quality analysis of transcriptome data
2.2 转录组差异表达分析
按照DEG筛选标准(P<0.05且Fold Change>2),综合CON和LPS样本基因表达分析共筛选出590个DEGs,上调和下调分别有303个和287个(图1)。通过绘制火山图可以了解差异表达基因的整体分布情况,灰色为非显著性差异的基因,红色为显著性上调差异基因,绿色为显著性下调差异基因。
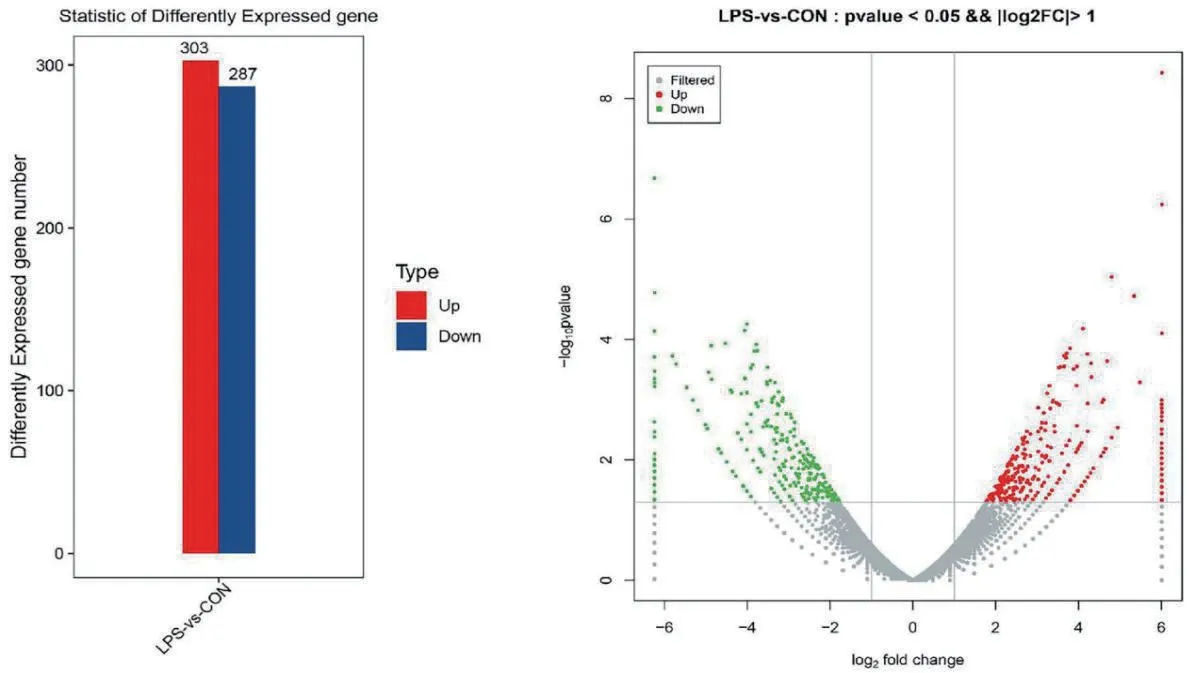
图1 差异表达基因统计柱状图及火山图Fig. 1 Statistical histogram of differentially expressed genes and volcano map
2.3 GO富集分析
GO分析表明,共有1 752个基因得到归类注释,涉及生物学过程(biological processes)、细胞组分(cellular components)及分子功能(molecular function)3大类,共59个亚类(图2)。在生物过程中共涉及23个亚类,DEG显著富集于细胞过程(cellular process)类别、其次为单有机体过程类别(single-organism process)及代谢过程类别(metabolic process)。在细胞组成中共涉及16个亚类,DEG显著富集于细胞(cell)、其次为细胞部分类别(cell part)及细胞器类别(organelle)。在分子功能共涉及20个亚类,结合功能类别(binding)DEG富集最多,其次催化活性功能类别(catalytic activity)及传感器活性功能类别(transducer activity)。上述GO功能富集分析表明,脂多糖参与调控鲤肠上皮细胞的生物学过程、细胞组分及分子功能。
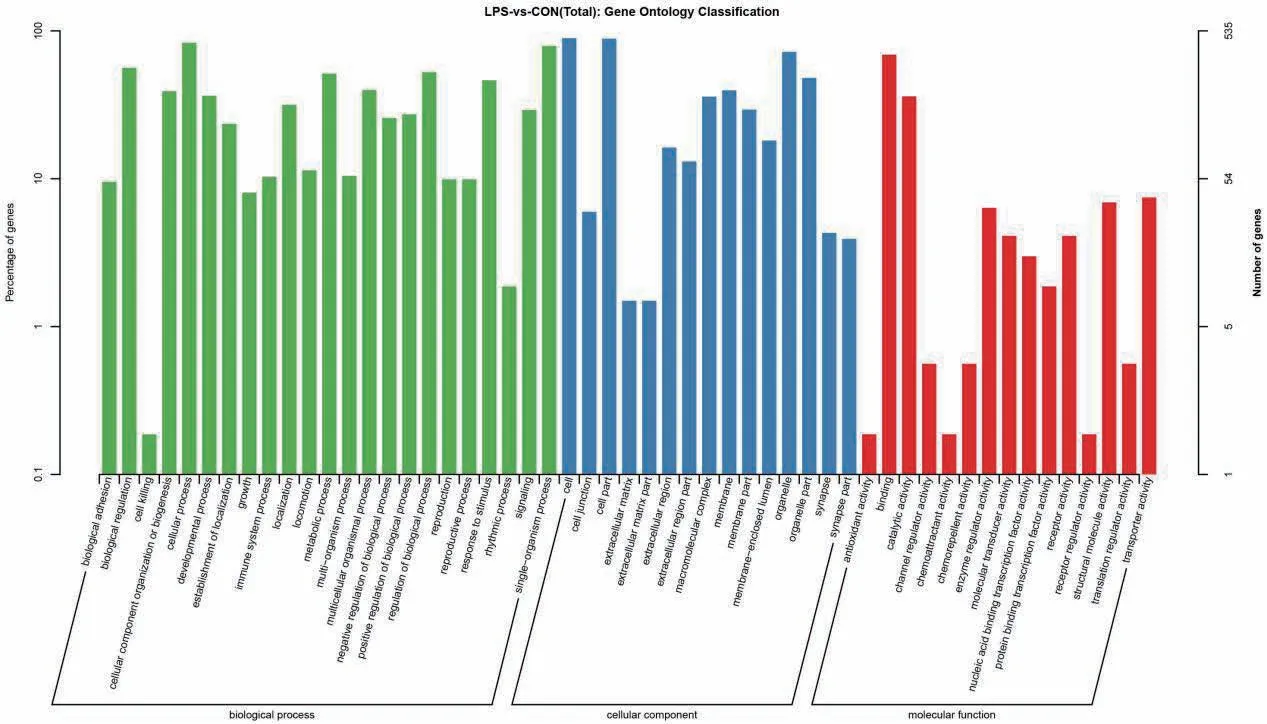
图2 差异表达基因GO分类Fig. 2 GO classification of differentially expressed genes
2.4 KEGG途径分析
KEGG途径分析表明,DEG被注释到106条通路途径中,其中KEGG富集的前20个途径,如图3气泡图所示。气泡越大的条目包含的差异蛋白编码基因数目越多,其富集P value值越小,显著程度越大。通过 KEGG分析表明,差异表达基因显著富集到细胞周期(cell cycle path:ccar04110)、自噬(autophagy path:ccar04140)、 凋 亡(apoptosis path:ccar04210)、mTOR信号通路(mTOR signaling pathway path:ccar04150)、P53信号通路(p53 signaling pathway path:ccar04115)、DNA复制(DNA replication path:ccar03030)、嘧啶代谢(pyrimidine metabolism path:ccar00240)、错配修复(mismatch repair path:ccar03430)、碱基切除修复(base excision repair path:ccar03410)、核苷酸切除修复(nucleotide excision repair path:ccar03420)等10个信号通路。我们发现脂多糖主要诱导鲤肠上皮细胞周期、自噬、凋亡通路途径。
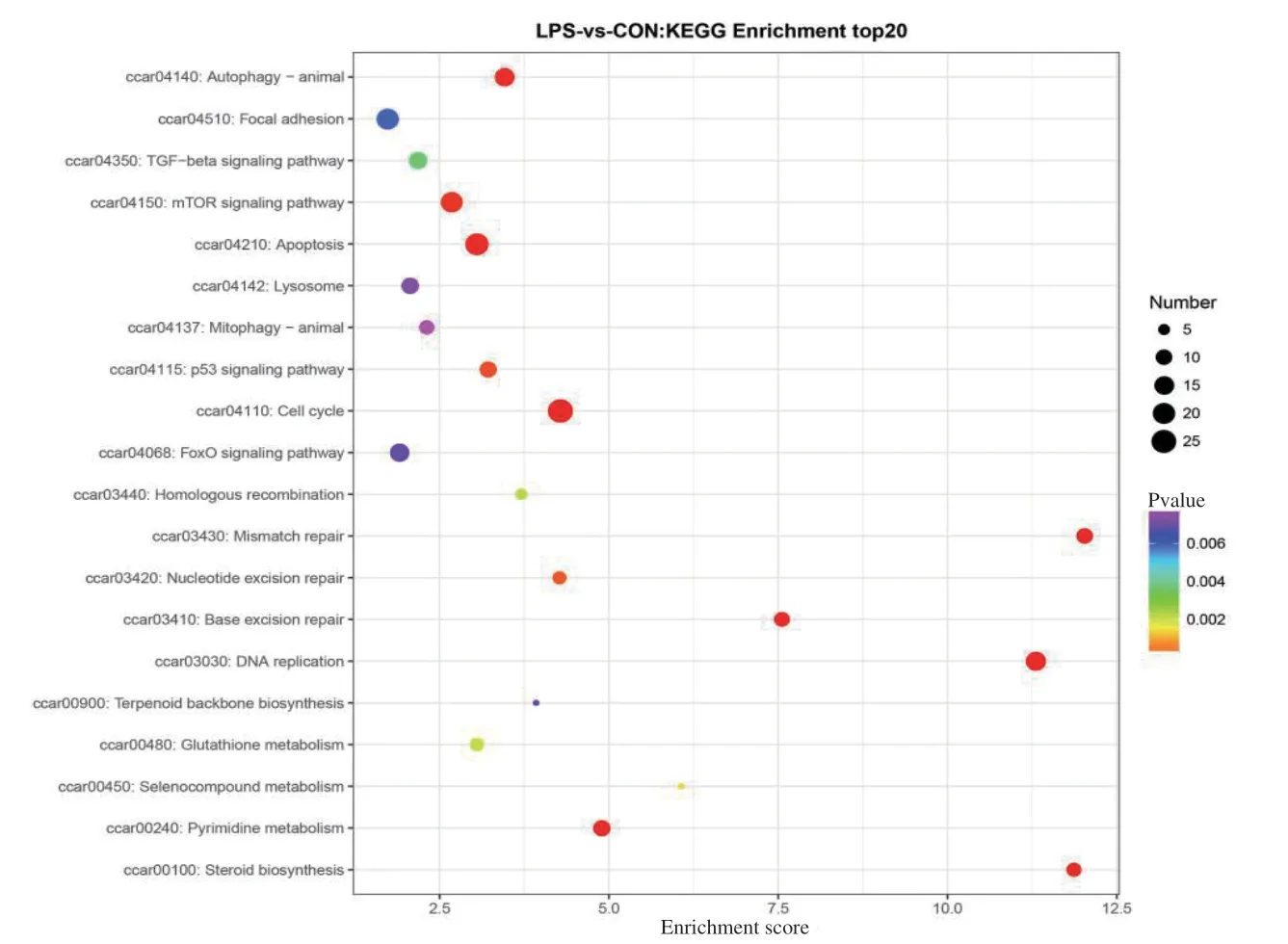
图3 差异基因显著富集的前20条KEGG信号通路Fig. 3 Top 20 KEGG signaling pathways with significant enrichment of different genes
2.5 自噬、凋亡、细胞周期的差异表达基因分析
KEGG代谢途径中与自噬、凋亡、细胞周期途径相关的差异表达基因,如表3所示。其中上调差异表达基因主要显著富集到自噬、凋亡;下调差异表达基因主要显著富集到细胞周期。转录组中注释到自噬途径中的LC3、BNIP3、ULK1、TP53INP2、LAMP、ATG16基因被诱导上调;转录组中注释到凋亡途径中的Casp9、Cathepsin、Gadd45、AP-1等基因被诱导上调表达,Lamin及PARP基因被诱导下调。此外,Gadd45基因在细胞周期途径中也被诱导上调;转录组中注释到细胞周期途径中PCNA、Cdc14、CycB、CDK2、MCM2、PLK1、TGF-β基因在脂多糖刺激过后显著下调。结果显示了LPS阻滞了鲤肠上皮细胞周期,诱导自噬,引起细胞凋亡。

表3 自噬、凋亡、细胞周期的差异表达基因Table 3 Differentially expressed genes of autophagy,apoptosis and cell cycle
2.6 qRT-PCR 验证基因表达
为验证转录组数据是否准确、可信,随机选取10个差异基因进行qRT-PCR检测。结果表明qRTPCR测定结果与RNA-seq测序结果得到的差异基因表达变化趋势一致(图4),表明本研究中基于RNA-seq测序得到的数据是可信的。
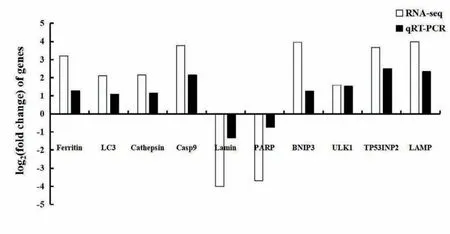
图4 qRT-PCR验证RNA-seq测序的结果Fig. 4 qRT-PCR validates RNA-seq sequencing results
3 讨论
肠道是鱼类重要的免疫消化器官,肠上皮细胞作为体内更新较快的一类细胞,在食物的消化、营养物质的吸收、保护机体免受微生物感染等方面发挥重要作用[17-18]。脂多糖作为细菌细胞壁的主要成分,是革兰阴性菌的主要毒力因子,可诱导细胞功能和结构损伤[19]。本研究通过转录组测序技术,全面、快速地获取脂多糖暴露于鲤肠上皮细胞过程中的所有转录本信息,系统地分析相关基因表达变化,为脂多糖调控的鲤肠上皮细胞分子机制提供理论依据。转录组测序共获得44.77 G高质量数据,其中,近81.83%的数据能够比对到鲤基因组。利用DESeq软件分析,与对照组相比,LPS处理可诱导差异表达基因590个,其中303个表达上调,287个表达下调。通过GO注释分析发现,鲤肠上皮细胞经LPS处理后,在细胞过程、单一生物过程、代谢过程、细胞、细胞组分、细胞器、结合和催化活性功能中发生了改变。KEGG 注释分析发现,DEG显著富集于细胞周期、自噬、凋亡等通路。注释丰富的转录组数据将为进一步分析脂多糖调控的鲤肠上皮细胞周期、自噬、凋亡通路基因提供重要的理论基础。
本研究发现脂多糖阻滞了鲤肠上皮细胞细胞周期进程,而细胞周期调控网络的异常与疾病的发生发展密切相关[20]。近年来的大量研究表明,Gadd45在DNA损伤时细胞周期检查点的调控、DNA修复和细胞凋亡中起了重要作用,维持着细胞基因组的的稳定性[21]。Gadd45对G2/M期检查点的调控主要是通过抑制Cyclin B/ CDK2复合物活性而实现 的[22-23]。DNA损伤诱导产生的Gadd45被转运入核后,解离Cyclin B/CDK2复合物,改变Cyclin B的亚细胞分布,使Cyclin B从核中输出,进入细胞质被泛素介导降解[24]。这样抑制了CDK2激酶的活性,并使细胞阻滞在G2/M转变中[25]。细胞周期的每个阶段都是被严格调控的,检查点的存在是为了检测潜在的DNA损伤,并允许在细胞分裂前修复[26]。如果损伤不能修复,细胞则会凋亡[27]。本研究发现,脂多糖通过诱导DNA损伤,增加Gadd45的表达从而抑制Cyclin B1/ CDK2复合物活性,阻滞鲤肠上皮细胞周期进程。
与此同时,本研究还发现脂多糖可诱导鲤肠上皮细胞自噬,引起细胞凋亡。自噬,是一种溶酶体降解反应,在饥饿和压力等恶劣条件下,可通过降解细胞蛋白、细胞器和细胞质,从而维持细胞的新陈代谢[28]。许多研究表明,在外界压力情况下,细胞通过BNIP3介导的自噬来对抗外界压力,维持生存;自噬受多种信号通路的调控,如AMPK/mTOR等信号转导通路,LC3在自噬信号通路中占有举足轻重的地位[29-30]。其中LC3可在TP53INP2的帮助下,从细胞核移位至细胞质完成脂质化修饰,参与自噬体的生成[31]。我们的研究发现脂多糖可以通过激活mTOR信号通路,诱导BNIP3和TP53INP2的表达促进LC3的转化来诱导自噬。另外,自噬在细胞存活,特别是细胞凋亡信号通路中起着重要作用[32]。细胞凋亡受到严格调控,在正常细胞中,Caspase处于非活化的酶原状态,凋亡程序一旦开始,Caspase被激活后发生凋亡蛋白酶的级联反应,从而导致细胞核(脱氧核糖核酸酶DNAse激活,PARP片段化),细胞骨架(lamin)和细胞代谢发生改变,发生不可逆的凋亡[33]。Lamin A/C和PARP是维持细胞正常功能和活力的基本核成分,有研究发现细胞毒性药物诱发的凋亡与Lamin及PARP两种核蛋白的降解呈正相关[34]。目前研究结果证明,脂多糖激活Caspase9,并且引起细胞凋亡和Lamin及PARP两种核蛋白的降解。细胞凋亡被认为是一个突出的病理特征,慢性疾病常伴随着许多细胞凋亡[35]。因此干预脂多糖诱导的鲤肠上皮细胞凋亡可能会延缓疾病进展并降低肠道疾病的发病率。
4 结论
本研究利用RNA-seq技术与生物信息学相结合,阐明了脂多糖阻滞鲤肠上皮细胞周期、通过诱导自噬引起细胞凋亡等一系列的毒性效应。本研究鉴定的DEG和信号传导途径将为研究和阐明养殖鱼类中的细菌感染性肠道疾病提供重要的理论基础。
