非常规酵母细胞工厂合成天然产物
2021-09-14叶敏高教琪周雍进
叶敏 高教琪 周雍进
(1. 中国科学院大连化学物理研究所生物技术研究部,大连 116023;2. 大连市能源生物技术重点实验室,大连 116023)
天然产物是一类来源于微生物或植物中具有活性的次级代谢产物,具有多种生物学功能,特别在抗癌、抗菌、抗炎症上发挥了关键作用,是药物的重要组成部分[1]。随着人们需求不断增加,迫切需要经济、可持续的大规模工业化生产供应。近年来,合成生物学与系统生物学等技术快速发展,使得利用微生物细胞工厂合成高附加值天然产物有望成为一种有效的替代方式。遗憾的是,目前大多关于天然产物生物合成的研究仍停留在实验室层面上,如何平衡外源代谢途径和内源网络提高生物合成效率仍然面临着巨大挑战[2]。
目前,最常用底盘细胞是模式生物大肠杆菌、酿酒酵母,其清晰的遗传背景和成熟的操作工具、调控手段等使得其广泛用于天然产物合成[3-5]。然而,大肠杆菌难以表达真核酶如P450,而酿酒酵母偏好生产乙醇影响产物得率。此外,二者需要温和生存条件,且底物利用范围有限,特别是近年来第三代原料生物转化倡导利用廉价的一碳资源[6],因此迫切需要拓展宿主范围。
近年来,非常规酵母由于其独特优势获得越来越多的关注。非常规酵母主要是指酿酒酵母和裂殖酵母以外的其他酵母,常见的包括解脂耶氏酵母、巴斯德毕赤酵母、多形汉逊酵母、乳酸克鲁维酵母等。而利用非常规酵母作为细胞工厂已经应用于合成多种产物[7],特别是羧酸化合物[8]与生物燃料等[9]。非常规酵母在发酵条件耐受性、广谱底物利用能力、高密度发酵上具有突出优势[10];此外,基因编辑技术和平台的不断发展[11],为非常规酵母细胞工厂构建提供了强有力技术支持。
本文系统总结非常规酵母合成天然产物(特别是萜类和黄酮类化合物)的研究进展,介绍了相关代谢工程改造手段和策略;并与模式微生物进行对比分析其作为细胞工厂的优劣势;最后介绍非常规酵母基因操作平台的发展及其合成更复杂生物碱等天然产物的潜力,并展望其未来发展的挑战和机遇。
1 非常规酵母
模式微生物如酿酒酵母具有清楚的遗传背景和成熟的遗传操作平台,在天然产物合成上取得了良好的进展[12-13]。然而,酿酒酵母面临耐受温度、有机溶剂的适应范围窄[10,14],可利用底物有限[14]等不足。另一方面,酿酒酵母Crabtree效应使得高密度发酵存在困难(图1)。寻求和开发其他酵母细胞,有望拓展酵母细胞工厂的应用潜力。
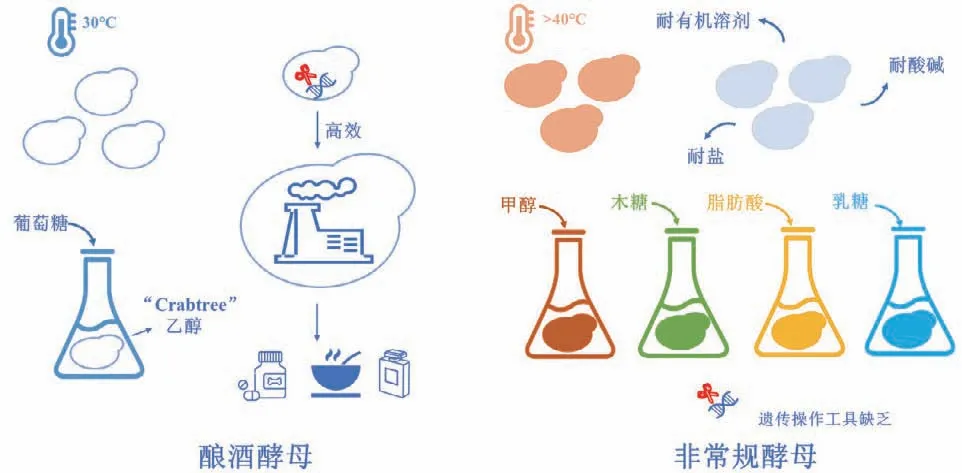
图1 酿酒酵母和非常规酵母优缺点比较Fig.1 Comparison between Saccharomyces cerevisiae and non-conventional yeasts
非常规酵母一般指除了酿酒酵母(Saccharomyces cerevisiae)和粟酒裂殖酵母(Schizosaccharomyces pombe)以外的其他酵母。目前研究最为广泛的非常规酵母是解脂耶氏酵母,其具有相对全面的基因组注释,因此更易于进行基因操作,在β-胡萝卜素类化合物、白藜芦醇、柚皮素生物合成上表现优越,超越了酿酒酵母中取得的产量。解脂耶氏酵母作为产油酵母,其优势在于细胞质中乙酰辅酶A和NADPH供给充足,有利于下游产物合成,其胞内脂质体能为长链疏水天然产物合成与储存提供疏水环境[15];特别是,解脂耶氏酵母能够以长链疏水脂肪酸作为唯一碳源,实现廉价原料的高效转化[16];并且和模式生物相比表现出较强的耐受性[17]。然而,解脂耶氏酵母生理特性的研究没有酿酒酵母深入,其培养大多采用丰富培养基[17-18],成本较高;此外,解脂耶氏酵母在合成更为复杂的天然产物如黄酮和生物碱的报道较少,可能是其外源途径的构建及与内源代谢的适配充满挑战。
除解脂耶氏酵母外,还有系列非常规酵母具备多种优良特性,有望成为构建细胞工厂的优良宿主[19]。比如:甲醇酵母(巴斯德毕赤酵母和多形汉逊酵母等)能够以甲醇作为唯一碳源,而甲醇的同化需要木酮糖-5磷酸(Xu5P)循环[20-21],因此其合成途径磷酸戊糖支路(PPP)效率很高,能够供应更多PPP中间体和NADPH,可能有利于黄酮类等天然产物的合成;汉逊酵母和毕赤酵母还都是工业上外源蛋白表达宿主,具有更类似高等生物蛋白翻译后修饰能力[22],对于外源酶的表达更有利;此外,汉逊酵母还能够耐受40℃以上的高温[23],在工业发酵上能够节约冷却成本。还有乳酸克鲁维酵母、树干毕赤酵母,分别能够利用乳糖、木糖;红发夫酵母具备天然虾青素合成能力,这些酵母都被GRAS认证且能够进行高密度发酵[14],具备合成多种天然产物的潜力。
尽管如此,目前在天然产物细胞工厂的构建方面,非常规酵母的研究还非常有限,主要原因在于基因操作平台不够完善,因而构建复杂天然产物合成途径相对困难。随着基因组测序技术、CRISPRCas9基因编辑平台以及合成生物学元件等的快速发展,非常规酵母将具有越来越大的应用潜力。
2 非常规酵母合成萜类化合物
2.1 萜类化合物合成
萜类是由异戊烯基为单元合成,包括单萜(C10)、倍半萜(C15)、二萜(C20)、三萜(C30)、四萜(C40)等,这一大类化合物通常包含抗癌、消炎、镇痛等药用效果,也常在化妆品、调味品、香精香料或食品中添加来修饰产品的色、香、味。萜类化合物是目前以非常规酵母作为细胞工厂研究最为广泛的天然产物。
酵母体内存在天然萜类合成途径——甲羟戊酸(MVA)途径,通过表达不同外源萜类合酶能够实现多种化合物合成(图2)。解脂耶氏酵母是优良的萜类化合物合成细胞工厂(表1),特别在合成诺卡酮、类胡萝卜素类化合物(C40,包括番茄红素、β-胡萝卜素、β-紫罗兰酮和虾青素)时,其产量甚至超过了模式生物。由于解脂耶氏酵母天然积累油脂,为这些长链化合物提供了良好的疏水环境,避免了细胞膜积累从而影响细胞活力[15]。研究表明通过增加细胞质脂肪酸合成能够促进番茄红素的积 累[15,24-25],证实细胞疏水环境对于长链萜类合成至关重要。在单萜柠檬烯和倍半萜紫穗槐二烯等的合成上,非常规酵母产量远远低于模式生物,可能是因为体内辅因子NADPH和ATP代谢不平衡[26]。另外,在发酵条件上,解脂耶氏酵母通常以复杂培养基(YPD)培养细胞[18,27-28],增加了生产成本。
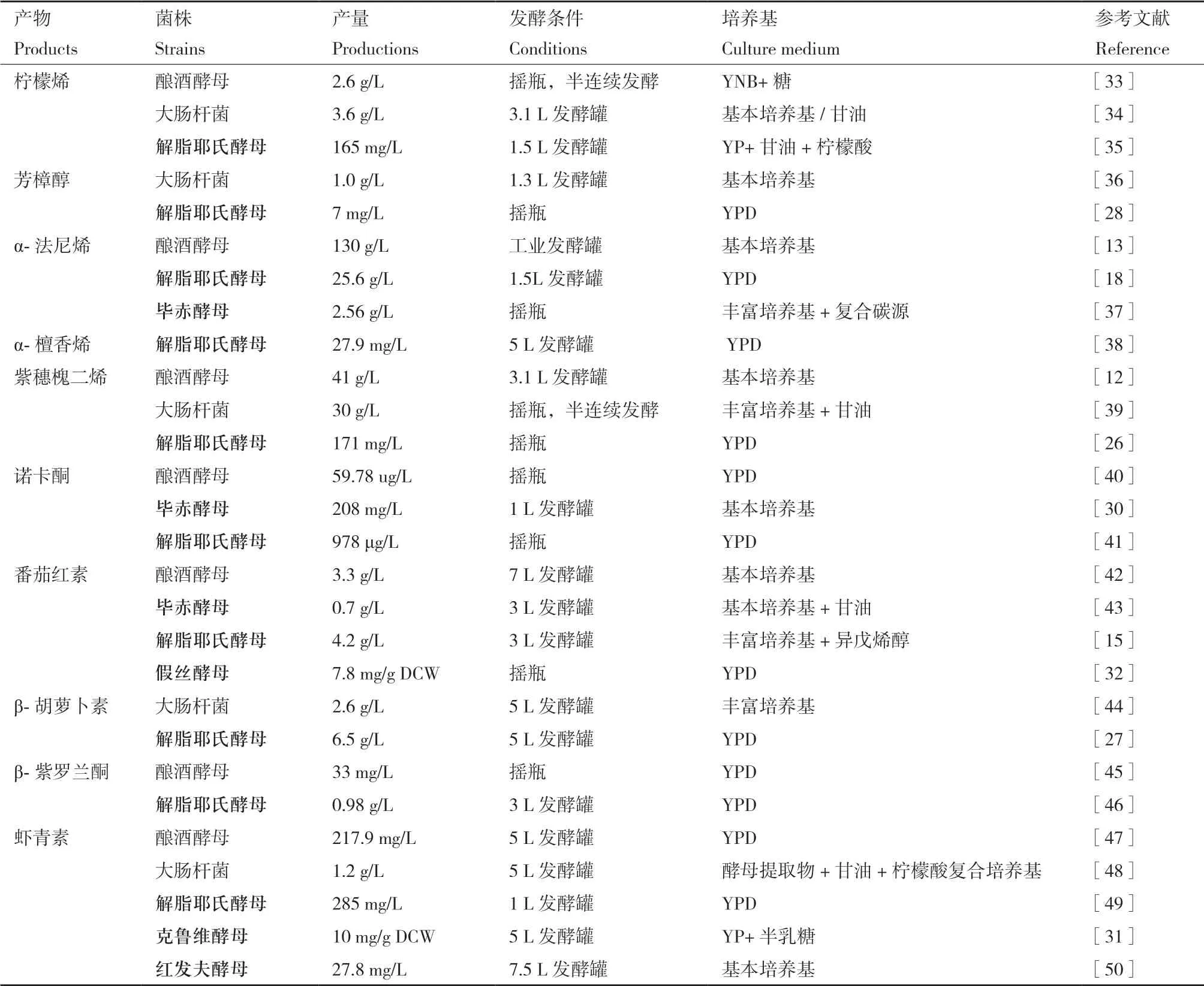
表1 非常规酵母及模式生物合成部分萜类化合物(标粗表示非常规酵母)Table 1 Terpenoids biosynthesis by model microorganisms and non-conventional yeasts(Bold ones are non-conventional yeasts)
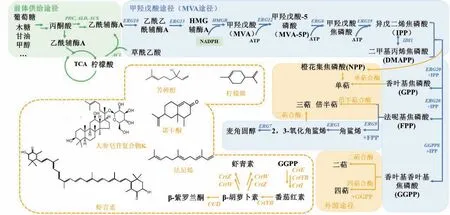
图2 甲羟戊酸途径合成萜类化合物Fig. 2 Mevalonate(MVA)pathway for terpenoids biosynthesis
其他非常规酵母在萜类合成上的研究非常有限,目前,只在毕赤酵母[29-30]、克鲁维酵母[31]、假丝酵母[32]等中实现了少数萜类化合物合成,并且由于缺乏遗传操作平台,代谢改造策略与最终产量均受到局限。
2.2 改造策略
为了在酵母中实现萜类等天然产物高效合成,需要发展代谢工程策略对细胞代谢进行优化,一般包括优化天然产物本身生物合成途径、强化前体供应和辅因子、弱化副反应以及区室化等代谢工程策略(表2)。这些代谢工程策略通用性强,适用于多种天然产物合成优化,但是需要根据不同天然产物生物合成机制合理选择改造策略,实现产物高效合成与细胞生长平衡。

表2 非常规酵母合成天然产物改造策略Table 2 Engineering strategies for biosynthesis of natural products in non-conventional yeasts
2.2.1 MVA途径关键基因调控 HMGR是MVA途径的关键基因,它具有N-基端的内质网跨膜结构域,研究表明只过表达C-基端的催化结构域能够显著提高萜类化合物的产量,并且避免降解而更稳定的存在于细胞中[58]。过表达解脂耶氏酵母HMGR[51]和tHMGR[46]使柠檬烯和β-紫罗兰酮产量分别提升14倍和10倍。假丝酵母中发现截短的tHMGR比HMGR有更好的效果[32];为了避免氧化还原状态不平衡,在解脂耶氏酵母中表达彼得里鲍特氏菌NADH依赖的HMGR[18],能够使细胞利用含量更多的NADH。ERG12也是关键基因,过表达提高了相应萜类化合物的合成[28,51];另一个重要基因IDI1调控DMAPP和IPP之间的转化,结合HMGR过表达能够显著促进萜类化合物的合成[28,59]。
2.2.2 强化前体和辅酶供应与削弱副反应 乙酰辅酶A是萜类合成的重要前体,其高效供应是萜类高效合成的关键之一。在解脂耶氏酵母中,过表达柠檬酸裂解酶ACL1和 ACL2强化柠檬酸裂解提供乙酰辅酶A,结合弱化三羧酸(TCA)循环,将番茄红素产量提升2-3倍[25]。NADPH是MVA途径合成的关键辅酶,在解脂耶氏酵母中过表达甘露醇脱氢酶提高NADPH供给使角鲨烯积累量提高11%[52]。ERG20是调控不同碳原子数萜类化合物合成的关键节点,不同的Erg20突变体能够倾向性合成不同萜类化合物前体。野生型Erg20p偏向合成FPP,而突变体Erg20pF96W-N127W利于GPP合成[60],Erg20pF96C能够直接催化IPP和DMAPP形成GGPP[61]。当以倍半萜为目标产物时,融合表达Erg20~Fpps能够显著提升产量[18],且能减少副产物角鲨烯的积累。
除此之外,为了使代谢流尽可能流向目标产物,需要消除/弱副反应。为了提高目标萜类化合物产量,往往需要弱化胞内甾醇的生物合成,而甾醇是合成细胞生长必需物质的前体,所以只能对副反应进行弱化。常用的方法包括弱化ERG9表达,在解脂耶氏酵母中,采用弱启动子PERG1,PERG11或截短PERG9的形式弱化ERG9表达,虾青素的产量提升2-2.5倍[53];另一可行策略是利用抑制型启动子,通过诱导物动态调控基因的表达实现副反应动态弱化。这一策略在酿酒酵母中有较多尝试,包括葡萄糖响应的启动子PHXT1[62]、甲硫氨酸抑制的启动子PMET[63],但是在非常规酵母中可利用的诱导型/抑制型启动子有限。有报道在解脂耶氏酵母中,尝试角鲨烯抑制型启动子PERG1和葡萄糖抑制型启动子PICL1来弱化ERG9表达[64],但是对番茄红素的生产没有明显效果;而使用甘油强抑制型启动子PALK1导致工程菌在甘油培养基中生长受限。这些结果表明启动子挖掘和表征是非常规酵母细胞工厂的重要研究内容之一。
2.2.3 细胞区室化策略 将萜类合成途径区室化也能够有效避免副反应发生,而且能够有效削弱中间产物与目标产物对细胞的毒害作用。过氧化物酶体是理想的区室化细胞器,一方面其区别于线粒体是细胞呼吸场所,系统改造不会对细胞生长造成负担;另一方面其中含有充足的乙酰辅酶A和NADPH前体,利于合成萜类化合物,且单层膜系统便于物质穿梭运输。酿酒酵母中将MVA途径靶向过氧化物酶体,单萜合成比细胞质途径提升125倍[33],角鲨烯产量提高68倍[65];在毕赤酵母中,将番茄红素合成基因定位至过氧化物酶体显著提高番茄红素产量[43]。实际上,非常规酵母,特别是解脂耶氏酵母和甲醇酵母具有发达的过氧化物酶体,有望成为高附加值萜类化合物合成的理想场所。
如前所述,解脂耶氏酵母中丰富脂质体为长链萜类化合物的合成提供了良好的疏水区室化环境。有报道发现抑制β-氧化和糖异生提高脂质体含量后,番茄红素产量显著提升,且主要积累在脂质体中[24];此外过表达脂质体合成关键基因DGA1显著提高了角鲨烯[54]和番茄红素[15]的合成。需要指出,油脂合成也是以乙酰辅酶A为前体,促进其合成可能与萜类合成竞争前体,因此平衡萜类与脂类合成至关重要。
3 非常规酵母合成黄酮类化合物
3.1 黄酮类化合物生物合成
黄酮类化合物是多酚类次级代谢产物的总称,它们都具有两个苯环通过3个碳原子相互连接的结构,即C6-C3-C6。黄酮类化合物因为潜在的抗菌、抗肿瘤、抗病毒、抗心脑血管疾病、抗衰老等活性备受关注,特别在2003年SARS病毒、2019年爆发的新型冠状病毒COVID-19治疗上,黄酮类化合物被证明具有减轻症状的效用[66]。
酵母体内需要引入细菌来源酪氨酸途径或植物来源的苯丙氨酸途径,由转氨酶催化形成对香豆酸后,再经过4-香豆酰辅酶A连接酶4CL合成香豆酰辅酶A,再被柚皮素查尔酮合酶CHS催化合成柚皮素查尔酮,最后被P450酶、糖基化酶等修饰形成多种结构各异的黄酮类化合物(图3)。由于路径复杂,目前非常规酵母中仅解脂耶氏酵母实现了黄酮类化合物从头合成(表3):表达矮牵牛来源的4CL,CHS,CHI和圆红冬孢酵母的TAL实现了柚皮素的从头合成[55],在此基础上表达外源P450氧化还原酶CPR、羟基化酶F3H,F3’H,进一步合成了黄杉素和圣草酚。Palmer等[57]构建的解脂耶氏酵母黄酮底盘细胞整合多种聚酮合酶,首次检测到去甲基姜黄素、(E)-5-(4-hydroxyphenyl)-3-oxopent-4-enoic acid化合物。在解脂耶氏酵母中表达了外源TAL,ACL,VST基因,在添加2 mmol/L酪氨酸的基础培养基中白藜芦醇产量达到52.1 mg/L[56],而在酿酒酵母中表达相同酶在相同培养基条件下产量只有9.5 mg/L[67],充分证实解脂耶氏酵母具有黄酮化合物高效合成的潜力。虽然多种黄酮化合物在非常规酵母中实现了以葡萄糖为底物的从头合成(表3),但总体合成效率不高。可能是因为外源酶活力有限,后续高效酶挖掘和酶工程改造可能是研究重点。

表3 非常规酵母及模式生物合成部分黄酮类化合物(标粗表示非常规酵母)Table 3 Flavonoids biosynthesis by model microorganisms and non-conventional yeasts(Bold ones are non-conventional yeasts)
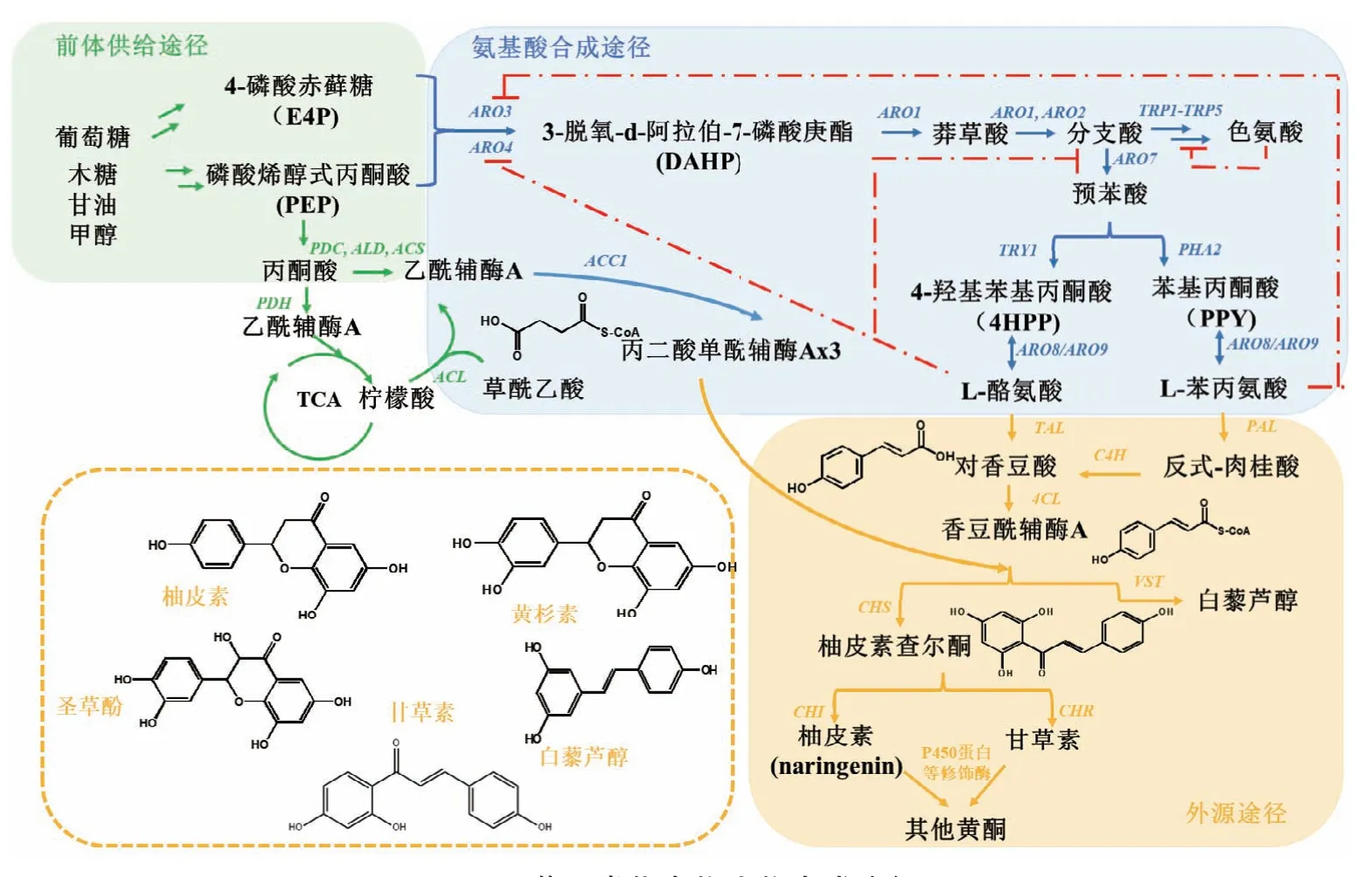
图3 黄酮类化合物生物合成途径Fig.3 Flavonoids biosynthetic pathways
3.2 改造策略
黄酮生物合成与萜类生物合成既有相似之处,比如说均需要乙酰辅酶A为前体;也有不同之处,比如黄酮直接前体芳香族氨基酸生物合成调控严格、复杂。因此,其代谢工程改造既要参考萜类合成的通用策略,又要根据其生物合成机制设计特异性的改造策略(表2)。
3.2.1 前体供给强化 乙酰辅酶A和丙二酸单酰辅酶A是黄酮化合物合成的重要前体(图3),强化其供给将有利于产物积累。分别过表达解脂耶氏酵母的柠檬酸裂解途径、丙酮酸旁路、丙酮酸脱氢酶(PDH)复合体(去除线粒体定位信号肽),不同程度促进了细胞内乙酰辅酶A供给,并且发现PDH复合体、丙酮酸旁路途径过表达能够将脂肪酸合成代谢流流向乙酰辅酶A积累[17]。同时,为了减少油脂积累,增加前体合成,过表达PEX10调控过氧化物酶体促进脂肪酸的β-氧化[57],提高了黄酮化合物合成能力。另外柚皮素发酵过程中发现pH会显著降低,推测是乙酸堆积,通过过表达乙酰辅酶A合酶进一步提高了产量[55]。
丙二酸单酰辅酶A由乙酰辅酶A经羧化酶ACC1催化形成。ACC1受到磷酸化调控,在酿酒酵母中通过表达解除调控的突变体ACC1S659A,S1157A,将脂肪酸产量提升了6倍[75]。但是在解脂耶氏酵母中,表达内源野生型ACC1有更好的效果[55]。
3.2.2 合成途径基因强化 黄酮化合物的直接前体是苯丙氨酸和酪氨酸,而它们的合成受到严格的反馈抑制调控(图3)。在酿酒酵母中,催化第一步PEP和E4P合成DAHP的同工酶Aro3和Aro4是关键限速步骤,分别受苯丙氨酸和酪氨酸反馈抑制,将Aro4进行氨基酸点突变K229L能够消除抑制效应[76];分支酸异构酶Aro7也是关键节点,受酪氨酸反馈抑制,色氨酸激活,突变为Aro7G141S后能够解除这两种反馈作用。有报道在解脂耶氏酵母中引入酪氨酸途径,通过与酿酒酵母同源序列比对,鉴定并表达了解脂耶氏酵母自身突变体Aro4K221L,柚皮素产量提升了4倍[57]。白藜芦醇合成中,通过表达解脂耶氏酵母自身和酿酒酵母外源的Aro4和Aro7突变体基因,产量提升了2.2倍[56]。
除此之外,合成途径中其他基因强化也对产量提升至关重要。Lv等[55]过表达ARO1将柚皮素产量提高30%。氨基酸合成的前体是E4P和PEP,这些化合物在以葡萄糖为底物时浓度不高且含量不一致,但是它们作为PPP途径的中间产物,在利用木糖时含量显著提高,因此,构建木糖响应的柚皮素合成途径能够强化其合成效率[77]:第一个阶段以葡萄糖利用为主,组成型启动子合成途径发挥作用,48 h后开始利用木糖,这一阶段木糖主要起到支持生长的作用,第三阶段木糖的消耗转化为产量积累,在YPD+60 g/L木糖摇瓶培养下,产量达到715 mg/L。
3.2.3 外源基因表达水平调控 外源基因表达强度对产物合成至关重要:过低不利于产物的合成,过高会对细胞造成代谢负担;此外,上下游基因表达强度不同会使中间代谢物积累,造成细胞毒性。对于黄酮类化合物的合成需要引入较多外源基因,最佳的表达配比最终决定了目标产物的合成效率。在解脂耶氏酵母中,将黄酮合成途径分为柚皮素合成模块和下游修饰酶模块,通过逐一过表达各模块基因,找出CHS拷贝数为5,CPR和F3H比例为1∶2时产量达到最高[55]。在白藜芦醇合成时,交换4CL和VST基因的启动子会导致产量明显下降[56],说明改造途径中代谢流达到平衡状态至关重要。
目前,在解脂耶氏酵母中对外源基因表达强度的调控均是通过逐一增加拷贝数实现,费时费力,并且蛋白之间存在空间距离会导致中间产物泄露。蛋白支架策略可能是今后调控外源基因表达强度的一个重要研究方向。蛋白支架能够将酶定位到同一个复合体,并且通过亲和肽数目的改变来调节酶表达水平。目前,在大肠杆菌中利用蛋白支架调控酿酒酵母来源的ERG13,HMGR,使得甲羟戊酸的合成水平提高77倍[78]。
4 机遇与挑战
非常规酵母细胞工厂在萜类和黄酮类化合物等天然产物合成方面已取得系列进展,展现了巨大应用潜力和重要研究价值。但是,和模式生物大肠杆菌、酿酒酵母等相比,仍面临许多技术瓶颈和亟待解决的关键问题,主要表现在精准基因编辑技术和合成生物元件匮乏,生理特性认知不足、代谢网络调控研究滞后等,解决上述瓶颈问题是实现构建非常规酵母细胞工厂高效合成天然产物的重要前提。
4.1 基因操作平台构建
非常规酵母缺乏良好的基因组注释和高效精准的基因编辑工具,限制了大片段基因整合、内源基因敲除、基因功能评估。表1和表3中的代谢工程改造大多采用整合质粒[15-16,29,79]或非同源末端连接技术[18],可能导致整合位点随机性较高,基因拷贝数不确定,而且还可能需要较多筛选标记。CRISPR-Cas9技术的快速发展,使非常规酵母实现高效基因编辑成为可能。
CRISPR-Cas9通过剪切特定位点能够实现精准高效的基因编辑,通过筛选不同来源的Cas9蛋白、调节CAS9和gRNA的表达强度,在多种非常规酵母中实现了平台构建[80]。但是和酿酒酵母以同源重组为主的修复方式不同,非常规酵母大多以非同源末端连接(NHEJ)形式参与断裂双链的修复,这种方式会导致基因编辑位点DNA片段随机插入、缺失、重排[81],难以实现精准代谢工程改造,使得构建的工程细胞随机性大。在NHEJ中,Ku70/80组成的蛋白复合体会结合在断裂双链末端,防止其被降解的同时招募核酸内切酶和连接酶进行修复[81],而HR介导的修复方式则通过招募Rad51/52等关键蛋白发挥作用[82](图4)。通过对这些蛋白进行调控,在非常规酵母中显著提升HR修复效率[83-84],为基因精确编辑提供技术支撑,并且能够实现大片段整合及多片段体内重组[83-84]。此外,基因敲除或过表达可能对细胞造成代谢负担,限制了内源代谢网络的调控及与外源代谢路径适配。而CRISPR衍生的基因调控策略CRISPRi(抑制)及CRISPRa(激活)调控系统已在解脂耶氏酵母[85-86]、毕赤酵母[87]等中得到建立,将有助于温和调控基因表达。
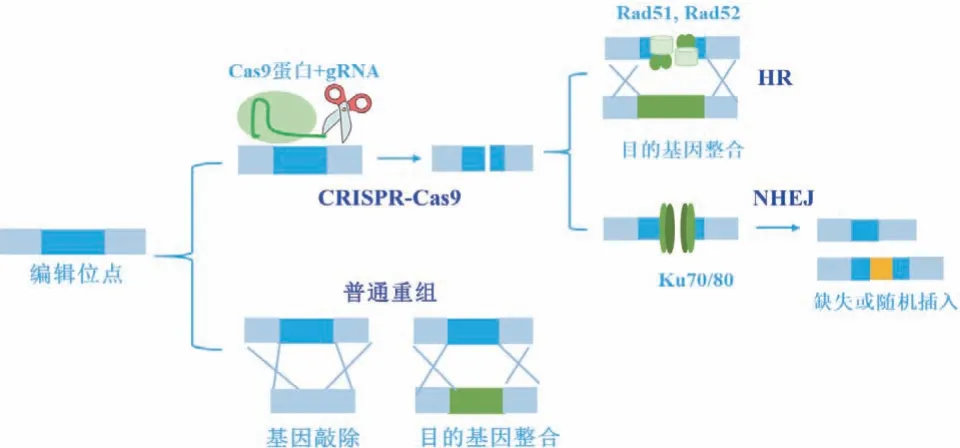
图4 真核生物中的基因编辑技术及重组机制Fig. 4 Gene editing methods and recombination mechanisms in eukaryotes
另一方面,基因组测序技术的发展,能够为非常规酵母提供完善的基因组注释信息。转录组学、蛋白质组学以及代谢组学等技术从宏观角度反映工程菌代谢网络信息,揭示工程菌体内调控模式,为代谢工程改造提供靶点。以甲醇酵母为例,由于对其生理生化特性认识有限,在目前模式生物构建一碳同化效率低[88-89]的背景下,从组学角度出发,可能能够更好的探索和阐释一碳同化机制,提高甲醇同化效率,为构建高效甲醇酵母细胞工厂提供指导。
4.2 合成生物学元件挖掘
启动子和终止子是基因表达的关键元件。目前,非常规酵母中最常见的诱导型启动子包括甲醇严格诱导的PAOX1,解脂耶氏酵母铜离子诱导启动子[90],脂肪酸强诱导型启动子[91]等。但是,总体来说,目前非常规酵母相关元件信息十分匮乏,制约了代谢工程改造。后续挖掘不同强度的组成型和诱导型启动子有助于突破非常规酵母元件限制,为构建高效细胞工厂奠定良好基础。特别是启动子能够从转录水平上调控基因表达,对于细胞毒性的天然产物,借助诱导型启动子将生长与生产分隔开,能够避免产物过早积累抑制细胞生长。
4.3 代谢物与产物细胞毒性
产物的积累往往对细胞具有毒害作用。除了利用诱导/抑制型启动子进行两阶段发酵生产之外,及时将目标产物转运出细胞也是重要研究策略。研究表明,通过表达大肠杆菌来源的转运蛋白AcrB和Grosmania clavigera的ATP结合转运超家族ABC-G1蛋白,能够促进甜没药烯外排[92]。
实验室适应进化结合反向代谢工程是一种提高微生物特定表型的有效策略[93]。在酿酒酵母中,通过实验室适应进化,提高了工程菌对中链脂肪酸的耐受性从而加强了生产能力[94],证实连续细胞培养传代能够提高细胞对某一特定化合物的耐受能力。特别是,近年来组学技术蓬勃发展,将驯化后得到的菌株借助基因组、转录组、蛋白组和代谢组等多组学联用分析,将强化非传统酵母细胞工厂耐受性,并提供新的靶点和理论认识。
4.4 复杂产物谱拓展
目前,非常规酵母合成天然产物主要集中在萜类化合物和黄酮类化合物(表1和表3),但随着技术的不断完善,更加复杂的天然产物合成将是未来重要的研究方向。其中,生物碱就是复杂天然产物的代表,它是一类具有复杂环结构的含氮呈碱性的有机化合物(除氨基酸、维生素等化合物以外)。它们往往具有非常强的生物活性,比如可卡因具有麻醉作用、长春碱和长春新碱用于治疗急性淋巴癌。由于生物碱的结构多样、种类众多、合成途径复杂,目前在非常规酵母中暂时未见报道。图5对近年来受到广泛关注的并且在酿酒酵母中实现从头合成的单萜生物碱、苄基喹啉生物碱和脱品生物碱的生物合成途径进行了归纳总结,可以看出,生物碱的生物合成和萜类、黄酮类化合物具有较多相同前体物质,但需要更多的P450氧化还原酶等修饰酶。鉴于非常规酵母在合成复杂萜类及黄酮类化合物上表现优异,相信随着基因操作平台工具的完善,非常规酵母在合成生物碱等复杂天然产物上将会大放异彩。
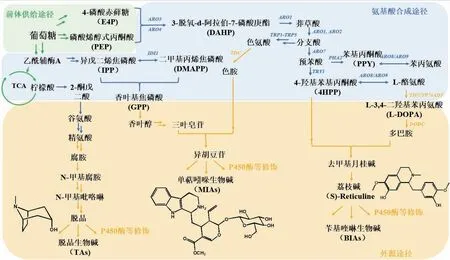
图5 常见生物碱合成途径Fig. 5 Common alkaloids biosynthetic pathways
总之,虽然模式生物酿酒酵母和大肠杆菌在高附加值天然产物的合成上取得良好进展,但是非常规酵母由于其独特优势,有望成为天然产物合成的潜在底盘细胞。在目前基因操作严重受限条件下,非常规酵母细胞工厂在萜类化合物和黄酮类化合物的合成上展现较大的应用潜力。相信随着基因编辑工具的发展、基因元件的开发以及发酵过程优化,非常规酵母将在天然产物生物合成上扮演越来越重要的角色,为其大规模工业化生产提供坚实技术支撑。
