灵芝酸生物合成及代谢调控研究进展
2021-09-14袁恺何伟杨云丽朱威宇彭超安泰李丽周卫强
袁恺 何伟 杨云丽 朱威宇 彭超 安泰 李丽 周卫强
(1. 中粮营养健康研究院有限公司,北京102209;2. 营养健康与食品安全北京市重点实验室,北京 102209;3. 北京工商大学化学与材料 工程学院,北京 100048)
灵芝酸(ganoderic acids,GAs)是灵芝三萜酸的简称,约占灵芝三萜类物质的三分之一[1]。尽管已经被证明其具有出色的药用价值,但是从天然灵芝的子实体和孢子中提取GAs,存在灵芝栽培工作量大、时间长、生长环境要求高、GAs含量低等问题,极大地限制了其商业应用和开发。近年来,灵芝菌深层液体发酵技术逐渐成为获取GAs的重要方法,而灵芝酸生物合成途径的解析和调控对于解决发酵生产灵芝酸低产量问题又意义重大。本文从GAs的合成代谢途径出发,首先介绍了利用基因工程手段对GAs合成代谢途径进行调控的实施案例,随后系统梳理了信号传导途径以及生物表观遗传在提高GAs积累量方面的作用原理,并绘制出示意图,希望为今后进一步提高深层液体发酵产GAs产量提供研究思路。
1 灵芝酸
1.1 灵芝酸简介
灵芝酸是灵芝菌的主要活性成分之一[2]。自1982年Kubota[3]首次分离得到灵芝酸A、灵芝酸B以来,已经超过100多种GAs被分离出来,其主要结构见图1。GAs已经被证明具有抗肿瘤[4-6]、抗炎[7]、抑菌[4]、抗衰老[8]、助睡眠[9]等作用。例如,灵芝酸A具有抑制炎症、治疗人胶质瘤、保肝、抑菌等作用[4,7],灵芝酸DM可以抑制黑色素瘤[10],灵芝酸D可以抑制结肠癌[5]等。在灵芝菌深层液体发酵生产GAs的过程中,发酵参数,如温度、pH、溶氧等,外源物质,如植物激素、油脂、苯巴比妥等都对GAs的生物合成代谢有直接影响作用[11-12]。
1.2 灵芝酸的合成代谢途径
Shiao通过13C同位素标记证明GAs的生物合成是由甲羟戊酸(MVA)合成代谢途径起始[13],并通过3个阶段合成(图1)。第一阶段:前体物质生成。首先3分子的乙酰辅酶A经过2次缩合形成3-羟-3-甲基戊二酰辅酶A(HMG-CoA),随后在3-羟-3-甲基戊二酰辅酶A还原酶(HMGR)的作用下生成MVA。再经过甲基戊酸激酶(MK)和甲羟戊酸激酶(MPK)焦磷酸化、甲羟戊酸脱羧酶(MVD)脱羧化作用下生成异戊烯焦磷酸(IPP)。IPP在异戊二烯焦磷酸异构酶(IDI)激活下可异构化生成二甲丙烯焦磷酸(DMAPP)。2分子IPP和1分子DMAPP在法尼基磷酸合酶(FPS)催化下头尾缩合成法尼基焦磷酸(FPP)。第二阶段:羊毛甾醇骨架生成。首先FPP在鲨烯合成酶(SQS)催化下转化为鲨烯,随后在羊毛甾醇合成酶(LSS)催化下生成羊毛甾醇。第三阶段:GAs的合成。羊毛甾醇经过氧化、羟基化和糖基化生成不同结构的GAs。

图1 灵芝酸生物合成途径Fig.1 Biosynthesis pathways of GAs
在GAs的合成途径中,第一、二阶段已经得到了系统性的研究,涉及的重要酶也被鉴定和表征。但是第三阶段的生物转化过程还未完全阐明。Chen等[14]发现细胞色素P450单加氧酶(CYP450)催化羊毛甾醇成为不同的GAs。同时基因测序发现有214个CYPs与灵芝酸下游合成途径相关,其中有78个CYPs与LSS共表达,猜测这78个CYPs可能参与到灵芝酸骨架结构修饰中。另外有198个CYPs分属于24个基因簇,其中有5个基因簇与LSS共表达,说明它们在GAs生物合成中发挥作用[15]。例 如CYP512U6负 责 催 化 合 成 灵 芝 酸ZXYL[16],CYP505D13则配合生成环状灵芝三萜[17]等。
2 灵芝酸合成代谢途径的基因调控
作为次级代谢产物,尤其是存在多种支路的情况下,GAs的合成和积累严格受限于合成代谢途径中关键基因的转录水平。因此,代谢通路中关键酶的过表达和异源表达成为获得GAs高积累量的最直接最有效手段。
2.1 关键酶基因的过表达
在GAs合成代谢途径的上游有HMGR、FPS、SQS、LSS[18]这4个关键酶,其基因表达量与GAs的积累量密切相关。钟建江课题组[19]使用同源标记基因Cbxr,利用农杆菌介导转化法将N端截断的hmgr(t-HMGR)基因片段导入灵芝细胞中,对HMGR催化域进行过表达。在发酵的第8天,fps、sqs、ls的基因转录水平出现上调,GAs水平急剧升高,发酵结束后t-HMGR基因过表达菌株中角鲨烯、羊毛甾醇和GAs含量比出发菌株分别高6.7、3.8、2倍。
作为MVA生物合成途径的第一个多分支点,FPS活性直接影响异戊烯焦磷酸(IPP)的催化路径[20]。Fei等[21]通过过表达fps发现,基因sqs和ls转录水平分别上调2.8倍和1.73倍,GAs、灵芝酸T、灵芝酸S、灵芝酸Me的含量分别为2.76、41、21、28 μg/100 mg菌丝体,比空白组分别高出2.28、2.27、2.62、2.80倍。与Ding等[22]上调fps转录水平的结果相同。类似于FPS,SQS通过控制法尼基焦磷酸将代谢流引向灵芝酸合成代谢途径,从而避免形成半倍萜。Zhou等[23]通过过表达sqs,转录水平提高15.6倍,鲨烯和羊毛甾醇含量分别增加1.55倍和1.68倍,灵芝酸Mk、T、Me、S的含量分别是16、40、43、53 μg/100 mg,比出发菌株高2.86、2.67、1.95、1.25倍。
LSS催化2,3-氧化鲨烯形成羊毛甾醇,过表达lss可以为GAs的生物合成提供足够的前体物质。研究结果显示原基时期的lss表达量显著高于菌丝体中的lss表达量,GAs含量呈现相同趋势[24]。Zhang等[25]过表达lss后羊毛甾醇积累量提高了2.3倍,灵芝酸O、Mk、T、S、MI、Me的含量分别达到4.66、24.30、69.80、28.90、15.4、26.70 μg/100 mg,相 比出发菌株提高6.1、2.2、3.2、4.8、2.0、1.9倍。
2.2 关键基因的异源表达
发酵周期长是制约GAs商业应用的另一个主要因素。根据其他次级代谢产物的生产经验,在合适的底盘微生物中实现异源表达将有效缩短发酵周期,同时也利于进一步提升GAs积累量。青蒿酸[26]、弥罗松酚[27]、人参皂苷[28-29]等植物来源的天然产物已经实现了异源表达,但是目前GAs的异源表达报道十分少。Wang等[30]通过体外酶促实验证明羊毛甾醇氧化酶CYP510L8通过3步催化羊毛甾醇的第二十六位碳转化成为灵芝酸Z,经异源表达cyp150l8,又成功实现灵芝酸Z在酿酒酵母中的合成,发酵120 h后产量约为14.5 mg/L。为了进一步提高CPY510L8活力,研究人员构建了新的异源表达体系CYP510L8-iGLCPR融合蛋白(一种细胞色素P450还原酶),实现胞内H+的快速转移,从而灵芝酸Z产量提升至154.45 mg/L,相比出发菌株提高了10倍[31]。毫无疑问,基因工程手段可以实现GAs的异源表达,而且更方便进行代谢调控、过程调控等方面的优化。其次,选择合适的宿主也十分重要。比如上述研究中选择酿酒酵母,一方面是因为它可以自行合成羊毛甾醇,为GAs合成提供前提物质。另一方面是利用其内质网和翻译修饰系统可以表达CYP510L8和iGLCPR的优势。
由此可见,通过基因工程手段对重要节点的酶的基因进行过表达或抑制,可以将胞内代谢流导向GAs的合成代谢分支,直接有效达到目标产物产量积累的目的。此外,尽管还存在关键酶功能解析不完全、合适宿主的选择困难等诸多障碍,但是通过构建异源表达系统提高GAs的生产效价这一路径极有发展前景。
3 灵芝酸合成代谢途径的信号转导调控
信号转导途径即细胞对某些特定刺激做出反应的分子途径。通过信号转导实现对微生物代谢途径的调控已经发展成为一种强有力的策略。在GAs代谢途径中,目前已经发现的转导信号包括钙调磷脂酶信号、活性氧信号、细胞壁完整性信号、茉莉酮酸(JA)及其衍生物信号、NO信号、cAMP信号等 (表1)[32-34]。
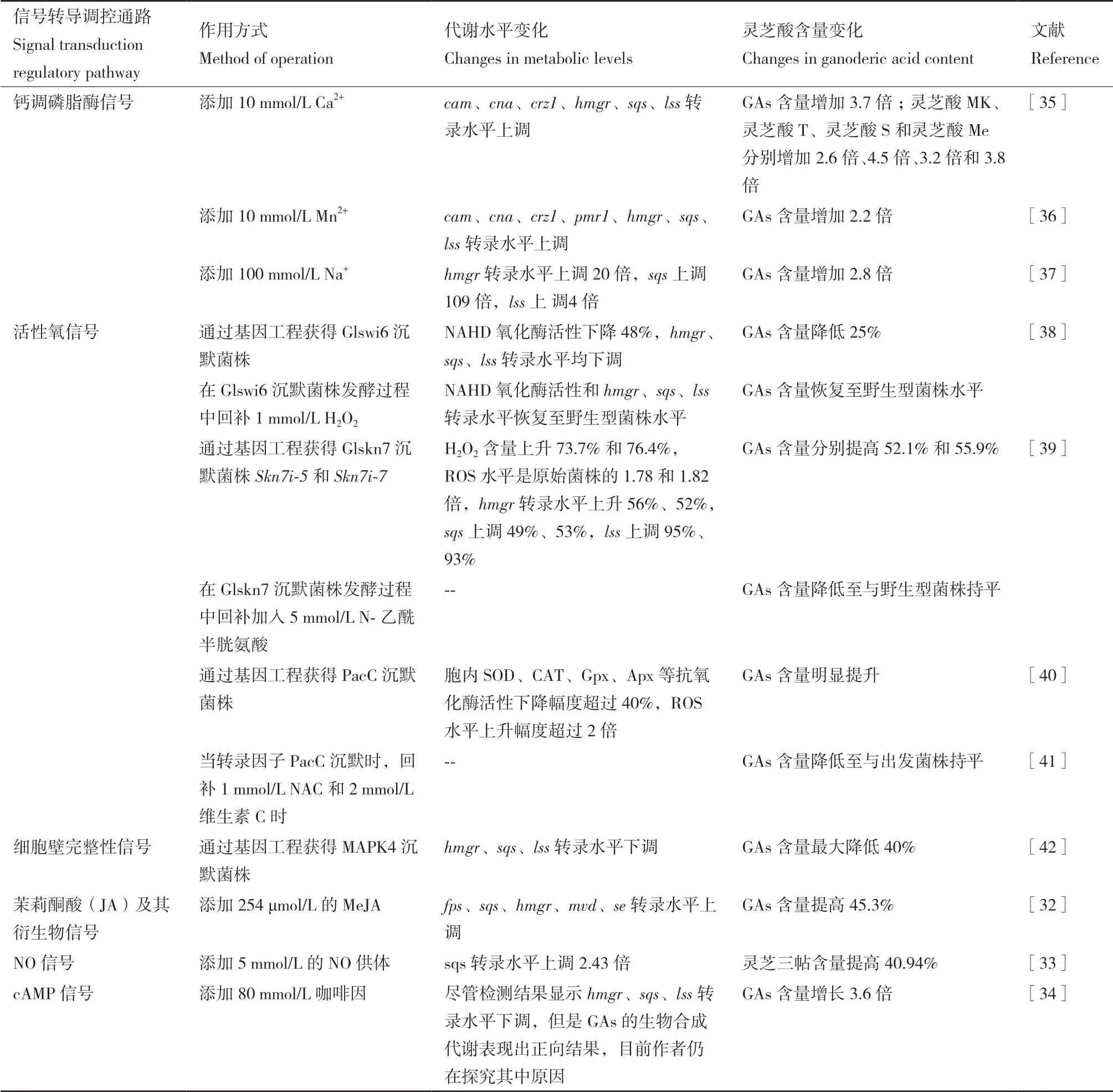
表1 灵芝酸生物合成途径的信号转导调控Table 1 Signal transduction regulation of ganoderma acid biosynthesis pathway
3.1 钙调磷脂酶信号
钙调磷脂酶信号的作用途径是,细胞内Ca2+浓度升高并与钙调蛋白(基因cam)形成Ca2+/钙调蛋白复合物,随后与钙调磷脂酶的催化亚基(基因cna)相互作用并激活转录因子锌指蛋白(基因crz1)[32]。在GAs合成代谢途径中,基因sqs和lss的启动子区域有一个CDRE序列,受CRZ1的正向调节。Xu等[35]发现当在培养基中加入Ca2+后,参与钙调磷脂酶信号的cam、cna、crz1和GAs合成代谢途径的关键酶基因hmgr、sqs、lss的表达量均出现明显上调,GAs含量增加了3.7倍,灵芝酸MK、灵芝酸T、灵芝酸S和灵芝酸Me分别增加了2.6倍、4.5倍、3.2倍和3.8倍。Na+和Mn2+具有相同作用机制,通过胞内Ca2+浓度增加并激活钙调磷脂酶信号从而实现GAs合成代谢途径的正向调节,分别将GAs含量提高了2.8倍和2.7倍[36-37]。
3.2 活性氧信号
活性氧(reactive oxygen species,ROS)平衡调节系统是一种广泛存在于细胞内的复杂调节机制,涉及多种氧化应激相关基因,对微生物合成代谢途径影响较大[43-44]。Glswi6是G. lucidum ACCC53264的APSES转录因子,其转录表达与灵芝菌的发育以及生物合成代谢途径密切相关。相比于野生型菌株,Zhang等[38]发现Glswi6沉默菌株的NAHD氧化酶活性下降48%,H2O2含量下降50%。同时,GAs合成代谢途径的关键基因hmgr、sqs、lss转录水平均下调,GAs产量降低25%。通过回补1 mmol/L H2O2,关键基因的转录水平和GAs的产量恢复至野生型菌株水平。转录因子GlSkn7参与细胞壁的合成、孢子形成及胞内氧化应激反应,是ROS系统不可或缺的一部分,维持ROS的稳态。以灵芝菌G. lucidum ACCC53264为原始菌株,通过敲除Glskn7获得的Skn7i-5和Skn7i-7菌株,H2O2含量上升73.7%和76.4%,ROS水平是原始菌株的1.78和1.82倍,GAs分别提高了52.1%和55.9%。转录组数据显示hmgr转录水平上升56%、52%,sqs上调49%、53%,lss上调95%、93%。在突变菌株中加入5 mmol/L活性氧清除剂N-乙酰半胱氨酸(NAC),GAs浓度降低至与野生型菌株相同水平[39]。同样地,当转录因子PacC沉默时,胞内SOD、CAT、Gpx、Apx等抗氧化酶活性下降幅度超过40%,ROS水平上升幅度超过2倍,GAs积累量明显提升[40],而回补1 mmol/L NAC 和 2 mmol/L维生素C时,突变菌株的GAs水平下降并与出发菌株持平[41]。这些研究结果表明胞内ROS水平与GAs合成代谢水平存在相关性,随着胞内ROS水平的变化,转录因子随之变化并对GAs合成代谢途径产生调控作用[45]。
3.3 细胞壁完整性信号
当植物生存环境受到外界胁迫时,会产生对植物具有保护作用的次级代谢物质,提高生存竞争力[46],而细胞壁是植物应答外界胁迫的第一环节。细胞壁完整性(cell wall intesrity,CWI)信号由丝裂原激活蛋白激酶(MAPK)模块组成,主要参与细胞壁完整性调控。经数据库对比、功能域和进化树分析,在G. lucidum HG菌株发现了编码MAPK模块的基因mapk4。与野生型菌株相比,多株mapk4沉默菌株都表现出生长速率减慢、菌丝分叉增多、细胞壁厚度减小。关键基因hmgr、sqs、lss转录水平下调明显,鲨烯、羊毛甾醇含量分别下降55%和50%,GAs含量最大降低40%。同时,研究人员还发现部分mapk4沉默菌株中H2O2含量约减少70%,NADPH氧化酶家族(noxA、noxB、noxR)基因表达量降低[42],这与Glswi6的调控路径高度一致。
由此看来,Ca2+、ROS、CWI、NO、cAMP、JA以及其衍生物的信号转导途径并不是单独作用,而是相互影响的,并且主要以钙调磷脂酶信号和ROS信号为主(图2)。其次,与以单个基因为靶点的关键酶过表达方法不同,信号转导途径通过影响涉及多个代谢途径的大量基因,从而实现对这些途径的整体上调或下调。

图2 灵芝菌胞内信号转导示意图Fig. 2 Schematic diagram of intracellular signal transduction in G. lucidum
4 全局性调控因子与生物表观遗传的调控
不同于调控单一基因的特异性调控因子,全局性调控因子能够同时调控多个基因簇内的基因表达,实现对多种次级代谢产物的生物合成干预。生物表观遗传是微生物调控自身次级代谢产物合成的一种方式,其分子机制有DNA甲基化、羟甲基化、组蛋白修饰、染色体重塑、核小体定位以及非编码RNA调控等。
4.1 全局性调控因子LaeA
灵芝菌中全局性调控因子LaeA可以通过激活沉默基因表达实现增加GAs积累量的目的。贺望兴等[47]发现振荡培养和液体静置培养两种方式下LaeA表达出现差异,静置培养下LaeA表达量和GAs含量均高于振荡培养,倍数分别为3.3和9.4倍,因此研究人员猜测蛋白LaeA通过转录调控影响GAs的次级代谢途径。有人推测类似于构巢曲霉,LaeA是与Velvet蛋白家族的2个成员形成LaeAVeA-VelB三聚体复合物从而调控着灵芝的次级代 谢[48-49],但是真正的机制有待探索。
4.2 DNA甲基化
DNA甲基化是维持植物正常发育必须的,具有不可替代的作用。蓝丽雯等[50]利用DNA甲基化抑制剂5-氮杂胞苷(5-azacytidine,5-AC)对GAs的代谢进行诱导。研究发现,在灵芝的液体静置培养基中添加1 mmol/L 5-AC时,灵芝孢子中灵芝酸Mk、T、S、Me含量达到最高,是对照组的3-4倍。灵芝酸Mk和灵芝酸S的含量分别达到13.10和12.33 mg/g。hmgr、sqs、se和lss的表达量分别是对照组的6.26、3.10、3.42和4.32倍。同时,研究人员还发现全局性调控因子LaeA的表达量是对照组的2.83倍,间接证明激活LaeA的表达有利于提高GAs积累量。
4.3 组蛋白乙酰化
组蛋白乙酰转移酶(histone acetyltransferases,HATs)可以通过开启沉默基因实现对次级合成代谢途径的调控。辛二酰苯胺异羟肟酸(vorinostat,SAHA)能有效抑制组蛋白去乙酰化酶(histone deacetylase,HDAC)的活性,从而促进组蛋白的乙酰化。通过向培养基中加入180 μmol/L的SAHA,灵芝培养第9天时组蛋白去乙酰化酶RPD3水平上调,其转录水平是对照组的6倍,组蛋白H3乙酰化的水平无差异,组蛋白H4乙酰化的水平是对照组的1.6倍。在灵芝培养第6、12天时检测GAs的含量比对照组降低36%、45%。向培养基中加入60 μmol/L和180 μmol/L的SAHA,在第6天检测hmgr、sqs、se和lss基因表达量均高于空白组,而在第12天时这4个基因表达量均低于空白组。对全局性调控因子LaeA和Velvet检测发现,不同SAHA浓度、不同天数下灵芝菌的LaeA和Velvet表达均受到抑制[51]。因此猜测灵芝中的组蛋白乙酰化水平的上升抑制了全局调控因子LaeA和蛋白Velvet的表达,从而导致GAs的积累量降低。
综上发现,全局调控因子与表观遗传存在紧密的联系。通过抑制DNA甲基化,全局性调控因子LaeA的表达量增加,GAs合成代谢途径正向激活。组蛋白乙酰化会抑制全局调控因子LaeA和Velvet的表达,导致GAs的积累量降低。
5 总结与展望
在GAs合成代谢途径方面,前两个阶段的多个关键酶已经被克隆表征,并得到研究。第3个阶段中,目前发现78个CYP450可能参与到GAs骨架结构修饰中,但是仅仅阐明cyp5150l8、cyp512U6、cyp505D13这3种基因参与下游途径,其余CYP450s的作用机制仍不清晰,这将是未来研究的重点方向之一。在信号转导途径方面,目前已经发现了多种信号转导途径以及之间存在的相互作用,未来将会聚焦到转录因子对GAs合成基因的影响机理上,例如利用染色质免疫沉淀-测序等技术揭示调控元件的高维相互关系水平,并从头注释新的功能基因组区域。在全局性调控因子与生物表观遗传方面,构建灵芝工程菌时可以通过减少DNA甲基化水平和组蛋白乙酰化水平以促进GAs的合成代谢。
完全解析GAs的合成代谢途径、共表达多个关键酶以增强代谢流、挖掘信号转导途径的深层作用机制、寻找合适的底盘生物实现其异源表达,整合转录、RNA加工和翻译,以及翻译后的修饰等多水平调控,将在灵芝深层液体发酵工艺中实现周期短、效价高的最终目的,并为GAs商业应用的进一步扩大打下基础。
