Ni-CeO2催化剂丙烷部分氧化重整产氢性能研究
2021-09-14王陈鹏
郭 劲,姚 越,马 跃,王陈鹏,施 涛,梁 波
(1.广东工业大学 材料与能源学院,广东 广州510006;2.佛山市攀业氢能源科技有限公司,广东 佛山528000)
随着全球工业化和城市化的发展,能源需求的迅速增长成为了21世纪的主要挑战之一[1,2]。氢能被誉为21世纪的“终极能源”,其主要来源于水,燃烧产物也是水,可以解决可持续发展、环境污染和能源安全等问题[3]。从全球制氢工业来看,制氢方法主要包括电解水制氢、碳氢化合物重整制氢、生物制氢、热解制氢等[4]。碳氢化合物重整技术作为制氢技术的重要分支之一,按反应方式的不同主要分为水蒸气重整、部分氧化重整、自热重整等。水蒸气重整是一个吸热反应,重整过程需提供大量热量,能耗大且反应速率慢;自热重整存在反应速率慢,设备复杂和流程繁琐等缺点。与水蒸气重整与自热重整相比,部分氧化重整具有放热特性,仅需空气即可作为氧化剂,因此具有启动快,响应时间短的特点[5,6]。丙烷作为液化石油气(LPG)或生物质衍生的气体之一,可以安全可靠地压缩,运输和存储。这些特征是制氢行业原料的理想特性[7,8]。
催化剂的性质决定了部分氧化重整反应的快慢与进程。目前主要采用的催化剂包括过渡金属催化剂(Ni、Co、Fe等)和贵金属催化剂(Au、Pt等)。然而,贵金属催化剂的高成本问题限制了其大规模应用。镍基催化剂高活性低成本的特点使其广泛应用于碳氢化合物重整制氢[9]。但是,镍基催化剂在重整反应中特别是在高温下具有强烈的烧结趋势并产生碳沉积物引起失活[10]。因此,载体的性质对于负载型金属催化剂的催化性能至关重要。CeO2因其独特的性能而被广泛用于催化载体[11]。通过Ce4+和Ce3+离子之间的可逆氧化还原循环,该材料可以产生固定的氧空位,这允许CeO2颗粒根据表面需求释放或吸收氧粒子。这种特性称为储氧量(OSC)。CeO2不仅充当了活性金属颗粒的载体,而且充当了储氧器,有助于氧化反应过程中沉积在催化剂上的碳质物质,从而减少部分氧化过程中的碳沉积[12]。Zhou等[13]研究了CeO2对NiCo-Al2O3的影响,发现添加CeO2改性NiCo-Al2O3催化剂降低了催化剂的表面酸性,进一步提高了催化剂的活性和抗积炭能力。Zong等[14]使用水热法制备了NiCeOx化剂,并将其应用于丙烷全氧化中,发现CeO2的存在能提高丙烷燃烧的催化活性。
尽管镍基催化剂已经有了很长的历史,但针对制备方法的对比研究却存在一定程度的空白。同时,镍基催化剂使用后,关于碳沉积的去除及重复使用问题也值得深入探讨。本文首先使用水热法制备了CeO2载体,再用不同的方法制备了Ni-CeO2催化剂,探究了制备方法、活性组分负载量及重整温度对丙烷部分氧化重整产氢性能的影响,以获得最佳工艺参数,从而制备出一种催化性能高且稳定的催化剂。
1 实验部分
1.1 实验试剂
实验所需药品信息如表1所示。

表1 药品与试剂
1.2 催化剂的制备
1.2.1 CeO2载体
使用水热法合成了CeO2纳米颗粒载体。为了获得均匀的纳米颗粒,首先将8.03 mmol的Ce(NO3)2·6H2O和120 mmol的NaOH分别溶解在40 mL去离子水中。然后,将这两种溶液混合并搅拌30 min,形成乳状悬浮液。随后,将混合溶液转移到水热釜中,然后在100 °C下保温24 h。在水热处理之后,将沉淀物用蒸馏水和乙醇洗涤,然后在60 °C下干燥12 h,并在空气中于400 °C下煅烧4 h。
1.2.2 Ni-CeO2催化剂
使用溶胶-凝胶法制备了负载量为0.1%~15%(质量分数)的Ni-CeO2催化剂。对于典型的10% Ni-CeO2样品,将3.56 mmol的Ni(NO3)2·6H2O和7.18 mmol的柠檬酸溶于30 mL去离子水中,在室温下搅拌5 min,然后一边搅拌一边加入11.6 mmol的CeO2。将混合溶液在80 °C下搅拌5 h,并将形成的溶胶凝胶在100 °C干燥过夜。最后,将获得的前体在空气中于700 °C煅烧4 h以获得产物。通过同样的方法制备其他负载量的Ni-CeO2催化剂。为了比较,还使用其他方法制备了10% Ni-CeO2催化剂。
用浸渍法制备了Ni-CeO2-CI样品。将3.56 mmol的Ni(NO3)2·6H2O和11.6 mmol的CeO2置于15 mL去离子水中,然后在70 °C下搅拌,直到将溶液搅干。将获得的前体在100 °C干燥过夜,然后在空气中于700 °C煅烧4 h以获得产物。
用共沉淀法制备了Ni-CeO2-CP样品。将3.56 mmol的Ni(NO3)2·6H2O和11.6 mmol的CeO2置于50 mL去离子水中,然后向混合溶液中滴加1 mol/L NaOH溶液直至pH=10。在室温下搅拌并老化1 h后,将溶液离心,并将获得的固体用去离子水洗涤几次。将得到的前体在100 °C下干燥过夜,然后在空气中于700 °C下煅烧4 h以获得产物。
1.3 实验装置及方法
在管式炉的石英管中进行丙烷部分氧化重整反应,石英管内径12 mm,长度80 mm,反应装置如图1所示。
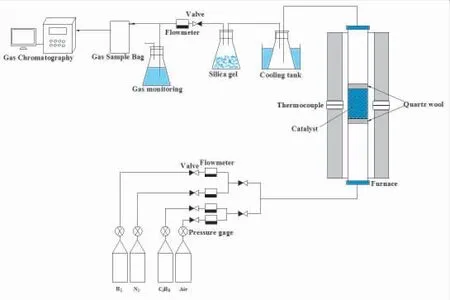
图1 实验装置示意
称取0.5 g催化剂置于玻璃石英管中,催化剂两端用石英棉挡住以防止催化剂被气体带走,连接气体管道并检查管道的气密性。为了保证催化剂充分反应,将管式炉竖立起来,气体从石英管下部通入。在实验之前先通入氮气吹扫排尽气路中的空气,随后通入氢氩混合气(V(H2):V(Ar)=20:80),催化剂在氢气气氛下保持600°C还原2 h,随后用氮气吹扫10 min以排空管内残余气体。通入丙烷和空气的混合气(丙烷40 mL/min、空气285 mL/min),在600 °C下发生部分氧化重整反应。重整后的合成气先通过冷却装置除去水分,再通过变色硅胶干燥,用1 L的集气袋收集干燥后的合成气。通过离线气相色谱(GC-2014C)测定重整产物合成气的组分,离线气相色谱配备有热导检测器(TCD)和5A分子筛填充柱,系统载气为氩气。气相色谱仪与工作站相连接,使用外标法对检测气体进行定性和定量分析。氢气选择性和含碳产物的选择性值分别用如下公式计算:

式中,Si表示相应产物的选择性,%;Fi_in和Fi_out表示为相应产物入口和出口的流量,mL/min;ni代表从丙烷产生的含碳产物的总化学计量因子。
1.4 催化剂的表征
采用X射线衍射仪(XRD)表征氧化铈载体和退火后催化剂的物相,Cu靶Kα射线(λ=0.15406 nm),管电压40 kV,管电流13 mA,扫描范围20°~80°,扫描速率5(°)/min。利用扫描电子显微镜(SEM)对催化剂的形貌进行表征,表征前为了增强样品导电性使用电子溅射铂金60 s,表征时设置加速电压10 kV,并使用能谱仪(EDS)对催化剂的元素进行分析。采用透射电子显微镜(TEM)研究催化剂使用后形貌,加速电压200 kV。结合热重分析仪(TG)研究催化剂使用后沉积的碳物质,测试条件为:在空气氛围下进行程序升温,升温速率为10 °C/min,温度区间50~800 °C。
因此,人的发展有其物质基础,社会生产力的发展是人的发展的必要前提和根本动力。“历史的每一阶段都遇到一定的物质结果,一定的生产力总和” [1]544,生产力的发展是不可或缺的实际前提,作为先在前提条件体现着社会发展对人的根本制约。离开生产力发展状况和物质生产条件去谈论人的发展,必然无法揭示人的发展的活动构成,因为“个人是什么样的,这取决于他们进行生产的物质条件”[4]147。当人从自己的目的出发,将其本质力量对象化于自然界时,这种能力本身决定于人们先前已经获得的生产力。
2 结果与讨论
2.1 催化性能的影响因素
2.1.1 制备方法
不同制备方法对Ni-CeO2催化剂性能影响结果如图2所示。由图2可知,使用溶胶-凝胶法制备的Ni-CeO2催化剂表现出最高的催化活性,其氢气产率稳定在220 μmol/(g·s)左右,其次是浸渍法制备的Ni-CeO2-CI催化剂稳定在190 μmol/(g·s),最后是共沉淀法制备的Ni-CeO2-CP催化剂只有150 μmol/(g·s)。这可能是因为溶胶-凝胶法在制备过程中形成了凝胶状态,这一过程有利于Ni的活性组分均匀分散在氧化铈的载体上,从而使催化活性提升。所有制备方法制备的催化剂性能都是在0~5 min内上升,然后在5 min左右出现一个峰值,而后保持稳定。这可能是因为刚通丙烷和空气的一段时间内气体和催化剂之间的反应不是很充分,随着反应的进行,全部催化剂参与反应,氢气产率提高。总之,不同制备方法制备的催化剂性能不同,溶胶-凝胶法制备的催化性能最佳。

图2 不同制备方法对催化剂产氢率的影响
2.1.2 镍负载量
不同的负载量对Ni-CeO2催化剂性能影响结果如图3所示。从图3可知,随着镍的负载量从1%到15%,催化剂的性能变得越来越好。这主要是因为镍在催化剂中是以活性组分的形式存在的,镍的含量越高,催化性能越好。而氧化铈是以催化剂载体的形式存在,并不直接影响性能的好坏。此外,虽然镍的负载量达到10%以后,随着负载量的增加,催化剂的性能还会有所提升,但提升幅度相较于低负载量时低。这可能是由于低负载量时,随着负载量的增加,氧化铈的表面积能够承受镍颗粒的均匀分布,而高于10%以后,氧化铈的表面积不足以承受增加的镍颗粒,导致镍的堆积,使催化剂的性能相较于低负载来说提升不是十分显著。

图3 不同镍的负载量对催化剂产氢率的影响
2.1.3 重整温度

图4 反应温度对催化剂产氢率(a)、各组分气体选择性(b)和气体组成分布(c)的影响
2.2 催化剂的表征
采用XRD和EDS对CeO2载体和10% NiO-CeO2催化剂进行表征,如图5所示。由图5(a)看出,合成的CeO2载体颗粒纯度高,证实了氧化铈的萤石结构类型的存在(空间群:Fm3m)。与图5(a)相比,图5(b)在37.2°,43.2°和62.8°处的三个衍射峰分别被标识为NiO的(111)、(200)和(220)结晶相。NiO衍射峰强度弱,表明CeO2载体上NiO含量低或分散高[17],B样品NiO衍射峰相对A和C较弱,说明NiO具有较高的分散度,从而使其催化产氢性能较佳。
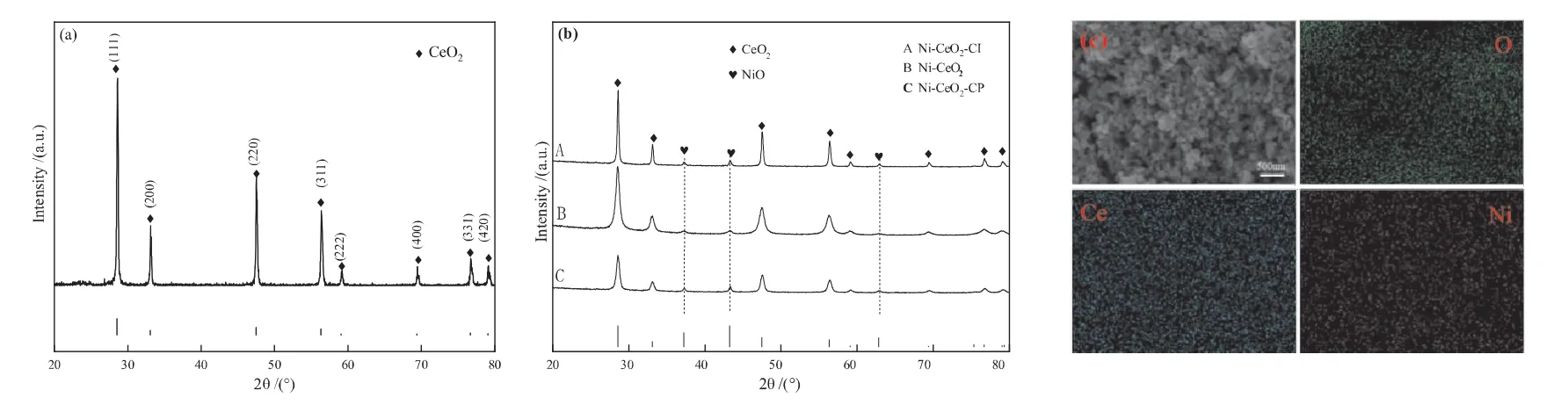
图5 CeO2载体XRD(a),Ni-CeO2催化剂XRD(b)和EDS分析(c)
为了进一步证实催化剂中NiO的存在,对样品进行的EDS能谱分析。从图5(c)中可以看出,Ni元素是均匀分布的,说明负载的氧化镍颗粒分散度高。
采用FESEM对催化剂重整前后进行了表面形貌分析,结果如图6所示。从图6(a)和6(b)可以看出,Ni-CeO2催化剂表现出致密状态,并且颗粒间相互聚集成小颗粒。另外,从图像中可以观察到颗粒之间出现了一些微米级别的孔洞。这些多孔结构是颗粒形状和尺寸的差异导致颗粒之间的堆积形成的[18,19]。图6(c)是重整后催化剂的SEM形貌图,可以看出长而细的纤维在Ni-CeO2上生长,并相互缠结在一起彼此相互作用,碳纤维的生长方向是随机的,并且其直径相对均匀。图6(d)是重整后催化剂的TEM图,表明碳纤维以碳纳米管的形式存在。纳米管直径约为60 nm,壁厚介于8~17 nm之间。产生的纳米管相互作用可能会导致催化剂结构塌陷,塌陷的碳覆盖镍物种,导致催化剂失活[20]。

图6 Ni-CeO2催化剂重整前的SEM图(a)、(b),重整后的SEM图(c)及TEM图(d)
2.3 催化剂的再利用
在高温空气环境下对重整后的催化剂进行煅烧,能氧化催化剂上沉积的碳纳米管,生成二氧化碳,从而达到去除积炭使催化剂重复使用的目的。通过一次重整后热重分析发现,大部分的热重损失出现在450~550 °C区间,为了充分去除催化剂表面的碳又不破坏催化剂的结构,确定煅烧实验方案如下:取部分一次重整后的Ni-CeO2催化剂置于马弗炉中,5°C/min的升温速率程序升温至600 °C,在600 °C保温4 h,得到Ni-CeO2-2催化剂;Ni-CeO2-2催化剂再次进行重整,得到二次重整后的催化剂,再重复上述煅烧步骤,此重整-煅烧过程重复三次。
图7 (a)是Ni-CeO2催化剂三次重整的性能对比。从图中可以看出,随着重整次数的增加,催化剂产氢性能呈下降的趋势,这可能是因为多次重整/煅烧对催化剂的整体结构有一定的破坏,从而造成性能下降。对每次重整后的Ni-CeO2催化剂取少量进行热重分析,以进一步研究重复使用的催化剂碳沉积现象。从图7(b)可以看出,样品的质量损失主要归因于沉积炭的去除。实际上,在300 °C之前的初始重量损失是由H2O和CO2的热脱附以及除去易氧化的碳质物质(如无定形碳)引起的。温度高于500 °C时的质量损失主要归因于晶须焦炭的气化,其中通过焦炭的氧化生成CO和CO2(COx),而石墨碳最有可能在750 °C以上被氧化[21]。此外,随着催化剂重复使用次数的增加,放热峰向高温方向移动,催化剂失重减少,说明碳沉积随着重复次数的增加而减少,这可能是因为多次重整/煅烧过程中发生了碳物质之间的晶型转化。
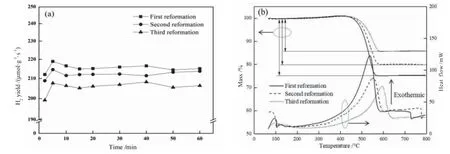
图7 Ni-CeO2催化剂重复使用三次后性能对比(a)和热重分析(b)
3 结论
本文进行了丙烷部分氧化重整制氢的研究,首先使用水热法制备了CeO2载体,再用不同的方法制备了Ni-CeO2催化剂,进而研究了制备方法、活性组分负载量及重整温度对催化剂催化性能的影响。结果表明,在使用溶胶-凝胶法,镍负载量为10%、重整温度为600 °C的条件下,催化剂重整性能最佳,氢气产率约为220 μmol/(g·s),重整气体中H2的含量高达48%(体积分数)。在600 °C的空气氛围下煅烧,可除去催化剂上大部分的沉积炭,从而实现了催化剂的重复利用。随着重整次数的增加,催化剂性能呈现下降的趋势,热重分析表明,催化剂碳沉积的量在减少,放热峰有向高温方向移动的趋势。
