D-乳酸、二胺氧化酶在早期诊断重型颅脑损伤患者合并急性胃肠损伤中的价值分析▲
2021-09-14裴明毓石磊朱瑞凯吕立文陈万
裴明毓 石磊 朱瑞凯 吕立文 陈万
广西壮族自治区人民医院急诊科,南宁市 530021
重型颅脑损伤(severe head injury, SHI)患者的中枢神经功能受损,其机体神经、内分泌和胃肠动力学功能紊乱,胃肠道屏障功能受损,易出现急性胃黏膜损伤乃至胃肠功能障碍,发生急性胃肠损伤(Acute gastrointestinal injury,AGI)[1]。AGI是导致患者多脏器功能衰竭(Multiple organ failure,MOF)的始动环节[2],而MOF是重型颅脑损伤患者预后不良的重要原因[3]。由于颅脑损伤患者经常出现昏迷、使用镇静药物等情况,因此临床上对危重患者AGI的诊断较为困难,目前尚缺乏特异性量化指标,导致AGI的及时诊断和治疗受到严重影响[4]。研究发现[2,4-6],患者的血液D-乳酸浓度与其肠黏膜屏障受损严重程度呈正相关;二胺氧化酶(DAO)来自肠黏膜细胞,肠黏膜损伤患者早期DAO特异性升高,两者均可作为脓毒症患者早期肠道损伤诊断指标。为探讨D-乳酸、DAO在早期诊断重型颅脑损伤合并AGI的价值,本研究选取86例重型颅脑损伤患者为研究对象进行了相关的检测分析,现将结果报告如下。
1 资料与方法
1.1 一般材料 选取2017年1月至2020年6月在广西壮族自治区人民医院急诊监护病房住院治疗的重型颅脑损伤患者86例为研究对象。纳入标准:(1)符合重型颅脑损伤诊断标准[8],经临床检查、颅脑CT检查确诊;(2)格拉斯哥昏迷评分(GCS)3~8分;(3)行颅内血肿清除+去骨瓣减压术治疗;(4)既往无消化道手术史。排除标准:(1)入院24 h死亡或脑死亡;(2)合并严重的胸、腹部联合伤及其他脏器损伤;(3)既往有消化道肿瘤、炎性及功能性肠病、机械性肠梗阻病史;(4)血流动力学不稳定。纳入研究的患者中男59例、女27例;年龄19~71岁,平均(48.37±18.44)岁;颅骨骨折合并硬膜下血肿46例、硬膜下血肿合并脑内血肿22例、硬膜下/外血肿合并弥漫性轴索损伤15例、硬膜下血肿合并硬膜外血肿3例。根据入院72 h是否出现AGI分为AGI组及非AGI组。
1.2 治疗概况 入院后常规给予抗感染、脱水降颅压、营养神经、预防性应用质子泵抑制剂及胃动力药物等治疗;采用统一胃肠功能保护策略,对患者进行早期肠内营养支持治疗,根据患者血流动力学变化及血管活性药物使用情况,逐渐由肠外营养过渡到肠内营养支持,逐步增加饮食量[9]。
1.3 胃肠功能的监测与评估 参照2012年欧洲危重病学会AGI诊断及分级指南[7]对患者进行AGI诊断及分级。(1)AGIⅠ级(存在胃肠道功能障碍和衰竭的危险因素):有明确病因,胃肠道功能部分受损;具有暂时性和自限性特点。(2)AGI Ⅱ级(胃肠功能障碍):胃肠道不具备完整的消化和吸收功能,无法满足机体对营养物质和水的需求;胃肠功能障碍未影响患者一般状况;表现为胃轻瘫伴有大量胃潴留或反流、下消化道麻痹、腹泻、腹腔内高压(IAH)Ⅰ级(腹腔内压12~15 mmHg)、食物不耐受[尝试肠内营养途径72 h未达到20 kcal/(kg·d)目标],经积极干预处理(红霉素、放置幽门后管等)可改善。(3)AGI Ⅲ级(胃肠功能衰竭):干预处理后,胃肠功能仍不能恢复,一般状况没有改善;出现持续食物不耐受,即大量胃潴留、持续胃肠道麻痹、肠管扩张、腹腔内高压进展至Ⅱ级(腹腔内压15~20 mmHg)、腹腔灌注压下降(<60 mmHg)。(4)AGI Ⅳ级(胃肠功能衰竭伴有远隔器官功能障碍):为AGI进展至直接危及生命安全的状态,患者发生多器官功能障碍综合征(MODS)和休克,随时有生命危险。
1.4 观察指标
1.4.1 一般资料 比较AGI组及非AGI组患者的年龄、颅脑损伤类型、部位、腹腔内压(intra-abdominal Pressure, IAP)等指标情况。
1.4.2 SOFA及APACHE Ⅱ评分 比较AGI组及非AGI组患者全身性感染相关性器官功能衰竭评分(SOFA评分)、急性生理与慢性健康评分Ⅱ(APACHE Ⅱ)。
1.4.3 DAO、D-乳酸水平 患者入院后抽取静脉血2 mL,离心分离血清,采用ELISA法检测比较AGI组及非AGI组患者的DAO、D-乳酸水平。
1.5 统计学处理 应用SPSS 22.0统计学软件进行数据分析。计量数据以x±s表示,两组间均数的比较采用t检验;计数资料以%表示,组间比较采用χ2检验。绘制根据D-乳酸、DAO水平诊断重型颅脑损伤患者发生AGI的ROC曲线并进行分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 AGI组与非AGI组患者的一般情况、DAO水平、D-乳酸水平等比较 入院后72 h,86例重型颅脑损伤患者中发生AGI 58例(AGI组,AGIⅠ级20例,AGIⅡ级27例,AGIⅢ级11例),发生率为67.44%。AGI组与非AGI组(未发生AGI,共 28例)患者的性别、年龄、BMI、APACHE Ⅱ、GCS评分、平均动脉压(MAP)、血红蛋白、氧合指数比较,差异无统计学意义(P>0.05);AGI组患者的DAO水平、D-乳酸水平、IAP显著高于非AGI组患者,差异有统计学意义(P<0.05)。见表1。

表1 AGI组与非AGI组患者的一般情况、DAO、D-乳酸水平水平等比较 (n,x±s)
2.2 绘制ROC曲线 绘制根据D-乳酸、DAO水平诊断重型颅脑损伤患者发生AGI的ROC曲线。分析结果显示,根据D-乳酸水平诊断重型颅脑损伤患者发生AGI的曲线下面积(AUC)为0.875,D-乳酸诊断界值为18.81 mg/mL时,诊断的灵敏度为94.80%,特异度为67.90%;根据DAO水平诊断重型颅脑损伤患者发生AGI的AUC为0.848,DAO的诊断界值为9.66 mg/mL时,诊断的灵敏度为93.10%,特异度为78.60%。见图1。
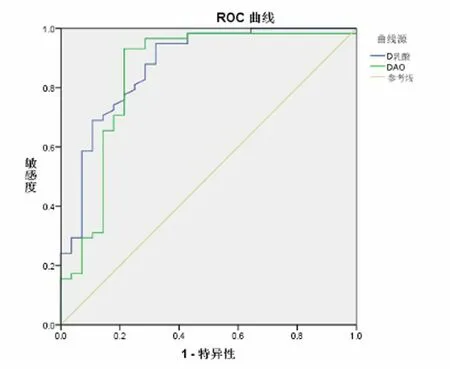
图1 根据D-乳酸、DAO水平诊断重型颅脑
3 讨 论
肠道是免疫防疫、消化吸收及分泌排泄的重要器官,急性胃肠功能损伤是重型颅脑损伤患者的常见并发症,其发生机制尚未完全明确,可能与患者的神经应激、代谢异常、肠道吸收功能障碍等有关[10-12]。正常肠黏膜有屏障功能,可充分阻断肠道吸收毒素,避免电解质和水分的丢失,抑制微生物和抗原进入体内[13]。重型颅脑损伤患者的神经应激等因素会引起内脏血管旋转性收缩,导致胃肠道缺血、上皮坏死及脱落,损伤肠道屏障功能。患者肠道吸收功能障碍及代谢异常会诱发肠道菌群失调及细菌移位,破坏胃肠道内微生态平衡[14-15]。胃肠道屏障功能损伤是脓毒症患者多脏器功能衰竭发生、发展的中心环节[16-17]。近年来,尽管对重型颅脑损伤患者所进行的器官功能支持及抗感染治疗手段得到了长足的发展,但因重型颅脑损伤所引发的脓毒症多器官功能障碍仍是导致患者死亡的重要原因[18]。
与其他器官损伤相比,肠道损伤的诊断缺乏血清学精细化指标,目前临床仍主要根据2012年欧洲危重病学会提出的AGI诊断及分级指南,根据患者临床症状和体征作出判断,因此主观性较强,客观性较差[19]。一些研究结果显示,血清瓜氨酸(citrulline,CIT)、肠型脂肪酸结合蛋白(intestinal type fatty acid binding protein,IFABP)等血清指标与危重症患者的肠道功能的关系密切,但影响因素较多[20-21]。及时、准确诊断危重症患者胃肠道功能损伤,可及时预警,指导临床治疗,改善预后。
本研究通过检测分析发现,重型颅脑损伤患者胃肠道损伤的发生率为67.44%,胃肠道损伤患者的IAP、D-乳酸、DAO水平显著升高。IAP是诊断AGI及分级的重要临床依据,是AGI患者院内死亡的重要因素,IAP水平与危重病患者病情的严重程度和预后密切相关。DAO是小肠黏膜上层绒毛中具有高度活性的细胞内酶,其活性与黏膜细胞的核酸和蛋白合成密切相关,能够反映出肠道机械屏障的完整性和受损伤程度。DAO在外周血中的活性稳定,患者肠黏膜上皮细胞受损后,DAO被吸收入血,肠腔和血浆中DAO的浓度增加,可用于评价肠黏膜上皮细胞的受损情况[4-6,11,14]。本研究根据IAP、D-乳酸、DAO在重型颅脑损伤患者胃肠道损伤中的密切关系,绘制根据D-乳酸、DAO水平诊断重型颅脑损伤患者发生AGI的ROC曲线。分析结果显示,根据D-乳酸诊断重型颅脑损伤患者发生AGI的曲线下面积为0.875,D-乳酸诊断界值为18.81 mg/mL时,诊断的灵敏度为94.80%,特异度为67.90%;根据DAO水平诊断重型颅脑损伤患者发生AGI的曲线下面积为0.848,DAO的诊断界值为9.66 mg/mL时,诊断的灵敏度为93.10%,特异度为78.60%。由此可见,D-乳酸、DAO水平可作为诊断重型颅脑损伤患者发生AGI的较好指标。
